响应面法优化球孢白僵菌CXJ-1的发酵工艺条件
2011-01-08孙佰平任娟赵思峰侯彩霞王斌刘启鹏
孙佰平,任娟,赵思峰,侯彩霞,王斌,刘启鹏
(1新疆兵团化工绿色过程重点实验室,石河子832003;2石河子大学绿洲农作物病害防控重点实验室,石河子832003)
响应面法优化球孢白僵菌CXJ-1的发酵工艺条件
孙佰平1,2,任娟2,赵思峰2,侯彩霞2,王斌2,刘启鹏2
(1新疆兵团化工绿色过程重点实验室,石河子832003;2石河子大学绿洲农作物病害防控重点实验室,石河子832003)
为了提高球孢白僵菌CXJ-1(Beauveria bassiana CXJ-1)在液体发酵过程中分生孢子的产孢量,采用响应面法对球孢白僵菌CXJ-1产孢的发酵工艺条件进行优化。采用单因素实验确定了产孢发酵条件最适初始pH、发酵转速和发酵温度。通过Plackett-Burman实验设计和Box-Behnken实验设计响应面分析优化,确定了球孢白僵菌CXJ-1产孢最佳发酵工艺参数为:温度28.07℃,转速198.95r/min,初始pH 6.10,预测孢子浓度可达9.5×108个/mL,在优化发酵条件下进行验证实验,孢子浓度达到9.7×108个/mL,表明验证值和预测值有较高的吻合度。
球孢白僵菌;响应面优化;发酵工艺条件;产孢
球孢白僵菌(Beauveria bassiana)是一种昆虫病原真菌,可通过寄主表皮侵入寄主,已被广泛用于防治咀嚼式和刺吸式口器害虫[1-2],其具有安全有效、容易大量生产等优点,在害虫综合治理系统中占有越来越重要的地位。球孢白僵菌主要靠分生孢子在昆虫体表萌发后侵入昆虫体内而发挥杀虫效能,因此生产高活力的分生孢子是研制真菌杀虫剂的前提。
随着球孢白僵菌生物杀虫剂需求量的不断增加,人们对球孢白僵菌的发酵方式和发酵培养方法开展了大量研究,季香云等[3]研究表明加有土样成分配方可降低球孢白僵菌的生产成本;谢翎等[4]利用大米固态发酵培养可提高球孢白僵菌的产孢量,然而在白僵菌发酵过程中能影响发酵产孢量的因素除了发酵方式和培养方法以外,发酵工艺条件对球孢白僵菌的产孢影响也尤为重要。球孢白僵菌的芽生孢子、分生孢子和菌丝体侵染体均可以侵染昆虫,其中液体深层发酵产生的液生孢子与气生分生孢子类似[5],因此通过优化发酵工艺条件来提高白僵菌活性孢子量也是生产球孢白僵菌生防制剂的重要途径之一。
传统优化发酵工艺的方法较多,有单因素法、正交实验法、模糊逻辑学法和数学统计方法等[6-7],这些方法不但费时费力,而且常常忽略因子之间的交互作用,从而使得优化结果不大理想[8],往往不能达到真正的优化。而响应面法是微生物发酵工艺优化中常用的方法之一,它可建立连续的三维变量曲面模型,由此能反映出单因素和多种因素间的交互作用对微生物生长的影响[9],因此被认为是较为准确可靠的优化方法[10-11]。
本研究首先通过单因素试验明确产孢发酵条件最适初始pH、发酵转速和发酵温,之后通过PB试验明确了三因素对产孢量的影响大小,并且由此得出优化的基本条件,再由最陡爬坡试验逼近了三因素产孢量的最佳水平域,最后采用中心组合实验设计(CCD)得出发酵条件最优点,且较为系统考察了各个因素之间的交互作用,旨在为球孢白僵菌生防菌剂的开发提供技术支持。
1 材料与方法
1.1 材料
1.1.1 供试菌株
球孢白僵菌CXJ-1(Beauveria bassiana CXJ-1)分离于新疆因白僵菌严重侵染致死的悬灯蛾体内,经鉴定为球孢白僵菌,保藏于石河子大学绿洲农作物病害防控重点实验室,将保存好的菌种,接种到PDA平板上,活化备用。
1.1.2 所用培养基
PDA培养基:马铃薯200g;葡萄糖20g;琼脂15~20g;蒸馏水1000mL,0.1Mpa灭菌20min。Czapek培养基 (察氏培养基):NaNO33.00g;K2HPO4·3H2O 1.00g;MgSO4·7H2O 0.50g;KCl 0.50g;FeSO4·7H2O 0.01g;蔗糖30.00g;蒸馏水1000mL,pH 7.0,0.1Mpa灭菌20min。
1.2 方法
1.2.1 菌种的活化和培养方法
将保藏的球孢白僵菌CXJ-1菌种接种于PDA平板上,置于培养箱中28℃下培养4d,备用。
1.2.2 培养方法
将直径为5mm菌碟接种到含有100mL已灭菌的察氏培养基的250mL的三角瓶中,置于28℃,200r/min摇床培养3d。
1.2.3 孢子数量的测定
将已摇好的发酵液用4层灭菌纱布过滤出去菌丝,并用灭菌蒸馏水稀释滤液100倍,之后进行孢子计数,孢子数量通过血球板计数法测定[12]。
1.3 试验设计
1.3.1 单因素试验
影响球孢白僵菌产孢量的因素很多,本试验选取对产孢量影响最大的3个因素,即初始pH、培养温度和摇瓶转速进行发酵条件优化。
1.3.1.1 培养温度对产孢影响
以Czapek培养基为发酵培养基,在pH 7.0,200r/min条件下,灭菌冷却后接入直径为5mm菌碟,之后分别置于24、26、28、30及32℃5个待测温度的摇床上摇培3d,最后进行孢子浓度的测定。每组试验设置3个重复,最后取试验结果数据的平均值。
1.3.1.2 初始pH 对产孢影响
以Czapek培养基为发酵培养基,28℃、200r/min条件下,在灭菌前将发酵培养基pH调为4.0、5.0、6.0、7.0和8.0五个试验值,灭菌冷却后接入直径为5mm菌碟摇培3d,然后进行孢子浓度的测定。每组试验设置3个重复,最后取试验结果数据的平均值。
1.3.1.3 摇瓶转速对产孢影响
以Czapek培养基为发酵培养基,在28℃、pH 6.0条件下,灭菌冷却后接入直径为5mm菌碟,之后分别置于140、160、180、200及220r/min 5个待测转速的摇床上摇培3d,最后进行孢子浓度的测定。每组试验设置3个重复,最后取试验结果数据的平均值。
1.3.2 Plackett-Burman(PB)设计
Plackett-Burman设计基于非完全平衡块原理,能快速准确估计出主效因素和主效因素次序,以供进一步研究。本实验在单因素实验基础上用该方法对pH(X1)、发酵温度(X2)和转速(X3)3种因素考察它们对产孢量影响的大小,选用N=15的Plackett-Burman设计表,其中安排3个空项作误差分析,各个参数代表因子及其水平见表1。每个试验均摇培3d,最后进行孢子浓度的测定。每组试验设置3个重复,最后取试验结果数据取平均值。
1.3.3 最陡爬坡试验
响应拟合方程只能在临近区域才能近似真实情形,在其他区域无法建立有效的响应面拟合方程。根据PB试验结果拟合出一阶模型,由该模型回归系数符号和大小来设计显著因素爬坡方向和步长,最后逼近最优响应区域。
1.3.4 中心组合试验
由单因素试验得出最适培养温度、初始pH和摇瓶转速后,采用旋转中心组合设计法(Central composite rotatable design,CCD)对培养条件进行进一步优化[13]。CCD试验总数为2K+2K+n0,公式中K代表自变量总数,n0代表中心点试验自变量xi按
xi=(Xi-X0)/ΔXi,i=1,2,3,… , (1)式(1)中:xi为自变量Xi的编码值,X0为自变量Xi在中心点的值,ΔXi为自变量变化步长[14]。
用多项式回归分析对实验数据进行拟合,得到二次多项式,该多项式描述响应值与自变量关系的经验模型,多项式回归模型表达式:
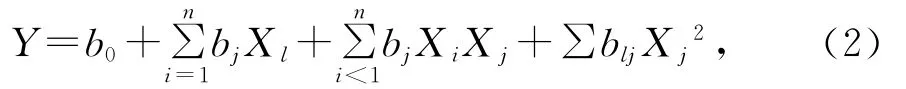
式(2)中,Y 为响应值,Xj为变量,b0为常数,bj为一次项回归系数,bij为互作回归系数,bij为二次项回归系数。利用Design Expert软件,采用Box-Behnken法进行中心组合设计[15],每个因素取3个水平:±α(轴向点),±1(因素点)和中心点。根据相应实验设计进行实验后,对实验结果进行二次回归拟合和数据分析。
2 结果与分析
2.1 单因素试验
培养温度、最初pH和摇瓶转速对球孢白僵菌产孢量有不同的影响(图1)。
从图1可看出,球孢白僵菌在26~32℃时均有较高的产孢量,在26~28℃,孢子浓度随着温度的上升而上升,当到达28℃时达到最大孢子浓度5.8×108个/mL,之后孢子浓度与温度的上升成反相关关系。因此最佳产孢培养温度为28℃。在最适温度的基础上进行最适pH测定,试验结果表明,在pH为5.0~8.0,白僵菌均能产生大量的孢子,孢子浓度随着pH的增高而逐渐上升,当pH为6时白僵菌孢子浓度达到最大,为9.0×108个/mL,当pH大于6.0时,孢子浓度随pH的增加而呈现递减趋势。因此确定球孢白僵菌产孢的最适pH为6.0。在最适培养温度和最适初始pH条件下,进行最适转速的确定,当转速为140r/min时,球孢白僵菌生长缓慢,当转速逐渐提高时,球孢白僵菌产孢量开始逐渐上升,转速为200r/min时,产孢浓度达到最大值9.3×108个/mL,继续增加转速,孢子开始呈现下降趋势,由此确定球孢白僵菌最适产孢转速为200r/min。为了进一步提高产孢量,结合以上试验结果进行中心组合试验。

图1 培养温度、初始pH和摇瓶转速对产孢的影响Fig.1Individual effect of incubation temperature,pH and flask speed on the spore yields
2.2 PB试验设计
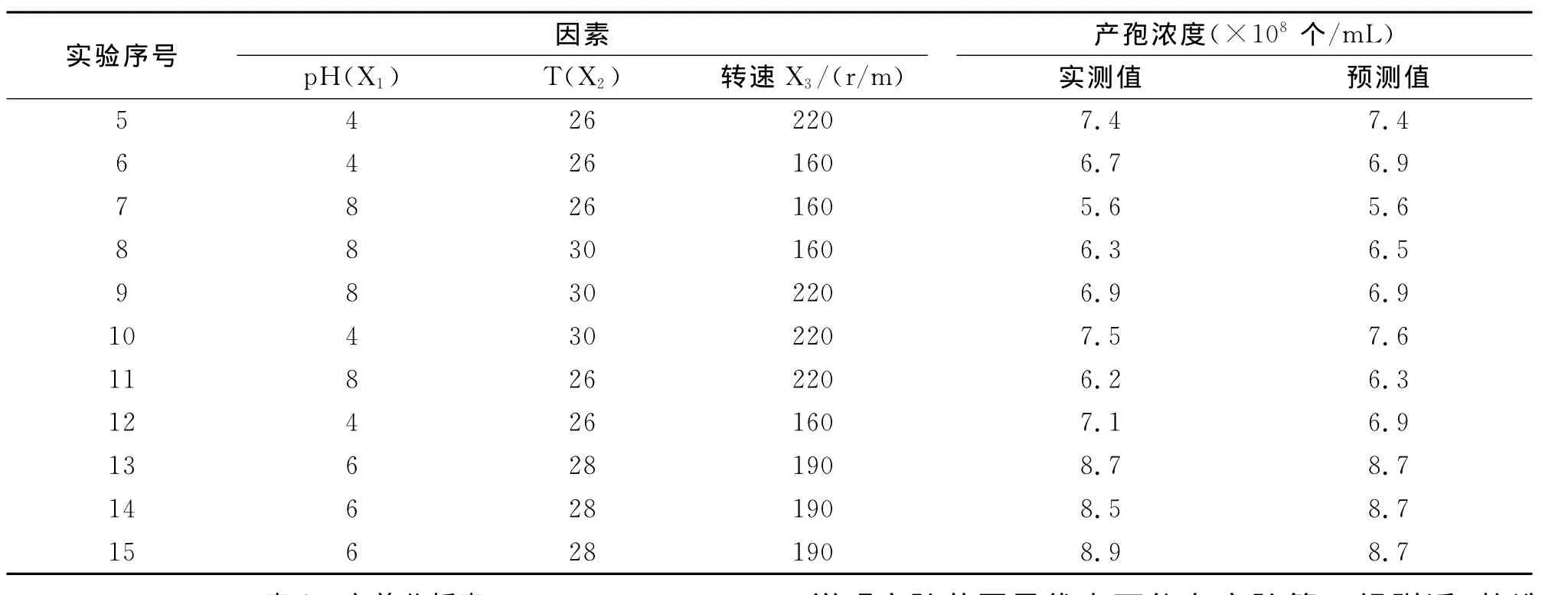
将单因素试验筛选出的最适pH、温度和转速进行PB设计,PB实验设计和结果如表1。
通过Design-Exper 7.0软件对表1实验结果数据进行方差分析,结果如表2。由表2可知,pH(P=0.0001)、温度(P=0.0056)和转速(P=0.0056)三因子对产孢的影响均在90%概率水平上差异性明显。剔除不显著因子,通过逐步回归得到如下方程:
Y=0.68-0.048X1+0.026X2+0.026X3, (3)式(3)中,Y为球孢白僵菌CXJ-1孢子浓度的预测值;X1、X2和X3分别为pH、温度和转速的编码值。以pH、温度和转速3个因子系数的正负值为爬坡的方向,在PB试验中第15组为基础进行爬坡试验。

表1 PB实验设计的变量与水平取值及实验结果Tab.1The variations and levels of Plackett-Burman design and its result
续表1

表2 方差分析表Tab.2ANOVA of Plackett-Burman design
2.3 最陡爬坡实验
最陡爬坡试验设计及结果见表3。
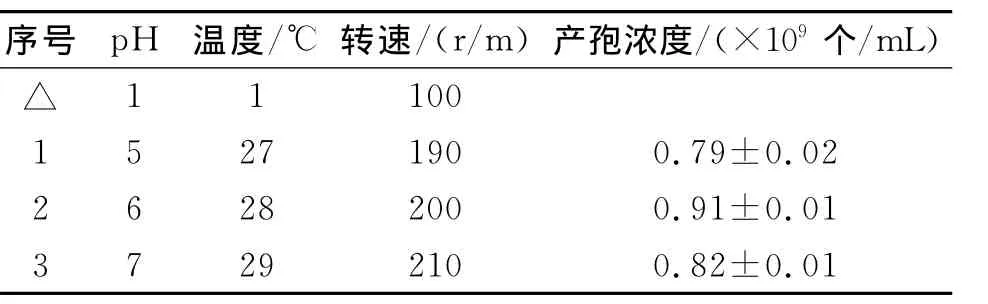
表3 最陡爬坡试验设计Tab.3Steepest ascent coordination path for all chosen factors at actual levels
由表3可知,X1、X2和X3三个因子浓度在试验第2组附近时球孢白僵菌CXJ-1孢子浓度最高,说明实验范围最优点可能在实验第2组附近,故选择第2组中三因子浓度作为中心组合实验设计的中心点。
2.4 中心组合试验
通过单因素试验和PB试验,大体上了解各个工艺参数对孢子浓度的影响。然而影响球孢白僵菌产孢的因素并不是孤立发生作用,它们之间共同发生作用,最终影响球孢白僵菌的产孢量。采用Box-Benhnken中心组合设计,以培养温度、初始pH和摇瓶转速为自变量,且分别以X1,X2和X3表示,以球孢白僵菌孢子浓度为因变量,即响应值,设计三因素三水平相应分析试验,三水平的高、中、低分别用-1,0,1表示。具体编码水平如表4所示,中心组合试验方案及其试验结果如表5所示。

表4 Box-Behnken响应面设计试验因素水平和编码Tab.4Variables and levels in response surface design
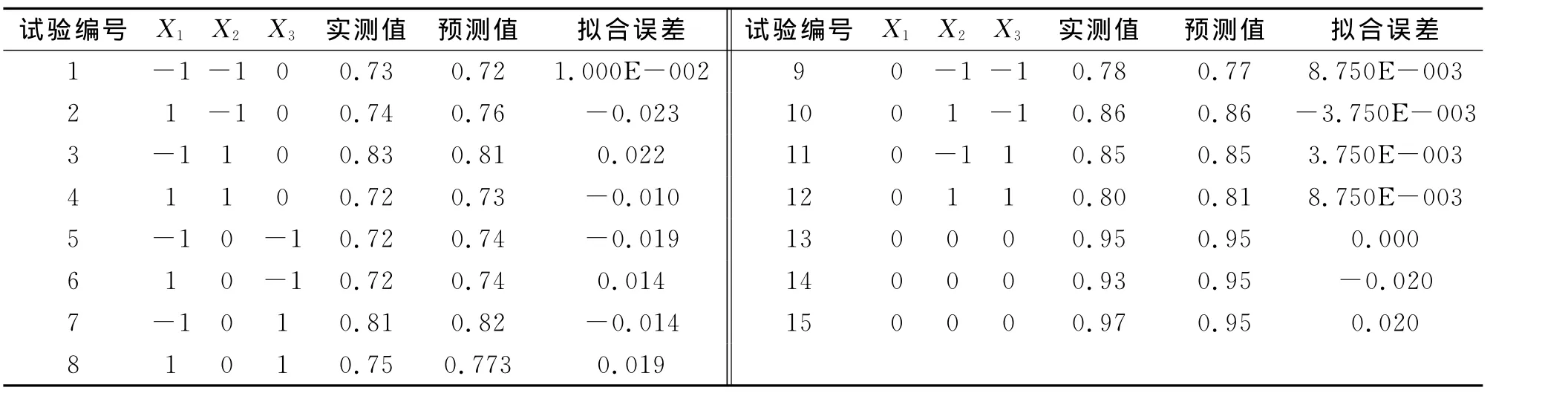
表5 响应面试验设计及结果Tab.5Experimental design and results of response surface methodology
通过Design Expert 7.0软件对实验结果进行多元回归分析,可以得出球孢白僵菌孢子产量的二阶模型,剔除不显著项,方程表示如下:
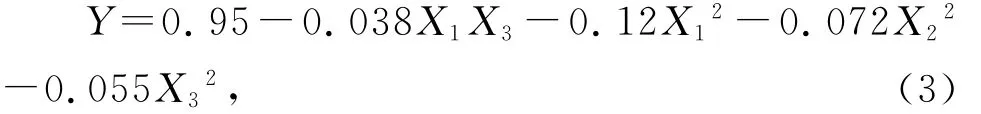
式(3)中:Y为球孢白僵菌CXJ-1产孢浓度预测值,X1、X2和X3分别为培养温度、pH和摇瓶转速的编码值,二次项和交互项系数均为负值,可认为二次项和交互项方程主要对产孢浓度起负作用。
F检验反应回归模型的有效性,其包括失拟性检验等。方差分析结果见表6。由表6可知:上述模型可描述各因子与响应值之间的关系,模型P<0.05,表明该回归模型显著;失拟项P=2.06,不显著;相关系数R2=0.9657,说明该模型拟合度良好,试验误差较小,R2Adj=0.9040,表明上述模型可以解释90.40%响应值的变化,由上述可知通过此模型可分析和预测球孢白僵菌的产孢浓度。另外,X1和X3的交互作用(P<0.05)与其他交互作用相比达到显著水平,X12、X22和X32对产孢浓度的影响也极为显著(P<0.01)。
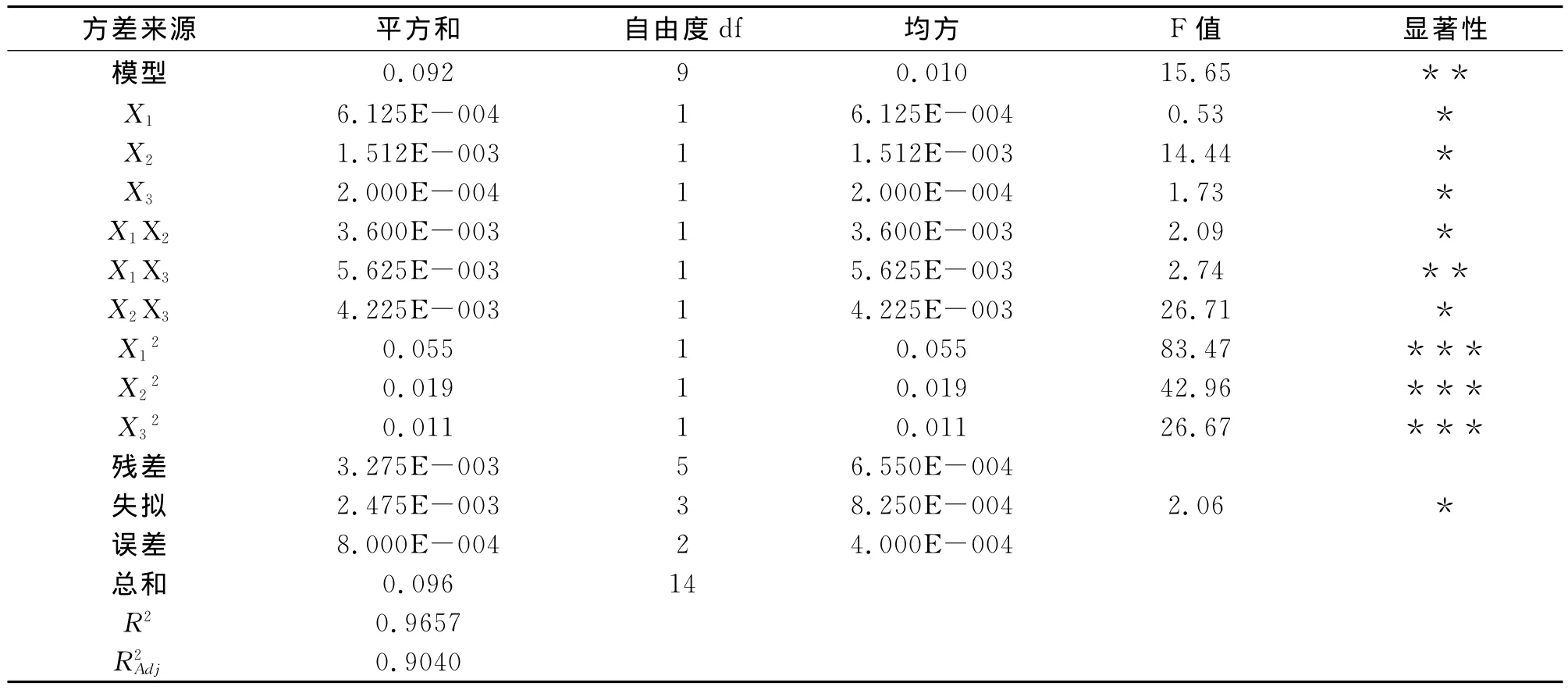
表6 孢子产量预测回归模型的方差分析Tab.6Analysis of variance(ANOVA)for regression equation
2.5 两因素之间的交互作用分析
由式(3)所作的响应面图和等高线图见图2~4,各个因素及其交互作用对产孢浓度的影响结果可通过响应面图和等高线图直观的反映出来。可从等高线形状反映交互作用的强弱,即越是椭圆形表示两因素交互作用越显著,反之越是标准圆形则表示交互作用不显著[16]。
由图2~4可知,随着初始pH、培养温度和摇瓶转速的增加,孢子浓度的增加呈现先逐渐增大后开始下降的趋势。通过对模型拟合分析,得出球孢白僵菌CXJ-1最佳产孢发酵工艺:初始pH值6.10;培养温度28.07℃;摇瓶转速198.95r/min,在此条件下预测孢子浓度为9.5×108个/mL。

图2 培养温度和摇瓶转速对孢子浓度影响的响应面和等高线图Fig.2Response surface and contour plot showing the interactive effects of incubation temperature and flask speed on the spore yields
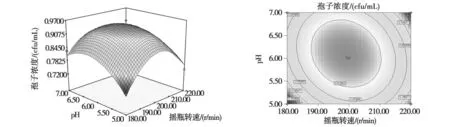
图3 pH和摇瓶转速对孢子浓度影响的响应面和等高线图Fig.3Response surface and contour plot showing the interactive effects of pH and flask speed on the spore yields
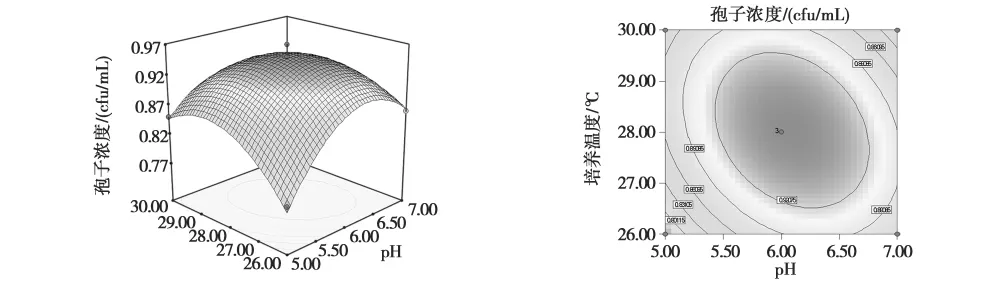
图4 培养温度和pH对孢子浓度影响的响应面和等高线图Fig.4Response surface and contour plot showing the interactive effects of incubation temperature and pH on the spore yields
2.6 模型的验证
利用分析所得的优化发酵条件,结合实际情况选择初始pH为6.1;培养温度为28.07℃;摇瓶转速为199r/min,在Czapek培养基为发酵培养基基础上进行3d的发酵试验,最后通过显微镜计数测定孢子浓度为9.7×108个/mL,与预测值极为接近,说明了该模型具有很好的预测性和可靠性。同时也证明了响应面发优化球孢白僵菌产孢工艺参数的可行性。
3 结论与讨论
本试验首先采用单因素试验,得出了产孢发酵的最适pH、温度和转速,即:最适pH 6.0,最适温度28℃,最适转速200r/m。然后通过PB法,以球孢白僵菌孢子浓度为响应值,明确了初始pH、温度和转速对球孢白僵菌产孢量的影响强弱,其中的pH(P=0.0001)对产孢影响最为显著,培养基是真菌生长的外部环境,菌丝体的生长依赖菌丝体内酶的催化作用,而pH与酶活力的关系极为密切,因而,培养基初始pH对微生物代谢具有重要作用[17]。因此,本试验结果,证明了PB方法是一种经济而有效的试验方法。
通过旋转中心组合试验得到了培养温度、pH和摇瓶转速3因子对产孢量影响的数学模型:Y=0.95-0.038X1X3-0.12X12-0.072X22-0.055X32。统计分析结果表明,该模型相关系数R2=0.9657,模型与实际情况符合很好,证明该模型能反映出3个因子对球孢白僵菌产孢量的影响。培养温度和pH的交互作用达到显著水平,且各个因子的二次效应也极为显著,说明培养温度和pH对球孢白僵菌产孢量的影响较为复杂。最后通过模型确定出最佳发酵工艺条件为:初始pH为6.10;培养温度为28.07℃;摇瓶转速为198.95r/min,在此条件下进行发酵验证,球孢白僵菌孢子浓度达到9.7×108个/mL,与优化前相比产孢量提高了16.88%。
目前,通过利用响应面法优化球孢白僵菌发酵条件的研究鲜有报道,此外对球孢白僵菌的工业化生产,还有很多方面未深入解决,传统的优化方法并不能有效解决生产中各个参数的优化,然而通过响应面法可解决生产中多变量问题,还可以对工艺中各个因子水平和交互作用进行有效评价和优化,快速确定多因子系统的最佳条件,该方法比正交试验相比更为有效,同时也证明了响应面法优化优化球孢白僵菌发酵生产工艺条件可行。
[1]Faria M.R,Wraight S P.Mycoinsecticides and mycoacaricides:a comprehensive list with worldwide coverage and international classificationof formulation types[J].Biological Control,2007,43(3):237-256.
[2]Feng M G,Poprawski T J,Khachatourians G G.Produ ction,formulation and application of the entomopathogenic fungus Beauveria bassiana for insect control:current status[J].Biocontrol Science Technology,1994,4(1):3-34.
[3]季香云,杨长举,蒋杰贤.白僵菌Bb98土壤培养法的优化[J].华中农业大学学报,2004,23(6):639-642.
[4]谢翎,陈红梅,樊美珍,等.利用大米固态发酵生产球孢白僵菌的工艺优化[J].食品和发酵工业,2007,33(10):85-88.
[5]Thomas K S,Khachatourians G G,Ngedew W M.Production and properties of Beauveria bassiana conidia cultivated in submerged culture[J].Canadian Joumal of Microbiology,1987,33(1):12-20.
[6]冯莉,张文举,于磊,等.棉粕源生物蛋白饲料底物辅料组成的优化[J].石河子大学学报:自然科学版,2011,29(2):184-188.
[7]赵洁,尹俊涛,郭亚可,等.万寿菊中叶黄素的提取皂化工艺研究[J].石河子大学学报:自然科学版,2011,29(1):71-74.
[8]Stowe R A,Mayer R P.Efficient screening of process variables[J].Ind Eng Chem,1996,58(2):36-40.
[9]Ambat P,Ayyanna C.Optimizing medium constituents and fermentation conditions for citric acid production from palmyra jaggery using response surface method[J].World Journal of Microbiology & Biotechnology,2001,17:331-335.
[10]Miller A,Sitter R R.Using the folded-over 12-run Plachett-Burman design to consider interactions[J].Technometrics,2001,43:44-54.
[11]Zhen M,Chen Q,Li H M.et al.Greater enhancement of Bacillus subtilis spore yields in submerged cultures by optimization of medium composition through statistical experimental designs[J].Appl Microbiol Biotechnol,2010,85:1353-1360.
[12]张玲.微生物实验指导[M].北京:北京交通大学出版社,2007.
[13]王仙,王祥军,曹连莆,等.大麦籽粒总黄酮超声辅助提取工艺的优化[J].石河子大学学报:自然科学版,2010,28(2):152-157.
[14]应惟娲,郝玉有,储炬,等.响应面法优化红霉素发酵培养基[J].中国抗生素杂志,2009,34(5):272-276.
[15]Liu Chuanbin,Liu Yan,Liao Wei,et al.Application of statistically-based experimental designs for the optimization of nisin production from whey[J].Biotechnology Letters,2003,25(11):877-882.
[16]王允祥,吕凤霞,陆兆新.杯伞发酵培养基的响应曲面法优化研究[J].南京农业大学学报,2004,27(3):89-94.
[17]James P D A,Edwards C.The effect of cultural conditions on growth and secondary metabolism in Streptomycesth ermovilaceus[J].FEMS Microbiol Lett,1998,52:1-6.
Optimizatiom of Fermentation Conditons for Beauveria bassiana CXJ-1Spore by Response Surface Methodology
SUN Baiping1,2,REN Juan2,ZHAO Sifeng2,HOU Caixia2,WANG Bin2,LIU Qipeng2
(1Xinjiang Bingtuan Key Laboratory for Green Processing of Chemical Engineering Shihezi 832003,China;2The key laboratory of Prevention and Control for Oasis Crop Disease,Shihezi University,Shhezi 832003,China)
Response surface methodology was used to optimize fermentation conditons in order to improve spore production of Beauveria bassiana CXJ-1.The optimum fermentation temperature,rotation speed and pH were obtained with one-factor-attime.Through Plackett-Burman experimental design and Box-Behnken experimental design for response surface optimization,the optimal conditions for spore production of Beauveria bassiana CXJ-1were also determined as follows:temperature 28.07℃,rotation speed 198.95r/min and the pH value 6.10.Under these conditions,the predicted value of the concentration of spores was 9.5×108spores/mL and the verified value was 9.7×108spores/mL,the fermentation validation showed that the experimental value have high inosculating degree to model prediction.
Beauveria bassiana;response surface optimization;fermentation conditons;sporulation
Q815
A
1007-7383(2011)06-0689-07
2011-07-21
新疆兵团重大产学研专项(2010ZX03-1),国家科技支撑计划项目(2011BAD48B02)
孙佰平(1984-),男,硕士生,专业方向为生物制剂和生化工程;e-mail:120933799@163.com。
赵思峰(1975-),男,教授,硕士生导师,从事生物农药研究;e-mail:zhsf_agr@shzu.edu.cn。
