失血性休克大鼠肠上皮细胞PGC-1基因表达改变及意义
2011-01-08李伟文陆松敏方传勤刘建仓郭素清王正国
李伟文,陆松敏,方传勤,刘建仓,郭素清,程 凤,王正国
线粒体基因组与核基因组在遗传信息表达上关系密切。调控线粒体基因表达的核转录因子过氧化物酶体增殖物激活受体γ辅激活因子-1(peroxisome proliferator-activated receptor γ coactivator-1,PGC-1)通过与调节基因表达的结合转录因子相互作用行使功能,调节核呼吸因子1(nuclear respiratory factor 1,NRF1)和NRF2等基因的表达,执行特异的细胞程序,能诱导线粒体生物合成、呼吸和生热作用[1]。PGC-1在适应性产热、线粒体生成等过程中有着重要作用[2]。国内外文献尚缺乏失血性休克时细胞PGC-1基因的表达变化规律的相关报道。本实验观察了PGC-1在失血性休克缺血缺氧条件下大鼠肠上皮细胞中表达的变化情况,以探讨核转录因子对编码呼吸链亚基的细胞核基因组和线粒体基因组表达的影响,揭示线粒体能量代谢障碍发生的原因。
材料与方法
1 采用转录-聚合酶链式反应(RT-PCR)法检测失血性休克大鼠肠上皮细胞核编码基因PGC-1mRNA的表达变化
1.1 动物模型的制作[3]健康Wistar大鼠,体重(250±20)g,由第三军医大学野战外科研究所动物实验中心提供。将36只随机等分为6组:(1)休克前组(对照组);(2)休克1小时组(HS 1小时);(3)休克2小时组(HS 2小时);(4)休克3小时组(HS 3小时);(5)休克4小时组(HS 4小时);(6)休克5小时组(HS 5小时)。动物快速放血(10分钟内)使血压降至 40mmHg(即5.32kPa),休克1、2小时组分别维持1、2小时;休克3、4、5 小时组均维持 2 小时后分别观察 1、2、3 小时。休克前组处理同上,仅不放血。
1.2 核编码基因PGC-1mRNA水平的检测 于以上各时相剖腹取小肠制备肠上皮细胞[4],参照文献[5]提取肠上皮细胞RNA,进行反转录,PCR扩增,将产物用2%琼脂糖凝胶电泳。100V,5分钟;50V,55分钟后观察并拍照。引物由宝生物工程(大连)有限公司合成。RT-PCR采用TaKaRa RNA PCR kit(AMV)宝生物工程(大连)有限公司产品。PGC-1引物
1A(bp 1945)5’-CGCAGAGAGTATGAGAAGCG-3’,
1B(bp 2179) 5’-AAGCGTCACAGGTGTAACGG-3’扩增长度 235bp β-actin引物
5’-TCATGAAGTGTGACGTTGACATCCGTAAAG-3’5’-CCTAGAAGCATTTGCGGTGCACGATGGAGG-3’扩增长度275bp
2 采用Western-blot法检测肠上皮细胞PGC-1蛋白的表达变化
2.1 主要试剂 一抗:兔抗小鼠PGC-1单克隆抗体(美国,Chemicon公司),二抗:辣根过氧化酶(HPR)标记的羊抗兔IgG(美国,Chemicon公司),二氨基联苯胺(DAB)显色试剂盒(北京中山公司),抗体稀释液(北京中山公司),低分子量蛋白Marker(上海丽珠东风生物技术公司):14.4KD~97.4KD,聚偏二氟乙烯(PVDF)膜(NENTMlife science),丽春红S(Sigma),牛血清白蛋白(Roche),细胞总蛋白裂解液(Pierce)。
2.2 细胞总蛋白提取 细胞1×107个,加入200μl冰预冷的总蛋白提取液,冰浴中匀浆,4℃裂解30分钟,4℃ 12 000g离心10分钟,保留上清液,即为全细胞总蛋白。Bradford法测定蛋白含量后,分装并于-70℃保存备用。
2.3 Western免疫印迹(Westernblot) 取60μg蛋白,行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDSPAGE)后,电转移至PVDF膜,将PVDF膜放入封闭液[Tris缓冲盐溶液(TBS)配制的5% 脱脂奶粉中]4℃封闭4小时,TBS液漂洗后加1:100稀释的一抗,37℃孵育2小时。TBS洗膜后加1:1000稀释的二抗,37℃孵育1小时。按DAB显色试剂盒使用说明操作,进行化学发光法显色,暗室显影、定影后观察结果。
2.4 统计分析 利用数字化凝胶分析仪分析得出各条带面积光强度值,进行统计学分析。数据均以均值±标准差(±s)表示,采用t检验确定组间差别,P<0.05为差别显著,P<0.01为差别非常显著。
结 果
1 失血性休克大鼠肠上皮细胞PGC-1mRNA水平的变化
本实验中PGC-1、β-actinmRNA PCR产物分别为235bp和275bp。对照组和所有休克组RNA提取以及PCR扩增产物电泳加样量都是相同的,这样就排除了因加样量不同而造成假阳性和假阴性。
正常情况下,肠上皮细胞核编码基因PGC-1 mRNA有较低程度表达,失血性休克1小时大鼠肠上皮细胞PGC-1 mRNA表达开始增加,2小时达高峰并维持到3小时,后又开始减弱,到休克晚期5小时PGC-1mRNA表达显著弱于休克前(P<0.05)(见表1、图1)。
2 失血性休克肠上皮细胞PGC-1蛋白的表达
Western-blot结果显示,正常大鼠肠上皮细胞PGC-1蛋白含量较低。失血性休克1小时大鼠肠上皮细胞PGC-1蛋白含量基本没有变化。失血性休克2小时,即休克中期PGC-1蛋白表达增强,后又渐减弱,失血性休克5小时已明显弱于休克前,结果见表2、图2。
表1 失血性休克大鼠肠上皮细胞核编码基因PGC-1mRNA的表达变化(n=6,光强度比值,±s)

表1 失血性休克大鼠肠上皮细胞核编码基因PGC-1mRNA的表达变化(n=6,光强度比值,±s)
与正常对照组比较:*P<0.05,**P<0.01
组别 对照组HS1h HS2h HS3h HS4h HS5h PGC-1/β-actin0.4634±0.0631 0.703±0.0965*0.7746±0.0896**0.7585±0.0865** 0.5586±0.0466 0.3082±0.0585*
表2 失血性休克大鼠肠上皮细胞核编码基因PGC-1蛋白的表达变化(n=3,光强度值,±s)

表2 失血性休克大鼠肠上皮细胞核编码基因PGC-1蛋白的表达变化(n=3,光强度值,±s)
与正常对照组比较:*P<0.05,**P<0.01
组别 对照组HS1h HS2h HS3h HS4h HS5h PGC-1蛋白 0.7642±0.0313 0.7538±0.0475 0.8943±0.0496**0.8848±0.0585** 0.7589±0.0425 0.6764±0.0475*
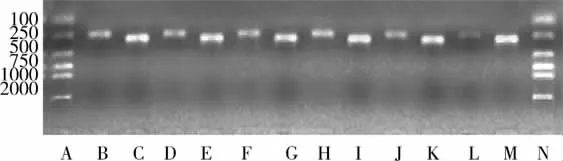
图1 失血性休克大鼠肠上皮细胞PGC-1基因mRNA的改变
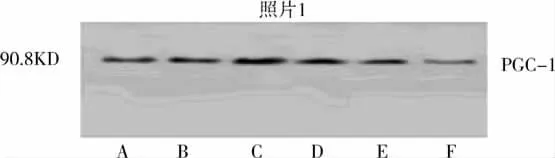
图2 失血性休克肠上皮细胞线粒体PGC-1蛋白杂交结果
讨 论
PGC-1能结合多种转录因子增强靶基因转录效率,参与多种代谢通路的调节活动[6]。PGC-1异常表达可引起与线粒体生理功能及能量代谢相关的细胞反应。在棕色脂肪、肌肉和心肌中,传递能量需求的信号可使PGC-1表达增高,PGC-1的过度表达刺激线粒体的生物合成。认识这种多功能辅激活因子在失血性休克时缺血缺氧所致损伤细胞中表达变化情况具有重要意义。
1 PGC-1生理作用及其调节机制
PGC-1是染色体4p15.1区域的基因编码的一种核受体刺激因子。人类PGC-1开放读码框(openreading frame,ORF)包含2 394个核苷酸,编码798个氨基酸,分子量91kDa。大鼠的PGC-1氨基酸序列与人类有95%的一致性,与小鼠有98%的一致性,分别与人类和小鼠的PGC-1有1个和2个N端氨基酸缺失的差异。人类、大鼠和小鼠PGC-1的功能基序大多是高度保守一致的[7]。PGC-1的 N末端转录活性区,是与几种转录因子相互作用的区域,命名为AD1和AD2;C末端与处理新转录的RNA有关。PGC-1上还有 NRF等的结合位点。PGC-1通过直接的蛋白-蛋白相互作用方式辅激活转录因子[7],能参与对染色质的修饰,与RNA聚合酶Ⅱ复合体相互作用,对mRNA加工,结合其他辅激活因子等,还能与TRAP/Mediator复合体相互作用[8]。PGC-1α 能被 p38 MAPK 激活。p38 MAPK对PGC-1的正调节作用机制是通过解除p160MBP与PGC-1的负调节结构域结合,从而消除其负调节作用[9]。
2 失血性休克大鼠缺血缺氧肠上皮细胞辅激活因子PGC-1表达的改变及意义
本实验中发现,在失血性休克时,大鼠肠上皮细胞中PGC-1 mRNA表达在休克早期表达开始增强,2小时和3小时表达最强,后又渐减弱,至休克5小时时其表达明显低于休克前水平。有报道高浓度过氧化氢可促进骨骼肌细胞PGC-1 mRNA表达,该过程与腺苷酸激酶(AMP kinase)激活有关[10]。说明缺血缺氧早期可上调PGC-1 mRNA,可能与氧自由基生成增多有关。PGC-1 mRNA的上调,可以使PGC-1蛋白合成增多,为PGC-1功能增强创造条件,以便适应细胞能量供应不足时线粒体加强能量代谢的过程,刺激线粒体的生物合成。而休克失代偿期细胞内与基因表达有关的能量和原料供应均减少,扰乱了PGC-1在转录水平的表达,从而下调了PGC-1 mRNA的表达,继而使PGC-1辅激活转录因子的能力减弱,相对抑制了编码呼吸链亚基的细胞核基因组和线粒体基因组的表达,更加重了线粒体的能量代谢障碍。
本研究发现,大鼠失血性休克2小时肠上皮细胞PGC-1蛋白表达量有所增高,后开始下降,到休克晚期5小时时,与正常对照组相比,其蛋白含量非常显著降低(P<0.01)。说明在休克早期,PGC-1 mRNA的上调,能使PGC-1蛋白合成增多,从而诱导细胞适应能量代谢需要基因的表达,并加强了线粒体能量代谢的过程。随着休克的发展,PGC-1 mRNA表达下降,PGC-1蛋白合成减少,辅激活转录因子的调节能力减弱,细胞能量生成障碍,细胞及其线粒体损伤更趋严重。推测如能阻止PGC-1蛋白表达的下降,可能会减轻休克时细胞及其线粒体的损伤。Srivastava等[11]研究证实,通过诱导PGC-1α/β表达,可以部分弥补线粒体疾病患者存在的细胞呼吸链功能的缺陷,增加线粒体生物合成。国内陈淑娟等[12]实验结果亦表明,增加PGC-1α在内皮细胞内的表达,可以增加线粒体生物合成,反之,可降低线粒体生物合成。目前,PGC-1在调控通路中的作用的更多研究正在深入进行,而有关失血性休克缺血缺氧条件下PGC-1基因表达的调控研究将无疑具有一定的临床应用前景。
[1] Norrbom J,Sundberg CJ,AmelnH,et al.PGC-1alpha mRNA expressionis influenced by metabolic perturbationinexercising humanskeletal muscle[J].J Appl Physiol,2004,96(1):189-194.
[2] Viña J,Gomez-Cabrera MC,Borras C,et al.Mitochondrial biogenesis inexercise and inageing[J].Adv Drug Deliv Rev,2009,61(14):1369-1374.
[3] Nakayama S,Kramer GC,CarlsenRC,et al.Infusion of very hypertonic saline to bleed rats:membrane potential and fluid shifts[J].J Surg Res,1985,38(2):180-186.
[4] Desoignie R,SellinJ.Propionate initialed changes inintra cellular PH inrabbit coloncytes[J].Gastroenterology,1994,107(2):347-356.
[5] Desoignie R,SellinJ.Propionate-initialed changes inintracellular pH inrabbit coloncytes[J].Gastroenterology,1994,107(2):347-356.
[6] LeMoine CM,Genge CE,Moyes CD.Role of the PGC-1 family inthe metabolic adaptation of goldfish to diet and temperature[J].J Exp Biol,2008,211(9):1448-1455.
[7] Sadana P,Park EA.Characterization of the transactivationdomaininthe peroxisome-proliferator-activated receptor gamma co-activator(PGC-1)[J].Biochem J,2007,403(3):511-518.
[8] Wallberg AE,Yamamura S,Malik S,et al.Coordination of p300-mediated chromatinremodeling and TRAP/mediatro functionthrough coactivator PGC-1[J].Mol Cell,2003,12(5):1137-1149.
[9] FanM,Rhee J,St-Pierre J,et al.Suppression of mitochondrial respirationthrough recruitment of p160 myb binding proteinto PGC-1:modulationby p38 MAPK[J].Genes Development,2004,18(3):278-289.
[10] Irrcher I,Ljubicic V,Hood DA.Interactions betweenROS and AMP kinase activity inthe regulation of PGC-1alpha transcriptioninskeletal muscle cells[J].Am J Physiol Cell Physiol,2009,296(1):C116-123.
[11] Srivastava S,Diaz F,Iommarini L,et al.PGC-1α/β induced expressionpartially compensates for respiratory chaindefects incells from patients with mitochondrial disorders[J].Hum Mol Genet,2009,(18):1805-1812.
[12]陈淑娟,汪新宇,李海燕,等.PGC-1对血管内皮细胞内线粒体生物合成的影响[J].南方医科大学学报,2010,30(5):1114-1116.