经皮椎体后凸成形术与非手术治疗急性和亚急性骨质疏松性椎体压缩性骨折临床研究
2011-01-08郝定均
谢 恩,郝定均
全球年均超过140万骨质疏松症患者继发椎体骨折[1]。经皮椎体后凸成形术(percutaneous kyphoplasty,PKP)是在影像增强装置监视下,经皮穿刺向椎体内球囊扩张注射骨水泥的一种微创技术。这种微创技术已得到广泛认同,有效地降低了患者短期和长期的痛苦[2]。目前缺乏PKP组与非手术治疗组临床随机对照研究,与非手术疗法比较,PKP的有效性、安全性仍有很大争议。
资料与方法
1 一般资料
本研究共纳入2007年7月~2010年7月骨质疏松压缩性椎体骨折164例。PKP组77例,男性47例,女性30例;年龄57~77岁,平均67岁。骨折部位:T118例,T1219例;L124例,L217例,L37例,L42例。非手术治疗组87例,男性43例,女性44例;年龄60~82岁,平均67岁。骨折部位:T119例,T1221例;L127例,L218例,L38例,L43例,L51例。住院时间:PKP组(7.60天)与非手术治疗组(12.30天)相比,有显著性差异(P <0.05)。
骨折标准[3]:椎体垂直距离减少了至少4mm被定义为一个新椎体骨折。椎体压缩性骨折脊柱X线片(最低15%的高度损失)入选。骨密度降低(T< -1)。
纳入标准:急性(骨折时间<2周)或亚急性(骨折时间2~8周)骨质疏松性骨折(患者生活无法自理),伴有顽固性疼痛,患者有足够的认知能力。入院体格检查结合骨密度检查确诊为骨质疏松性椎体压缩骨折,椎体后壁完整,无合并脊髓损伤。
排除标准:年龄<57岁、长期服用抗凝药物、老年性痴呆、认知能力损害或有其他的大脑疾患、脊柱感染或皮肤状况不佳、恶性肿瘤、四肢骨折或对造影剂过敏的患者。
影像学标准:所有患者术后摄X线片;行MRI或骨扫描以区分新鲜或陈旧性骨折。在MRl上显示有水肿或在骨扫描上有骨转换被视为新鲜骨折。
合并症:67例合并1~3种内科疾病,常见为高血压病、冠心病、糖尿病、脑梗死、肺气肿等。
2 随机分组
共758例椎体骨折患者,其中不符合纳入标准271例、拒绝参加217例、其他原因97例。根据计算机生成的随机码,患者被随机分配行PKP治疗或非手术治疗。PKP组失访7例,纳入分析77例;非手术组失访2例,纳入分析87例。PKP组尽早手术,非手术组需住院治疗。两组患者在可以自理时出院。
3 治疗方法
3.1 经皮椎体后凸成形术:椎弓根入路,用C型臂X线机透视定位,局部麻醉。透视下沿穿刺点进入椎弓根,球囊位于椎体前3/4处,连续透视监测下注入显影剂,缓慢扩张球囊,观察球囊压力。当椎体高度恢复满意或球囊到达椎体上下终板时,停止加压,抽出造影剂并撤出球囊。透视下骨水泥低压注入椎体内,骨水泥应充盈于椎体的前中2/3处,不能超过椎体的后缘,一旦发现骨水泥流到椎体的后缘,应立即停止推注。常规应用抗生素2~3天。
3.2 过程:椎体后凸成形术或非手术治疗后1天、3、6个月之后进行临床评估。疼痛治疗根据WHO分类[4]。
4 疗效标准及评分与统计学处理
4.1 生理及心理结果评估 由健康调查简表(SF-36)和 Dallas疼痛问卷(Dallas painquestionnaire,DPQ)[5]进行评估。SF-36包含36个问题、涵盖8个方面的内容。这8个方面内容包括:躯体功能、躯体角色、肌体疼痛、总的健康状况、活力、社会功能、情绪角色和心理卫生,从中可计算出标准生理组分(standardized physical component,PCS)和标准心理组分(standardized mental component,MCS)[6]。DPQ是包含16项的视觉模拟测量表,用以评估慢性疼痛对患者4个方面生活的影响。这4个方面包括日常活动(da)、工作和娱乐(wl)、焦虑和沮丧(ad)和社会兴趣(si)。腰背疼痛用视觉模拟量表(visual analogue scale,VAS;0 cm表示无痛,10cm表示最痛)进行评定。
Barthel[7]指数(分值为 0 ~20)包括 10 项评估个人日常功能的项目,分别为饮食、洗澡、仪容、服饰、大便、小便、自行如厕、搬运能力、活动能力和上下楼等。
简易精神状态量表(MMSE)是对成人认知程度的定量测评,包括方向感、记录、注意力、计算能力、记忆力和语言能力。
4.2 影像学观察 (1)椎体高度:采用Lee测量法,在X线片上测量椎体前壁高度(anterior vertebral body height,AVBH),计算椎体高度百分率;(2)椎体后凸:采用椎体上、下终板测量法,在X线片上测量椎体后凸角度;(3)骨水泥渗漏:观察椎旁、椎间隙、椎管骨水泥渗漏情况。
5 统计学分析
疼痛缓解的数据处理按照以下公式计算:
疼痛缓解百分数(%)=(治疗前疼痛值-治疗后疼痛值)/治疗前疼痛值×100%。
6 临床疼痛显著缓解
VAS评分在3分或以下。采用临床显著缓解疼痛Kaplan-Meier生存曲线(PKP组和非手术治疗组)进行分析。
结 果
1 临床疗效
77例手术顺利完成,每个椎体骨水泥注入量3~7ml,平均 5.7ml。
1.1 影像学检查 椎体前壁高度平均恢复27.9%,椎体后凸角平均矫正17.7°。手术前后的VAS疼痛评分、椎体前壁高度、椎体后凸角度比较差异均有统计学意义(P<0.05)(图1)。
椎体前壁高度(67.6±22.4)%,椎体后凸角22.7°±10.7°。
椎体前壁高度平均恢复27.9%(P<0.05),椎体后凸角平均矫正12.6°(P <0.05)。
1.2 临床分析 PKP组患者的VAS疼痛评分由术前的7.7(CI:[6.7,8.7])降至术后(12 ~24 小时)1.8(CI:[0.9,3.2]),非手术治疗组(7.9(CI:[7.2,8.7])降至术后 7.8(CI:[7.7,8.7])(12 ~ 24 小时)。两者比较有显著性差异(P<0.05)。6个月随访时,两组间的VAS评分无显著性差异(P>0.05)(图2)。
将两组在初诊时和3个月时的结果及在第3、6个月时两组之间的结果分别进行比较,我们发现在SF-36中PCS和MCS评分、DPQ测试中的4个方面,MMSE、Barthel指数及生理测试中均无显著性差异(表1)。
疼痛显著缓解生存分析显示,早期PKP组患者疼痛缓解比非手术治疗组显著有效(χ2=57.6,P<0.01)(图3)。
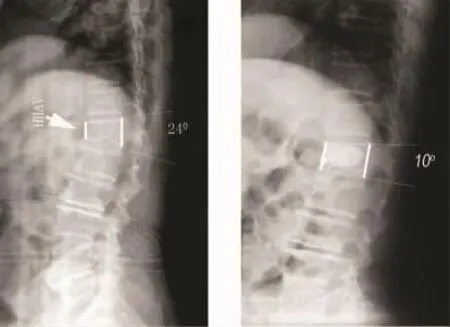
图1a.术前侧位普通X线片,椎体前缘高度(AVBH);b.术后侧位普通X线片
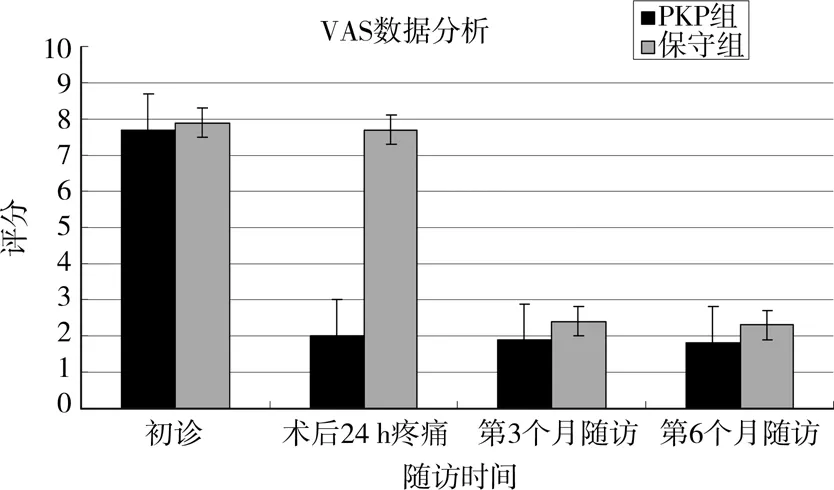
图2 PKP和非手术治疗组的VAS分析
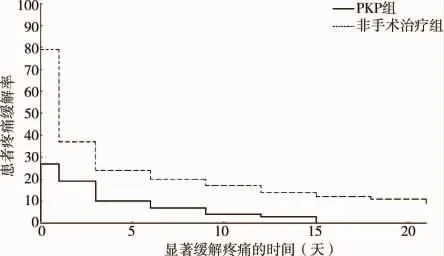
图3 显著缓解疼痛Kaplan-Meier生存曲线
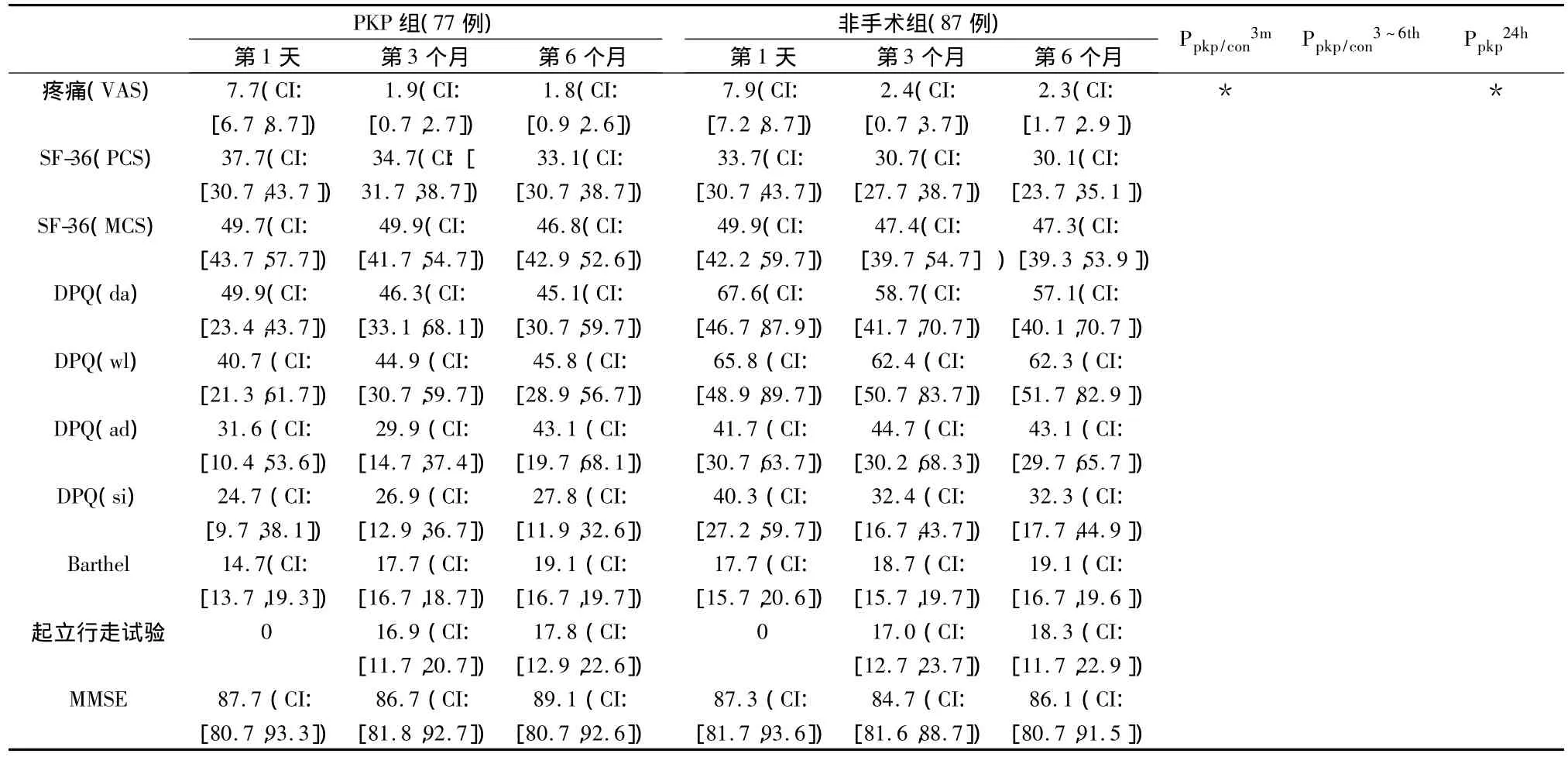
表1 PKP组与非手术治疗组的临床结果
讨 论
如前所述,部分作者认为PKP应只用于非手术治疗无效的骨质疏松所致的骨折疼痛[8]。本研究结果支持这一观点,并与其他研究结果一致[9]。我们发现经PKP治疗后可立即缓解患者的骨折疼痛,但在统计第3、6个月时,两组间结果没有显著性差异。然而,少数患者在3个月后疼痛并没有缓解(VAS评分>5),其中非手术组10例,PKP组3例,随访的结果同样支持这个总体性的结论。
PKP手术指征须仔细分析,急性和亚急性骨质疏松性椎体压缩骨折腰背痛可以简单地归因为压缩骨折后的脊柱后凸。然而是单纯腰背部软组织的原因、还是涉及到椎管与小关节,是否有神经功能损害等均需认真辨别。目前一般认为PKP的最佳时机是骨折后数天,时间越长、效果越差;超过2年时一般不会推荐使用,除非能证明椎体骨折尚未愈合。本研究也支持这个观点。
本实验各组有效的样本数量都较大。由于需术前进行MRI、骨密度检查而导致住院时间延长,PKP组的平均住院时间为7.6天。
本研究的结果首先是基于随机化的临床研究,其次纳入的患者最终仍保留在各自的分组中。PKP组在术后12~24小时内疼痛显著缓解(P<0.05)。术前VAS疼痛评分(7.70±1.00)分,术后24小时VAS评分(1.80±0.91)(P <0.05)。从初诊到3个月随访时两组的疼痛缓解程度相当(P<0.05),在VAS评分中从7.7降至1.8,组内差异显著(P<0.05)。椎体前壁高度平均恢复27.9%(P<0.05)。椎体后凸角平均矫正12.6°(P<0.05)。本研究同时发现PKP手术矫正后凸畸形并不能成比例地减轻腰背疼痛。
总体上,PKP是一种安全的治疗方法[10],但可能会发生少见却严重的并发症。较常见的是骨水泥的渗漏,这可导致不同程度的运动功能障碍[11]。其他的严重并发症包括骨水泥引发的肺栓塞[12]以及已存在感染的患者发生骨髓炎[13]。本组骨水泥渗漏11例,其中1例术后腰背痛加重,考虑为渗漏骨水泥引起椎旁软组织炎症反应,经对症处理后缓解。1例椎旁静脉渗漏引发呼吸道症状,可能与聚甲基丙烯酸甲脂(PMMA)颗粒进入肺部刺激气道有关。椎体静脉造影有助于及时发现骨水泥静脉渗漏这一并发症。
骨质疏松性椎体骨折,非手术治疗包含药物、卧床休息与支具等。卧床休息会进一步导致骨量丢失,加重骨质疏松。非手术治疗中的长期制动可能会导致肺感染、深静脉血栓形成危险性增加。有两项研究结果似乎表明,假手术组和椎体成形术也同样有效[14-15],但是缺少临床非手术治疗组的对照[16]。
PKP尤其适合于行非手术治疗风险增加的患者,例如有慢性阻塞性肺疾病且不能大量应用止痛剂的患者。我们认为这一结果一般适用于60岁以上的非恶性肿瘤引起的骨质疏松症。由于具备经椎弓根入路的丰富经验以及透视监测排除了不适合手术的患者(存在感染、对造影剂过敏以及不合理的抗凝血治疗的患者),并且在发生骨水泥渗漏迹象时及时停止了注射,因此PKP组并未发生严重不良反应。
经皮椎体成形术(PVP)是Deramand和Galibert于20世纪80年代发展的微创脊柱外科技术[17],可早期稳定骨折、强化椎体、缓解疼痛,其缺点是不能恢复椎体高度和改善后凸畸形。PVP与PKP二者原理是一样的,但PVP无球囊,骨水泥渗漏危险更大,后者由于有球囊,恢复椎体高度的作用更充分。对压缩程度不严重、终板和椎体后缘骨皮质相对完整的骨质疏松性脊柱压缩性骨折,选用PVP和PKP均可;对严重塌陷,特别是明显存在椎体骨皮质裂隙者,是骨水泥渗漏的高危因素,则应优先选择PKP,但该技术仍存在一些不足,且费用高。
PKP术能够积极有效地治疗椎体压缩骨折的关键在于迅速缓解疼痛,防止恶性循环,尽可能地恢复椎体高度和矫正后凸畸形,提高患者的生存质量[18],是目前治疗骨质疏松性椎体压缩骨折较理想的微创治疗方法。
[1] Johnell O,Kanis JA.Anestimate of the worldwide prevalence and disability associated with osteoporotic fractures[J].Osteoporos Int,2006,17(12):1726 -1733.
[2] Eck JC,Nachtigall D,Humphreys SC,et al.Comparison of vertebroplasty and balloonkyphoplasty for treatment of vertebral compressionfractures:a meta-analysis of the literature[J].Spine,2008,8(3):488 -497.
[3] Black DM,Cummings SR,Karpf DB,et al.Randomised trial of effect of alendronate onrisk of fracture inwomenwith existing vertebral fractures[J].Lancet,1996,348(7):1535-1541.
[4] McHugh GA,Luker KA,Campbell M,et al.A longitudinal study exploring paincontrol,treatment and service provisionfor individuals with end-stage lower limb osteoarthritis.Rheumatology[J].Oxford,2007,46(4):631 -637.
[5] Lawlis GF,Cuencas R,Selby D,et al.The development ofthe dallas painquestionnaire:anassessment of the impact of spinal painonbehavior[J].Spine,1989,14(2):511 -516.
[6] Brazier J,Roberts J,Deverill M.The estimation of a preference-based measure of health from the SF -36[J].Spine,2002,21(2):271 -292.
[7] CollinC,Wade DT,Davies S,et al.The Barthel ADL Index:a reliability study[J].Int Disabil Stud,1988,10(2):6163.
[8] Kim DH,Vaccaro AR.Osteoporotic compressionfractures of the spine;current options and considerations for treatment[J].Spine J,2006,6(5):479 -487.
[9] VoormolenMH,Mali WP,Lohle PN,et al.Percutaneous vertebroplasty compared with optimal painmedicationtreatment:short-term clinical outcome of patients with subacute or chronic painful osteoporotic vertebral compressionfractures.The VERTOS study[J].AJNR Am J Neuroradiol,2007,28(3):555 -560.
[10] ChinDK,Kim YS,Cho YE,et al.Efficacy of postural re -ductioninosteoporotic vertebral compressionfractures followed by percutane ous vertebroplasty[J].Neurosurgery,2006,58(4):695 -700.
[11] ChenYJ,TanTS,ChenWH,et al.Intradural cement leakage:a devastatingly rare complication of vertebroplasty[J].Spine,2006,31(12):E379 -382.
[12] Yoo KY,Jeong SW,YoonW,et al.Acute respiratory distress syndrome associated with pulmonary cement embolism following percutaneous vertebroplasty with polymethylmethacrylate[J].Spine,2004,29(14):E294 -297.
[13] Walker DH,Mummaneni P,Rodts GE Jr.Infected vertebroplasty.Report of two cases and review of the literature[J].Neurosurg Focus,2004,17(6):E6.
[14] Kallmes DF,Comstock BA,Heagerty PJ,et al.A randomized trial of vertebroplasty for osteoporotic spinal fractures[J].nEngl J Med,2009,361(6):569 -579.
[15] Buchbinder R,Osborne RH,Ebeling PR,et al.A randomized trial of vertebroplasty for painful osteoporotic vertebral fractures[J].nEngl J Med,2009,361(6):557 -568.
[16] Clark W,LyonS,Burnes J,et al.Trials of vertebroplasty for vertebral fractures[J].nEngl J Med,2009,361(21):2097-2098.
[17] Galibert P,Deramond H,Rosat P,et al.Preliminary note onthe treatment of vertebral angioma by percutaneous acrylic ertebroplasty[J].Neurochirurgie,1987,33(2):166-168.
[18] Alvarez L,Alcaraz M,Perez-Higueras A,et al.Percutaneous vertebroplasty:functional improvement inpatients with osteoporotic compressionfractures[J].Spine,2006,31(10):111-138.
