α-乳白蛋白油酸复合物对SGC-7901细胞增殖的影响
2011-01-08崔巍巍许晓曦王红卓志国
崔巍巍,许晓曦,王红卓志国
(东北农业大学食品学院,哈尔滨 150030)
α-乳白蛋白油酸复合物对SGC-7901细胞增殖的影响
崔巍巍,许晓曦,王红卓志国
(东北农业大学食品学院,哈尔滨 150030)
分别采用了MTT法检测细胞增殖,Hoechst33258染色观察细胞形态变化,以及电泳法观察DNA梯形条带研究经油酸诱导的牛乳α-乳白蛋白分别以不同浓度不同时间作用于胃癌SGC-7901细胞对其增殖作用的影响。结果表明,α-乳白蛋白油酸复合物对胃癌SGC-7901细胞的确有明显的促凋亡作用。
乳白蛋白;油酸;胃癌;凋亡
0 引言
α-乳白蛋白是采用加热酸凝法凝固乳清中的蛋白质所得,是一种不可溶的天然浓缩乳清蛋白。它必需氨基酸和支链氨基酸的极好来源;是惟一能结合钙的乳清蛋白,其成分接近人乳,不易过敏,是调节睡眠、食欲情绪的重要因子。α-乳白蛋白富含半胱氨酸和蛋氨酸,能维持人体内抗氧化剂的水平,并,增加骨骼强度和降低LDL胆固醇水平。同时,α-乳白蛋白还能调理肠胃功能,加速营养均衡及吸收;加速伤口的愈合[1-3]。
近年研究表明乳铁蛋白具有明显的抗肿瘤作用[4],α—乳白蛋白虽然不具抗癌活性[5],但经油酸诱导后对白血病细胞有抑制作用[6]。
本研究旨在将蛋白与油酸复合后作用于胃癌细胞,采用MTT法、Hoechst33258染色法和琼脂糖凝胶电泳法研究其对胃癌细胞的增殖抑制作用。
1 实验
1.1 材料
RPM I-1640细胞培养基;DMSO(二甲基亚砜);小牛血清;MTT;胰蛋白酶;Hoechst33258凋亡染色试剂盒;倒置荧光显微镜;人胃癌细胞株SGC–7901;其他所用试剂均为国产或进口分析纯试剂。
1.2 方法
1.2.1 细胞培养
胃癌SGC-7901细胞用质量分数为10%胎牛血清、青霉素100 U/mL、链霉素质量浓度为100 mg/L的RPM I-1640培养基培养,置于37℃质量分数为5%的CO2饱和湿度细胞培养箱培养。每24 h换液,质量分数为0.25%胰酶消化,每2~3 d传代1次。取对数生长期细胞进行实验[6-8]。
1.2.2 药物α-乳白蛋白油酸复合物的制备
M.Svensson等[9]研究了乳白蛋白油酸复合物的制备过程。DEAE-Trisacryl M经缓冲液(bufferA: 10MmTris-HCl,pH=8.5;bufferB:buffer A包括浓度为1 mol/L的NaCl)处理后添加到(14cm×1.6cm)的离子交换色谱柱然后将柱子连接到GE离子交换色谱系统中。10 mg油酸溶于100 μL体积分数为99.5%的乙醇溶液中超声3 min。然后加入10 mL浓度为10 mmol/L的Tris/HCl(pH=8.0),接着将处理后的油酸加入到柱子中进NaCl梯度洗脱对油酸进行分散。10 mg的α-乳白蛋白溶于20 mL浓度为10 mmol/L的Tris/HCl(pH= 8.0)包括浓度为0.08 mmol/L的EDTA上样。洗脱液用3.5 ku的透析袋除盐至少换4次水然后冷冻干燥。流速为1 mL/min,记录仪0.1 cm/min。缓冲液使用前需脱气及利用0.22 μm的滤膜进行过滤。洗脱峰在280 nm的波长下进行检测[10]。
1.2.3 MTT法检测细胞增殖
取对数生长期细胞用质量分数为0.25%的胰酶消化,含质量分数为10%胎牛血清的RPM I-1640培养基培养调整细胞浓度为5×104mL-1,以100 μL/孔接种96孔板,细胞贴壁生长过夜。设实验组为A,B,C,D,E组;分别加入浓度为10,15,20,25、30 mmol/L乳铁蛋白培养基,并以不含乳铁蛋白的培养基为对照组E,200 μL/孔,每个浓度设3个复孔。设空白孔用于调零,对照组各孔加入等量的培养基。将96孔板置于37℃质量分数为5%的CO2饱和湿度下细胞培养箱培养12,24,48 h后,加入MTT(质量浓度为5 g/L)20 μL/孔继续孵育4 h。弃上层清液,加入DMSO150 μL/孔,摇床震荡10 min混匀,用酶标仪测定570 nm各孔吸光度值(A值)。按照公式计算细胞增殖抑制率(Inhibiting Rate,IR):IR=MTT法抑制率=(对照组OD值一实验组OD值)/对照组OD值×100%。每组实验重复3次[11,12]。
1.2.4 Hoechst染色观测细胞凋亡
取经体积分数为70%乙醇中浸泡的洁净盖玻片,无菌超净台内吹干,再用细胞培养液洗涤一遍。将盖玻片置于6孔板内,种入细胞过夜,使约为50%~80%满。设实验组A,B,C,D,E组;分别加入浓度为10,15,20,25,30 mmol/L乳铁蛋白培养基,并以不含乳铁蛋白的培养基为对照组E,1 mL/孔,设空白孔用于调零,对照组加入等量的培养基。孵育48 h后,去培养基,加入0.5 mL固定液,固定(4℃过夜)。去固定液,用PBS洗两遍,每次3 min,洗涤期间手动晃动。按照Hoechst 33258染色试剂盒说明书,每孔加Hoechst 33258染色液0.5 mL,避光染色5 min,期间手动晃动数次。去染色液,用PBS洗两遍,每次3 min,吸尽液体。洗涤时手动晃动。滴一滴防荧光淬灭封片液于载玻片上,盖上贴有细胞的盖玻片,让细胞接触封片液,尽量避免气泡,于倒置荧光显微镜蓝色荧光激发下观察细胞形态学变化。荧光显微镜的紫外光可检测到呈蓝色的细胞核。激发波长350 nm左右,发射波长460 nm左右[13]。
1.2.5 DNA的提取琼脂糖凝胶电泳
分别收集1×106细胞mL-1的实验组和对照组细胞,200 r/min1离心洗涤后,细胞在Eppendorf离心管内悬浮于1 mL内含10 mmol的Tris·HCl(pH=8.0)、1 mmol的EDTA、10 mmol的NaCl、1%SDS的DNA抽提缓冲液中,再补充20 μg的RNAase100 μg蛋白酶K,用玻棒搅拌至黏稠状,置37℃温箱中12 h,待冷却至室温后,加入等容积饱和酚溶液,转动离心管混匀两相,以12 000 r/min离心,吸出上层黏稠水相,移至另一Eppendorf离心管内,再加等体积饱和酚溶液抽提一次,然后用1:1的氯仿酚溶液抽提后,将上层水相移入另一管内,加入浓度为0.3 mmol/L乙酸钠-乙醇溶液DNA,加入二倍容积冰冻无水乙醇置冰格中30 min,取出在4℃、转速为12 000 r/min离心10 min收取DNA,弃去无水乙醇后用70%乙醇混匀漂洗,开盖室温放置15 min挥发乙醇,加入含1 mmol的EDTA和10 mmol的Tris·HCl(pH=7.8)TE缓冲液,使DNA溶解,放置4℃冰箱保存备用[14]。
取5 μL提取的DNA样品与质量分数为0.25%溴酚蓝和质量分数为40%蔗糖溶液混匀后,加入到琼脂糖凝胶样品槽内,在TAE(由pH值为8.0浓度为1 mmol/L的EDTA和浓度为45 mmol/L的Tris-硼酸)缓冲液配制的内含质量浓度为0.5 mg/L溴乙锭染料的1.5%琼脂糖凝胶中电泳,电压稳定在90 V,电泳0.5 h后,取出标本,在紫外灯下观察具有细胞凋亡特征的DNA阶梯状条带;而坏死细胞DNA电泳,则呈模糊的弥散条带(smear)[15]。
2 结果与分析
2.1 MTT法检测细胞增殖
SGC-7901细胞随加药浓度变化凋亡率曲线如图1所示。由图1可以看出,α-乳白蛋白油酸复合物浓度在10~30 mmol/L组在12,24,48 h时对SGC-7901细胞的增殖抑制作用呈现递增趋势,细胞的调亡率递增,并且随时间的延长而逐渐增高,在48 h时细胞的抑制率凋亡率达到最大。同时在12,24,48 h时,各浓度处理组对SGC-7901细胞的增殖抑制凋亡率从小到大依次是6.43%,14.39%,34.51%,45.05%,53.41%,7.58%,31.81%,42.04%,46.59%,57.95%,29.72%,44.47%,51.84%,60.6%,74.77%。表1为MTT法检测药物不同作用时间对SGC-7901细胞的增殖抑制作用。
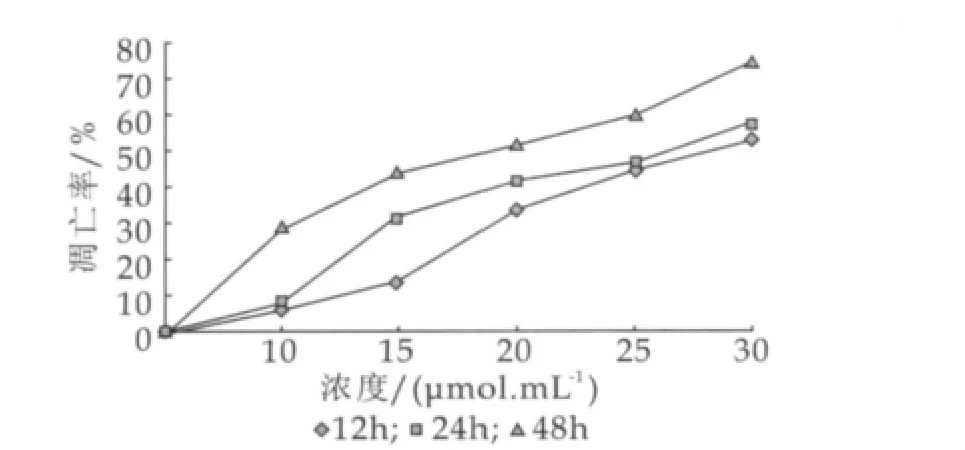
图1 SGC-7901细胞随加药浓度变化凋亡率曲线
2.2 Hoechst染色观测细胞凋亡
Hoechst33258染色结果如图2所示。图2(a)~(f)分别为对照组、浓度为10 mmol/L药物处理组、浓度为15 mmol/L药物处理组、浓度为20 mmol/L药物处理组、浓度为25 mmol/L药物处理组、浓度为30 mmol/L药物处理组;药物α-乳白蛋白油酸复合物作用于SGC-7901细胞48 h后,利用荧光显微镜在紫外光源激发下观察细胞经药物作用的形态变化。发现对照组的细胞在镜下可见生长旺盛,并且长势均匀。细胞核成圆形或椭圆形,染色均匀,全部呈现蓝色或淡蓝色荧光。药物处理组细胞均出现典型的细胞凋亡特征,细胞核固缩浓染,可见高度点状白色荧光现象。呈高度点状白色荧光的细胞比例随着药物α-乳白蛋白油酸复合物的浓度的递增而增大。其中,浓度为10 mmol/L药物处理组细胞与对照组比较变化不大,有少量的SGC-7901细胞呈现细胞凋亡现象,高浓度药物处理组细胞核被染成高度点状白色荧光的细胞逐渐增多,说明凋亡的细胞也相应的增多。
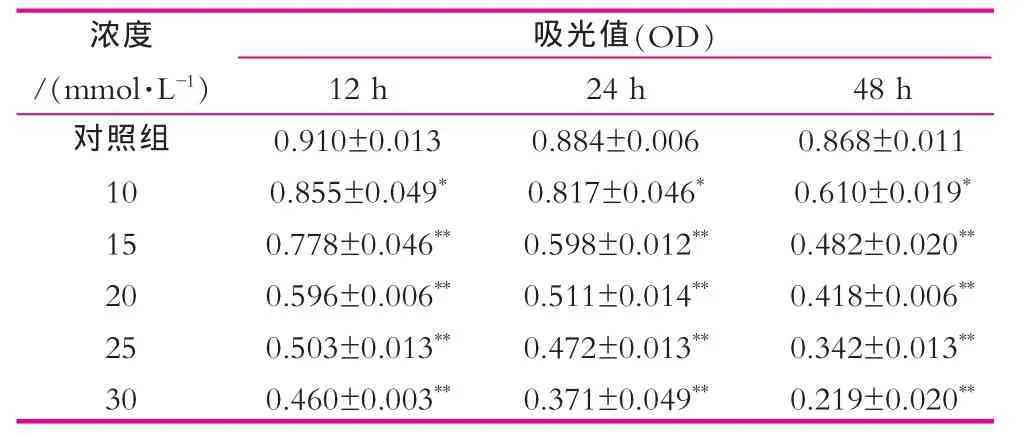
表1 不同时间对SGC-7901细胞的增殖抑制作用的检测结果

图2 Hoechst33258染色结果
2.3 琼脂糖凝胶电泳
图8为DNA琼脂糖凝胶电泳图。图8中,条带从左至右分别为对照组、浓度为10 mmol/L药物处理组、浓度为15 mmol/L药物处理组、浓度为20 mmol/L药物处理组、浓度为25 mmol/L药物处理组和30 mmol/L药物处理组;药物α-乳白蛋白油酸复合物作用于SGC-7901细胞48 h后,浓度为10 mmol/L药物处理组的细胞DNA梯状条带不是十分明显,从浓度为15 mmol/L药物处理组至浓度为30 mmol/L药物处理组细胞DNA梯状条带逐渐明显,并且梯形条带逐渐增多,说明从药物低浓度至高浓度处理组细胞凋亡率逐渐增强。
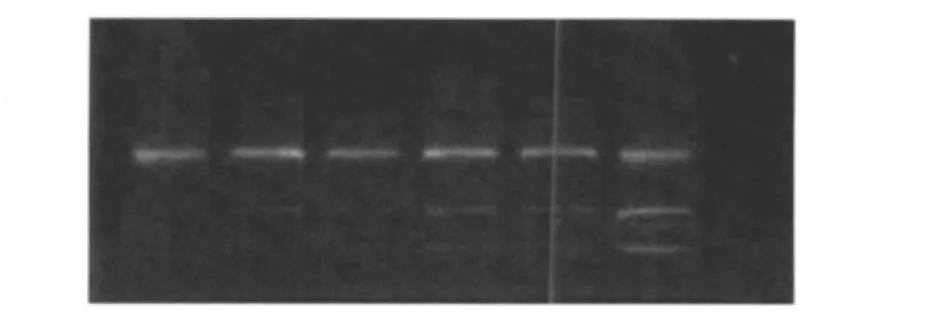
图8 DNA琼脂糖凝胶电泳结果
3 讨论
近半个世纪以来,国内外学者对胃癌的治疗进行了广泛而深入研究,取得许多重要进展,化疗﹑放疗是直接针对病灶部位采取的治疗方法,虽然效果比较显著,但是对人体伤害极大,但是目前胃癌临床诊治状况仍处于早期诊断率低、手术切除率低、5年生存率低的局面。随着胃癌治疗技术的进步和人们观念改变,天然药物正在逐渐被人们认可,它在胃癌治疗方面正在慢慢地取代化学药物的地位,用自然存在的复合物作为化学预防和化学疗法的方法逐渐成为重要的战略。
从实验结果可以看出,α-乳白蛋白油酸复合物对胃癌SGC-7901细胞的增殖具有显著的抑制和促凋亡作用,尤其是当给药浓度均大于15 μmol/L时,药物处理组与对照组相比具有显著性差异(P<0.05),说明该复合物具有明显的抑制胃癌的作用。且其增殖抑制作用还具有明显的量效关系,随着给药浓度的增加,胃癌细胞的凋亡率也明显增高。
因此,乳白蛋白油酸复合物的抗癌功能的发现,对胃癌治疗和预防的简单化、低廉化、无害化具有着重要的意义。如果能将实验所制药物广泛添加于食品和药品中,那会将使胃癌甚至于其它肿瘤的预防和治疗向对人体完全无害化的方向迈出更重要的一步。
[1]仲玉梅.α-乳白蛋白在婴儿营养中的重要性[J].食品工业科技,1992(2):53-57.
[2]燕红,张兰威,朱永军.牛乳清蛋白的性质及其在食品工业中的应用[J].乳品科学与技术,2002(1):14-17.
[3]DUSTIN D,KEVIN H,刘庆平.牛奶成分中的功能性物质及其生物学活性[J].中国畜牧杂志,2009(20):65-68.
[4]JAMIE S M,JAYME S,DAVID M.Conrad,Bovine Lactoferricin Selectively Induces Apoptosis in Human Leukemia and Carcinoma Cell Lines[J].Mol Cancer Ther,2005,4(4):612-624.
[5]MALIN SVENSSON,JONAS FAST,ANN-KRISTIN MOSSBERG.α-Lactalbumin Unfolding Is not Sufficient to Cause Apoptosis,but Is Required for the Conversion to HAMLET(human α-lactalbumin made lethal to tumor cells)[J].Protein Science,2003(12):2794-2804.
[6]PATIL J B,KIM J,JAYAPRADASHA G K.Berberine Induces Apoptosis in Breast Cancer Cells(MCF-7)Through Mitochondrial-Dependent Pathway[J].Eur J Pharmacol,2010(4)70-78.
[7]LIU M J,FEI S J.The Protective Effect of 17beta-Estradiol Postconditioning against Hypoxia/Reoxygenation Injury in Human Gastric Epithelial Cells[J].Eru.J.Pharmacol,2010(21):151-157.
[8]邵世和,孙丽媛,李国利,等.亚硒酸钠在SGC-7901细胞生长中的抑制作用[J].食品科学,2005(26):58-62.
[9]SVENSSON M,HAKANSSON A,MOSSBERG A K.Conversion of a-lactalbumin to a Protein Inducing Apoptosis[J].Medical Science,2000,97(8):4221-4226.
[10]JENNY P,ANN-KRISTIN M,CATHARI-NA S.a-Lactalbumin Species Variation,HAMLET Formation,and Tumor Cell Death[J].Biochemical and Biophysical Research Communications,2006(345):260-270.
[11]JOSEPH O,PHYLLIS S.Walker,Edmond Schmulbach,Alloanti-c in a c-Positive,JAL-Positive Patient[J].Vox Sang,2009,96(3):240–243.
[12]刘颖,张玮玮,李景刚,等.大豆异黄酮抑制胃癌细胞生长作用的研究[J].食品科学,2004(25):163-166.
[13]SANG R P,KYOUNG D L,UK K K.Pseudomonas Aeruginosa Exotoxin A Reduces Chemoresistance of Oral Squamous Carcinoma Cell via Inhibition of Heat Shock Proteins 70(HSP70)[J].Yonsei Med J,2010,51(5):708-16.
[14]侯晓明,李庆章.乳腺细胞凋亡及其研究进展[J].中国乳品工业,2006,10(34):49-51.
[15]LIN X,CAI Y J.Cladonia furcata Polysaccharide Induced Apoptosis in Human Leukemia K562 Cells[J].中国药理学报,2001,22(8):716-720.
Effects of compounds of alpha lactalbumin and oleic acid on proliferation and apoptosis of gastric carcinoma cell line SGC-7901
CUI Wei-wei,XU Xiao-xi,WANG Hong,ZHUO Zhi-guo
(College of Food Science,Northeast Agricultural University,Harbin 150030,China;)
In this paper,MTT was used for cell proliferation,Hoechst33258 staining was used to observe morphology and apoptosis and DNA gel electrophoresis was used to observe ladder-shaped band.Accordingly,we researched the effect of gastric carcinoma SGC-7901cell proliferation with oleic acid-induced milk alpha lactalbumin in different time and by different concentration.The results showed that alpha lactalbumin-oleic acid complex has a conspicuous role to induce apoptosis in gastric carcinoma SGC-7901 cells.
lactalbumin;oleic acid;apoptosis;gastric carcinoma
Q93-33
A
1001-2230(2011)05-0018-03
2010-12-21
黑龙江省教育厅青年骨干支持计划项目(1153G005),黑龙江省教育厅创新团队建设计划(2010td11),黑龙江省普通高等学校青年学术骨干支持计划项目。
崔巍巍(1986-),女,硕士研究生,研究方向食品科学。
许晓曦
