基于反相C8色谱柱的海洋浮游藻色素高效液相色谱分析方法有效性验证*
2011-01-08邓春梅于志刚牛增元
邓春梅,姚 鹏,于志刚,牛增元
(1.国家海洋局北海环境监测中心海洋溢油鉴别与损害评估技术重点实验室,山东青岛266033;2.中国海洋大学化学化工学院海洋化学理论与工程技术教育部重点实验室,山东青岛266100;3.山东出入境检验检疫局,山东青岛266002)
基于反相C8色谱柱的海洋浮游藻色素高效液相色谱分析方法有效性验证*
邓春梅1,姚 鹏2**,于志刚2,牛增元3
(1.国家海洋局北海环境监测中心海洋溢油鉴别与损害评估技术重点实验室,山东青岛266033;2.中国海洋大学化学化工学院海洋化学理论与工程技术教育部重点实验室,山东青岛266100;3.山东出入境检验检疫局,山东青岛266002)
对一种海洋浮游藻色素高效液相色谱分析方法进行了有效性验证。该方法使用反相C8色谱柱,以甲醇、乙腈和丙酮为流动相,并在流动相中添加吡啶/醋酸溶液作为修饰剂改善色素峰的分离效果。结果表明,4种色素标准在一定的浓度范围内线性关系良好,叶绿素a的线性范围为189.6~18 960μg/L,叶绿素b为89.2~8 920μg/L,β,β-胡萝卜素为7.77~777.2μg/L,叶黄素为15.28~1 528μg/L。除β,β-胡萝卜素外各色素标准的回收率在不同浓度下均在90%以上,相对标准偏差也普遍低于5%。在4个参考藻种和123个胶州湾现场样品中共检测出37种色素,一些关键的特征色素均获得了良好的分离效果。该方法操作简便,具有分离度好、灵敏度高、重复性好、回收率高等优点,适用于培养的藻种和现场样品中的海洋浮游藻色素分析。
海洋浮游藻;色素;高效液相色谱;有效性验证
海洋浮游藻是海洋生态系统中的初级生产者,在物质循环与能量转换过程中起着重要作用[1]。对浮游藻群落组成和丰度的估计对于理解浮游生态系统的结构和功能及其动力学过程有重要意义[2]。不同种类的浮游藻具有不同的色素种类和特征色素比值,许多色素之间都有很强的化学分类学的联系,可以用来确定海洋学意义上的浮游藻群落组成和丰度[3]。近年来,以高效液相色谱(HPLC)色素分析为基础的海洋浮游藻化学分类方法由于具有适合大批量样品快速分析等优点,已逐渐成为一种从宏观上对浮游藻群落结构进行定性与定量分析的重要方法,在世界各地海洋环境中得到了广泛应用[4-5]。
对现场样品进行色素分析是应用化学分类方法的第一步也是最重要的一步。Zapata等[6]建立的以C8反相色谱柱为基础,并通过在流动相中添加吡啶作为修饰剂来改善峰形的二元梯度方法被认为是目前分离效果最好、最有前途的一个海洋浮游藻色素分析方法,国际上对于其应用日益增多[7-9],但是在国内其应用还不是很广泛[10-13]。考虑到Zapata等人并没有给出该方法的有效性验证,而且不同的实验室所使用的仪器、试剂以及耗材都不同,本文通过对色素标准、参考藻种和现场样品的分析,参照HPLC校正的通用方法[14-15]考察了这一方法的线性、精密度、回收率、检测限、定量限、分离度等指标,以期建立一套完整的海洋浮游藻HPLC色素分析有效性验证方法,为该方法在不同实验室的应用以及今后新的色素分析方法的研究和比较提供基础。
1 实验部分
1.1 仪器、试剂与材料
Waters Alliance 2695HPLC系统,配有Waters 2996二极管阵列检测器(PDA,检测波长350~750 nm)和Waters 2475荧光检测器(FD,Ex=440nm,Em=650nm);Milli-Q超纯水处理系统(美国Millipore公司);SK250H型高频超声波仪(上海科导超声仪器有限公司);GXZ-300B光照培养箱(宁波东南仪器有限公司);MDF-382E超低温冰箱(日本三洋公司)。
4种色素标准,包括叶绿素a(C-5753)、叶绿素b(C-5878)、β,β-胡萝卜素(C-4582)和叶黄素(X-6250),均购自美国Sigma化学试剂公司(St.Louis,USA)。这些色素标准均为固体,在使用之前需要配制成标准溶液,并经过纯度检验和浓度确定[17];甲醇、乙腈、丙酮为色谱纯(美国Fisher公司);醋酸、吡啶为国产优级纯(天津博迪公司);超纯水(电阻率为18.2MΩ·cm)为自制。
4种已知色素组成的海洋浮游藻作为参考藻种辅助进行色素的定性,包括诺氏海链藻(Thalassiosira nordenskioeldii)、裸甲藻(Gymnodiniumsp.)、赤潮异弯藻(Heterosigma akashiwo)和亚心型四爿藻(Tetraselmis subcordiformis),它们分属4个不同的浮游藻纲(硅藻、甲藻、针胞藻和绿藻),色素组成具有较大差异[10-11,16-17]。
1.2 实验步骤
1.2.1 藻种培养和收获 藻种生长在光照培养箱中,光照强度范围为40~70μmol quanta/m2/s,光暗周期比为12h∶12h,生长温度为18℃。藻种在指数生长期末尾收获,约10mL收获的藻种培养液(细胞密度约在105个/mL)在弱真空(<0.03MPa)和微光下被过滤到47mm Whatman GF/F玻璃纤维滤膜上。滤膜在分析之前于-20℃下冷冻保存(保存时间不超过72h)。
1.2.2 现场样品采集 在胶州湾布设站位采集了7个航次123个表层海水样品,1L海水水样在弱真空(<0.03MPa)和微光下过滤到47mm Whatman GF/F玻璃纤维滤膜上。滤膜在分析之前于-80℃下冷冻保存以减小色素转化(保存时间不超过3个月)。
1.2.3 色素提取 将冷冻的滤膜剪碎,用1.5~3mL 95%甲醇(甲醇∶水=95∶5,v/v)提取色素,并在冰水浴中超声处理5min。提取物通过PTFE滤膜针筒滤器(英国Whatman公司)过滤以去除细胞和滤膜碎屑。为了避免色素峰的变形,250μL的提取液和50μL的Milli-Q水混合,混合后立即进样(混合后无沉淀产生)。所有的操作均在暗室中进行以避免光照破坏色素。
1.3 色谱条件
色谱柱:Waters Symmetry C8柱(150mm×4.6 mm,3.5μm粒径,100Å孔径),恒温25℃;流动相:A=甲醇∶乙腈∶吡啶/醋酸溶液(50∶25∶25v/v/v),B=甲醇∶乙腈∶丙酮(20∶60∶20v/v/v),吡啶/醋酸溶液的配制方法如下:在2L的玻璃烧杯中加入900 mL Milli-Q水,然后分别加入20mL吡啶和10mL醋酸,在搅拌的过程中滴加醋酸直到pH变为5.0,然后将溶液转移至容量瓶,并用Milli-Q水定容到1L[6]。流动相在配好之后先用0.45μm GHP滤膜(美国Pall公司)过滤,然后超声脱气20~30min;梯度洗脱程序:0~22~28~38~40min,0%B~40%B~95%B~95%B~0%B;进样量为100μL;流速为1.0mL/min。每一次运行之后使用一个进样环体积(100μL)的30%甲醇(甲醇∶水=30∶70,v/v)对自动进样器进行自动清洗。叶绿素和类胡萝卜素用PDA进行检测(波长范围350~750nm,光谱分辨率1.2nm),叶绿素同时也用FD辅助检测。色素的定性通过与色素标准、相关文献结果的保留时间和光谱性质进行比较确定,采用外标法进行定量。因为大部分色素在440nm下有吸收,所以后续的计算均是针对440nm下的色谱图。
2 结果与讨论
2.1 方法的线性范围和相关系数
根据现场样品中各色素的大致浓度比例,精确量取标准储备液配制成色素标准混合溶液,共包括8个工作曲线点,各色素标准的起始质量浓度分别为:叶绿素a为189.6μg/L,叶绿素b为89.2μg/L,β,β-胡萝卜素为7.77μg/L,叶黄素为15.28μg/L,然后按照2、4、10、15、20、40、100的倍数递增。色素标准混合溶液按浓度从低到高依次进样,以峰面积(Y)为纵坐标,标准溶液的质量浓度(X,μg/L)为横坐标建立标准工作曲线,其线性方程、线性范围及相关系数如表1所示。图1为色素标准混合溶液第4个浓度点440nm下的色谱图。4种色素标准在标准混合溶液的整个质量浓度范围内(叶绿素a为189.6~18 960μg/L,叶绿素b为89.2~8 920μg/L,β,β-胡萝卜素为7.77~777.2 μg/L,叶黄素为15.28~1 528μg/L)线性关系均较好,线性相关系数为0.999 93~0.999 99,完全可以满足实验要求。
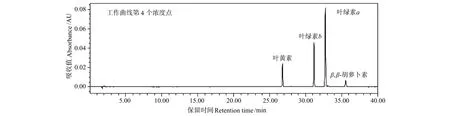
图1 色素标准混合溶液工作曲线第4个浓度点的色谱图(440nm)Fig.1 Chromatogram of a mixed solution of 4pigment standards at the fourth point of working curve(440nm)
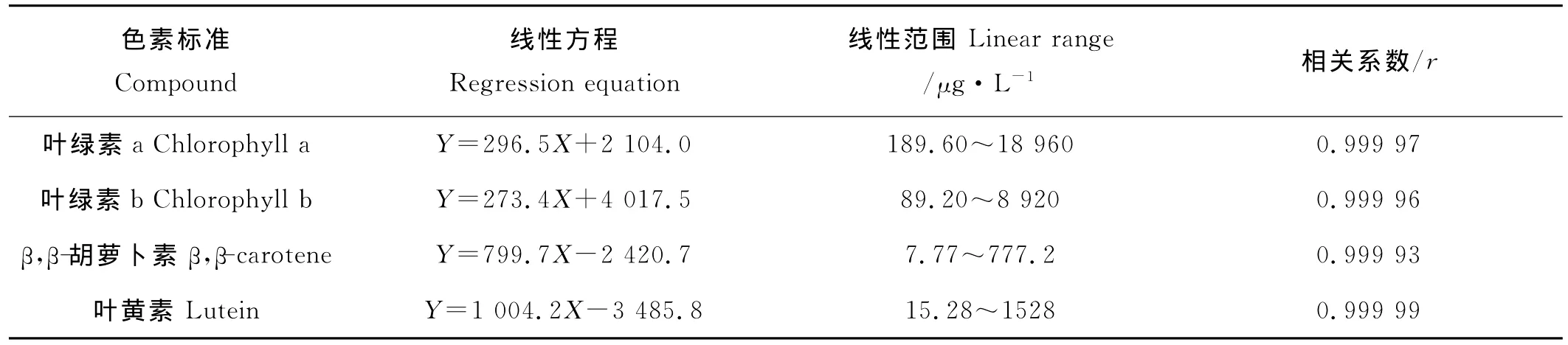
表1 4种色素标准的线性方程、线性范围和相关系数Table 1 Regression equations,linear ranges and correlation coefficients of 4pigment standards
2.2 方法的检测限和定量限
在1.3节所述的实验条件下,将最低浓度的标准系列点连续进样7次,测定各化合物的峰面积,然后按照式1计算出本方法对各色素标准的检测限。

上式中MDL代表检测限(Method Detection Limit,μg/L),t(n-1,0.99)为在99%置信度下双侧t检验的临界值,而n-1代表自由度。当n=7的时候,t(6,0.99)=3.707。SDistandard为各色素标准7次进样峰面积的标准偏差,Fi为各色素标准工作曲线斜率(见表1)。
对于分析方法的定量限一般选择多次重复测定结果的标准偏差的10倍来设定[14]。在本实验中,以3倍的检测限来设定定量限(实际上为3.707×3=11.121倍标准偏差)。4种色素标准的仪器检测限和定量限结果如表2所示,完全能满足实际样品检测和定量需要。
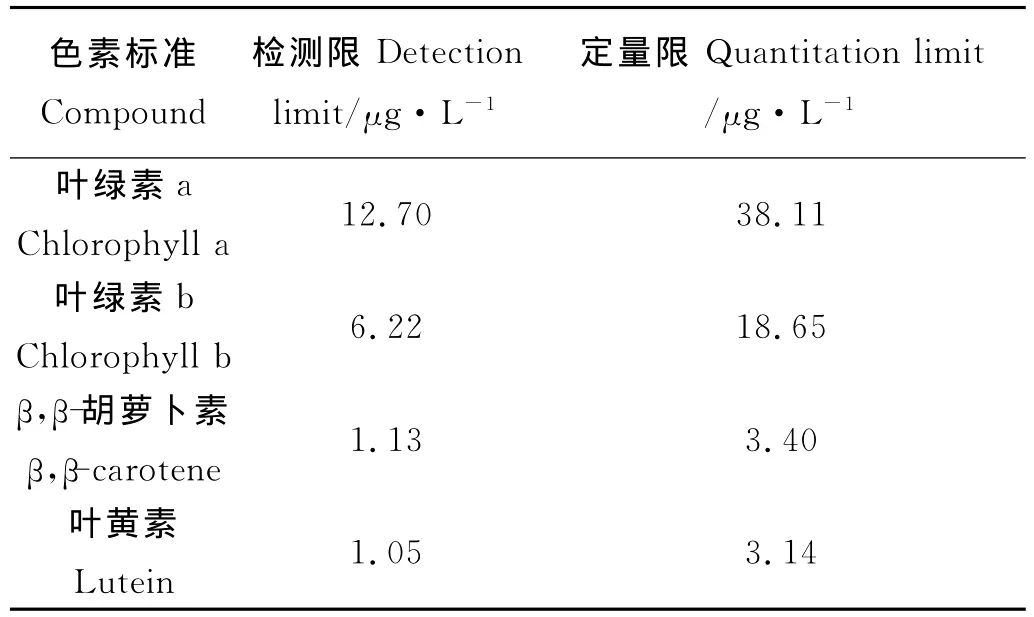
表2 方法的检测限和定量限Table 2 Method detection and quantitation limits
2.3 方法的精密度和回收率
取色素标准混合溶液第2个浓度点,即4种色素标准质量浓度分别为:叶绿素a 379.2μg/L,叶绿素b 178.4μg/L,β,β-胡萝卜素15.54μg/L和叶黄素30.56μg/L的溶液,重复进样5次,分别计算各色素标准的保留时间和峰面积的精密度,各色素标准的相对标准偏差(RSD)如表3所示。由表3可见,其标准保留时间的RSD均小于0.03%,峰面积RSD为1.01%~3.07%,可见该方法的精密度良好。
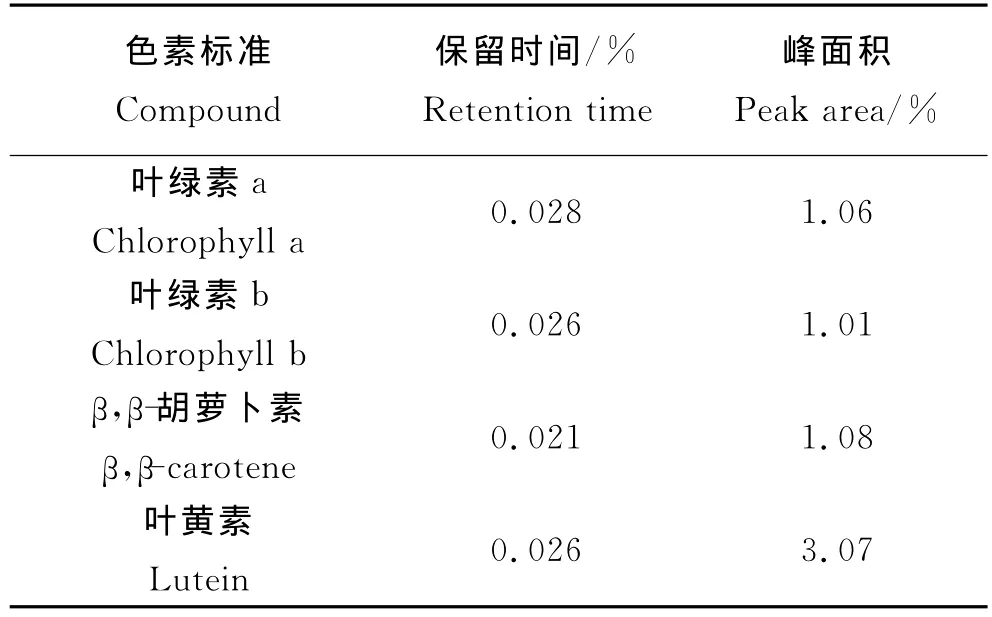
表3 4种色素标准的保留时间和峰面积相对标准偏差Table 3 Relative standard deviation of retention time and peak area of 4pigment standards
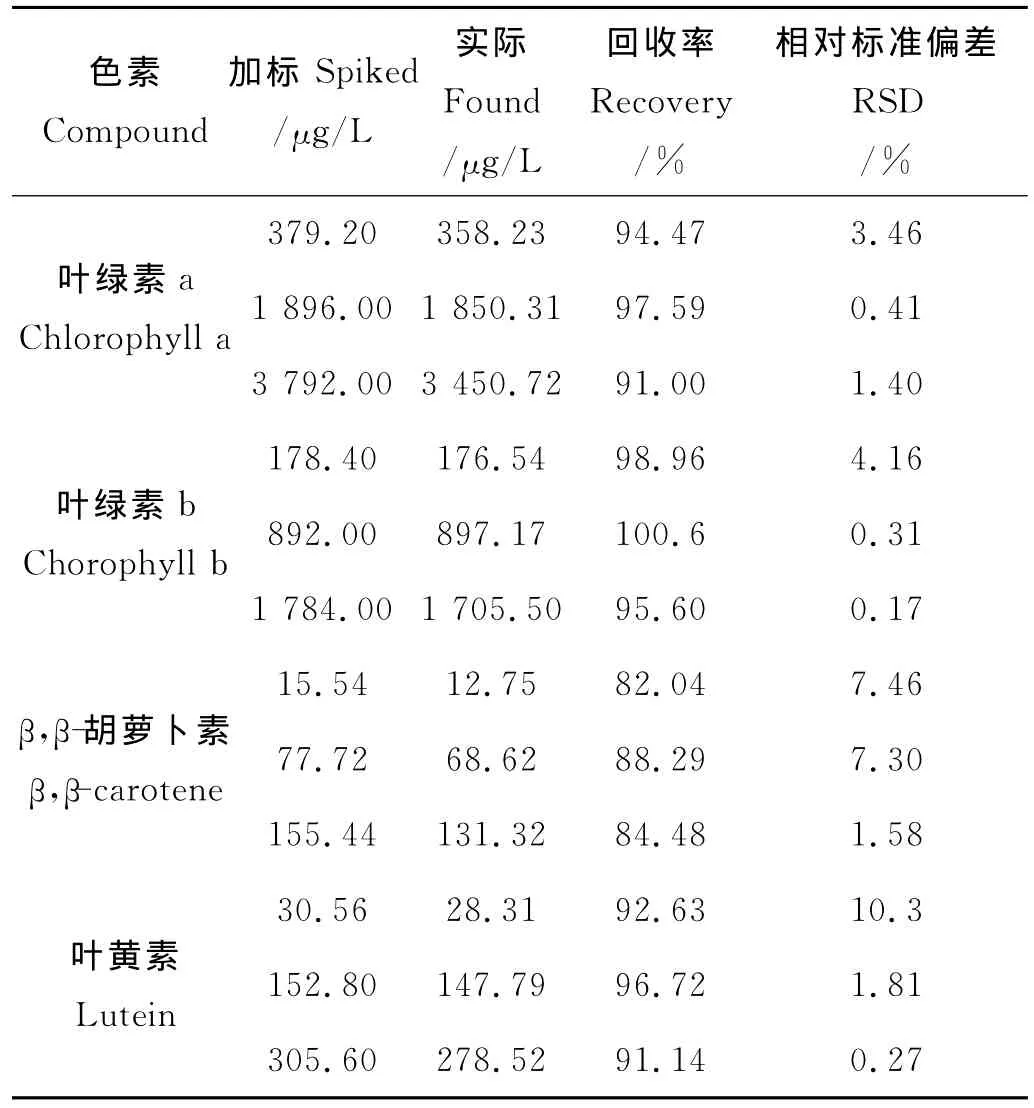
表4 空白样品中4种色素标准的加标回收率(n=3)Table 4 Recoveries of 4pigment standards spiked in a blank sample(n=3)
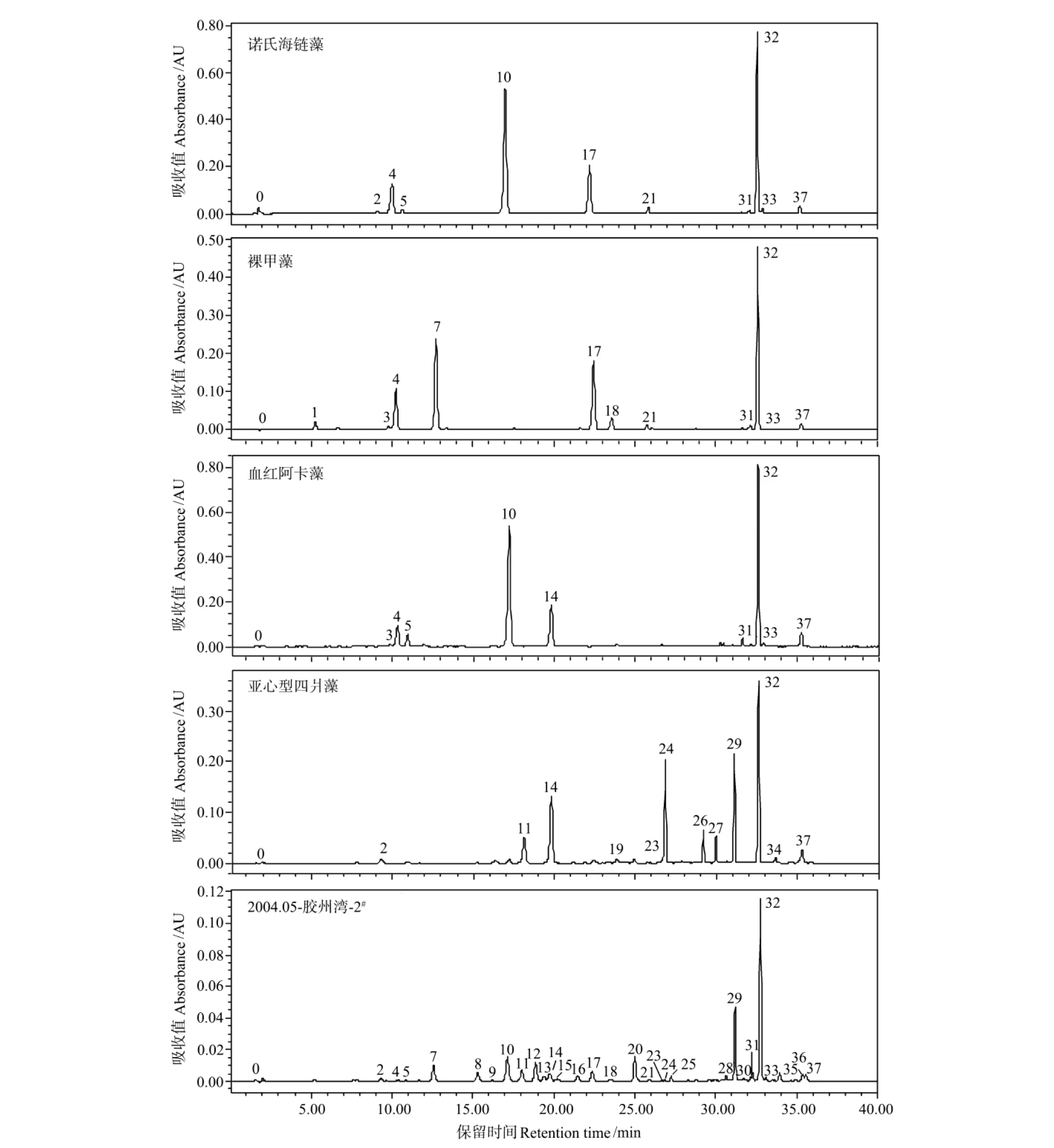
图2 4个参考藻种和1个胶州湾代表性采样站位色素样品的色谱图(440nm)Fig.2 Chromatograms of 4reference marine phytoplankton species and 1representative sampling site of Jiaozhou Bay(440nm).Peak identifications as in Table 5
为进一步检验该方法的准确性,本研究通过添加空白实验方法测定了该方法的回收率。具体方法为:将空白滤膜作为样品,分别添加低、中、高3个浓度级别的标准溶液(分别取色素标准混合溶液的第2、4和6个浓度点)进行加标回收实验,平行测定3次,对结果取平均值,结果见表4。从回收率数据可以看出,除β,β-胡萝卜素外各色素标准的回收率在不同浓度下均在90%以上,RSD也普遍低于5%。β,β-胡萝卜素在3种浓度下的回收率均在80%~90%之间,RSD均<10%。总的来看该方法可以较好地满足藻类样品中色素化合物含量测定的要求。
2.4 分离度
在1.2和1.3节所述的实验步骤和色谱条件下,测定了4种参考藻种和7个航次123个胶州湾现场样品[12]中的色素组成,代表性色谱图如图2所示,所检测出的色素如表5所示。根据式2计算样品中相邻色素的分离度。表5中的数据为样品分析结果的平均值。
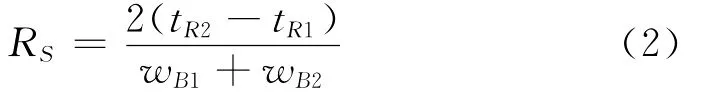
上式中tR1和tR2分别为色素峰1和2的洗脱时间,wB1和wB2分别是色素峰1和2的宽度(单位为min)。色素峰分离度越大表明2个色素分离效果越好,分离值小于1.0则意味着2个相邻色素没有完全分离[14]。

表5 参考藻种和胶州湾现场样品中检测出的色素峰鉴定表Table 5 Identification table of pigment peaks detected in reference species and field samples from Jiaozhou Bay
分离度计算结果如表5所示,可以看到,大部分色素都能获得良好的分离,有8对先后流出的色素没有得到完全分离,它们是MgDVP和叶绿素c2、micromonol和紫黄素、甲藻黄素和百合黄素、硅藻黄素和蓝隐藻黄素、玉米黄素和叶黄素、叶绿素a异质同晶体和叶绿素a、叶绿素a和叶绿素a差向异构体、β,ε-胡萝卜素和β,β-胡萝卜素,其中尤以甲藻黄素和百合黄素最接近,两者的洗脱时间相差在0.3min以内。一般的HPLC色素分析方法中,叶绿素c2和c1往往作为一个峰同时被洗脱(包括曾被联合国教科文组织所推荐的使用C18柱的Wright方法[18]),在本方法中,这2个色素得到了完全分离。玉米黄素和叶黄素的分离是所有HPLC色素分析方法的难点,很多方法也将其作为1个峰洗脱,在本方法中,虽然未能实现基线上的分离,但是可以部分分离(分离度为0.81),2种色素以2个峰先后流出。在这37种色素中有10种是在参考藻种中未检出的,如19′-丁酰氧基岩藻黄素、19′-己酰氧基岩藻黄素、青绿藻黄素、尿酸内酯、别黄素等,主要来自于金藻、定鞭藻、青绿藻(含青绿藻黄素的种类)和隐藻,是这些藻类的特征色素,这些色素的确定需要结合文献资料中的结果,依据保留时间和紫外-可见光谱特征的比较作出。
3 结语
运用统计学方法考察了一种基于反相C8色谱柱的海洋浮游藻色素高效液相色谱分析方法的有效性,包括方法的线性范围、相关系数、精密度和回收率、检测限和定量限、分离度等。结果表明,通过采用色素标准、参考藻种和文献资料结合的方法,可以对样品中的色素进行准确定性和定量。该方法操作简便,具有分离度好、灵敏度高、重复性好、回收率高等优点,适用于培养的藻种和现场样品中的海洋浮游藻色素分析。
[1] Jeffrey S W,Wright S W.Photosynthetic Pigments in Marine Microalgae:Insights from Cultures and the Sea.In Subba Rao D V(editor).Algal Cultures,Analogues of Blooms and Applications[M].Enfield:Science Publishers,2006:33-90.
[2] 于志刚,米铁柱,姚鹏,等.赤潮藻鉴定与定量检测方法进展[J].中国海洋大学学报:自然科学版,2009,39(5):1067-1076.
[3] Wright S W,Jeffrey S W.Pigment Markers for Phytoplankton Production.In Volkman J K(editor).Marine Organic Matter:Biomarkers,Isotopes and DNA,the Handbook of Environmental Chemistry,Vol.2N[M].Berlin:Springer,2006:71-104.
[4] 姚鹏,于志刚,米铁柱.海洋浮游藻类的化学分类法[J].海洋环境科学,2003,22(1):75-80.
[5] 邓春梅,姚鹏,刘淑霞,等.海洋浮游藻色素分析和化学分类研究进展[J].中国海洋大学学报:自然科学版,2010,40(4):91-98
[6] Zapata M,Rodríguez F,Garrido J L.Separation of chlorophylls and carotenoids from marine phytoplankton:a new HPLC method using a reversed phase C8column and pyridine-containing mobile phases[J].Mar Ecol Prog Ser,2000,195:29-45.
[7] Zapata M,Jerrrey S W,Wright S W,et al.Photosynthetic pigments in 37species(65strains)of Haptophyta:implications for oceanography and chemotaxonomy[J].Mar Ecol Prog Ser,2004,270:83-102.
[8] Rodr guez F,Chauton M,Johnsen G,et al.Photoacclimation in phytoplankton:implications for biomass estimates,pigment functionality and chemotaxonomy[J].Mar Biol,2006,148:963-971.
[9] Seoane S,Zapata M,Orive E.Growth rates and pigment patterns of haptophytes isolated from estuarine waters[J].J Sea Res,2009,62:286-294.
[10] Yao P,Yu Z G,Deng C M.Pigment signatures of some diatoms isolated from China seas[J].Acta Oceanol Sin,2006,25(1):108-118.
[11] Yu Z G,Deng C M,Yao P,et al.Prasinoxanthin-containing Prasinophyceae discovered in Jiaozhou Bay,China[J].J Integr Plant Biol,2007,49(4):497-506.
[12] Yao P,Yu Z G,Deng C M,et al.Spatial-temporal distribution of phytoplankton pigments in relation to nutrient status in Jiaozhou Bay,China[J].Estuar Coast Shelf Sci,2010,89(3):234-244.
[13] 朱卓毅.长江口及邻近海域低氧现象的探讨-以光合色素为出发点[D].上海:华东师范大学,2007.
[14] 施奈德L R.实用高效液相色谱法的建立[M].∥张玉奎等译.2版.北京:华文出版社,2001:764.
[15] Mueller J L,Fargion G S,McClain C R.Ocean Optics Protocols for Satellite Ocean Color Sensor Validation,Revision 4,Volume V:Biogeochemical and Bio-Optical Measurements and Data Analysis Protocols[R].NASA/TM-2003-21621/Rev-Vol V,2003,5-14.
[16] 姚鹏.胶州湾浮游藻的色素分析和基于色素的分类方法研究[D].青岛:中国海洋大学,2005.
[17] 邓春梅.中国近海典型浮游藻特征色素分析和化学分类方法研究[D].青岛:中国海洋大学,2008.
[18] Wright S W,Jeffrey S W,Mantoura R F C,et al.Improved HPLC method for the analysis of chorophylls and carotenoids from marine phytoplankton[J].Mar Ecol Prog Ser,1991,77:183-196.
Validation of an High Performance Liquid Chromatography(HPLC)Method Using Reversed Phase C8Column for Marine Phytoplankton Pigments
DENG Chun-Mei1,YAO Peng2,YU Zhi-Gang2,Niu Zeng-Yuan3
(1.Key Laboratory of Marine Spill Oil Identification and Damage Assessment Technology,North China Sea Environment Monitoring Centre,State Oceanic Administration,Qingdao 266033,China;2.Key Laboratory of Marine Chemistry Theory and Technology,Ministry of Education,Department of Chemistry and Chemical Engineering,Ocean University of China,Qingdao 266100,China;3.Shandong Entry-Exit Inspection and Quarantine Bureau,Qingdao 266002,China)
Validation of an high performance liquid chromatography(HPLC)method for marine phytoplankton pigments was conducted.The HPLC method employs reversed phase C8column,methanol,acetonitrile and acetone as mobile phases and pyridine as solvent modifier to improve the separation of pigment peaks.Good linear relationships between the mass concentrations and the peak areas of 4pigment standards,i.e.chlorophyll a,chlorophyll b,β,β-carotene and lutein were observed in the range of 189.6~18960,89.2~8920,7.77~777.2and 15.28~1528μg/L,respectively.The spiked recoveries were more than 90%for most of the standards exceptβ,β-carotene and the relative standard deviations of multiple determinations were lower than 5%.37pigments were detected in 4reference species and 123water samples from Jiaozhou Bay,and baseline separation of some important biomarker pigments were achieved.The validation results showed that the method was sensitive,accurate and reproducible.It was suitable for the analysis of marine phytoplankton pigments from cultures and field samples with high recoveries.Key words: marine phytoplankton;pigment;high performance liquid chromatography(HPLC);validation
O657.72;P734.43
A
1672-5174(2011)05Ⅱ-272-07
国家自然科学基金项目(40806029,40676068)资助
2011-03-17;
2011-03-24
邓春梅(1979-),女,高级工程师,博士。E-mail:deng_cm@ncsemc.gov.cn
**通讯作者:E-mail:yaopeng@ouc.edu.cn
责任编辑 徐 环
