水溶性低分子量壳聚糖对糖尿病大鼠血糖的影响*
2011-01-10韩宝芹蔡文娣宋福来刘万顺
韩宝芹,王 剑,蔡文娣,宋福来,刘万顺
(1.中国海洋大学海洋生命学院,山东青岛266003;2.潍坊医学院,山东潍坊261053)
糖尿病(Diabetes mellitus)是一组以慢性血糖水平增高为特征的代谢性疾病,长期的碳水化合物、脂肪以及蛋白质代谢紊乱可导致多组织慢性进行性病变、功能减退甚至器官衰竭[1]。甲壳素是由N-乙酰-2-氨基-2-脱氧-D-葡萄糖以β-1,4糖苷键的形式连接而成的聚合物,壳聚糖为其脱乙酰产物。已有文献报道,低分子量壳聚糖[2-4]、甲壳低聚糖[5]、壳寡糖[6]对糖尿病大鼠血糖均有调节作用。鉴于低分子量壳聚糖的水溶性较好,以及不同化学修饰的低分子量壳聚糖生物活性不同,本研究对低分子量水溶性壳聚糖进行了结构表征和分子量测定,研究了其对糖尿病大鼠的血糖调节作用,并初步探讨其结构与功能的关系。
1 材料与方法
1.1 实验动物
雄性W istar大鼠50只,购自山东鲁抗医药股份有限公司(清洁级,许可证号SCXK鲁20050017),体质量(200±20)g。大鼠饲养条件:饮食饮水供应充足,每12 h更换洁净塑料鼠笼,室温在18~22℃,光照周期为12 h明亮、12 h黑暗,室内通风良好,氨浓度小于20 ppm,相对湿度为40%~70%。适应饲养1周。
1.2 材料、试剂与仪器
低分子量壳聚糖、低分子量羧甲基壳聚糖、低分子量羧甲基甲壳素(本实验室制备)。
分子量180~84 400 Da右旋糖酐标准品(中国药品生物制品检定所);链脲佐菌素(Strep tozotoccin,STZ,美国Sigma公司);血糖测定试剂盒(上海荣盛生物药业有限公司);糖原测定试剂盒(南京建成生物工程研究所);TU-1800紫外分光光度计(北京普析通用有限责任公司);Waters 1525型液相色谱仪、2414型示差折光检测器(美国Waters公司);Eclipse E200生物显微镜(日本尼康有限公司);PowerShot A 650 IS数码相机(日本佳能公司)。
1.3 方法
1.3.1 水溶性低分子量壳聚糖分子量的测定 采用高效液相色谱分析法测定分子量(Mw)。色谱条件为:色谱柱:Shodex Ohpak SB-806M HQ;流动相:1 mol/L Na2SO4水溶液;柱温:25℃;流速:1 m L/min;进样量20μL;2414型示差折光检测器检测。
对分子量为4 600、7 100、10 000、21 100和84 400 Da的右旋糖酐标准品进行高效液相色谱分析,建立峰位时间与其对应分子量的标准曲线。
对水溶性低分子量壳聚糖进行高效液相色谱分析,根据标准曲线,测定其分子量。
1.3.2 水溶性低分子量壳聚糖乙酰基与羧甲基取代度的测定 采用电位滴定法测定水溶性低分子量壳聚糖乙酰基和羧甲基取代度。精确称取低分子量水溶性低分子量壳聚糖0.100 0 g(准确至0.000 2 g),加入15 mL 0.3 mol/L标准HCl溶液,搅拌至完全溶解。用0.1 mol/L标准NaOH溶液在搅拌下滴定,用数字酸度计测定溶液p H值,直到p H>11时终止滴定,记录p H值和消耗的标准NaOH溶液体积,用一阶微商法找出突跃点。另取一份水溶性低分子量壳聚糖,置于105℃烘干至恒重,测定干燥失重。参照文献[7-8],计算水溶性低分子量壳聚糖乙酰基与羧甲基取代度。
1.3.3 糖尿病大鼠模型的建立 建模大鼠禁食不禁水12 h以上,按65 mg/kg体质量一次性腹腔注射无菌1%STZ柠檬酸钠缓冲液(p H=4.32),正常组大鼠按体质量注射相同剂量柠檬酸钠缓冲液。注射7 d后,禁食不禁水5 h,尾静脉采血测定空腹血糖值(Fasting p lasma glucose,FPG),半定量法测定尿糖,以血糖≥10 mmol/L、尿糖≥+++,并出现多饮、多食、多尿等现象为造模成功。
1.3.4 动物分组及实验方法 正常组(Normal):正常大鼠9只,按体质量每日灌胃蒸馏水5 m L/kg;模型组(DM model):造模大鼠9只,按体质量每日灌胃蒸馏水5 m L/kg;低分子量壳聚糖组(LMC):造模大鼠9只,按体质量每日灌胃低分子量壳聚糖180 m g/kg;低分子量羧甲基壳聚糖(LM-CMC):造模大鼠9只,按体质量每日灌胃低分子量羧甲基壳聚糖180 mg/kg;低分子量羧甲基甲壳素组(LM-CMCT):造模大鼠9只,按体质量每日灌胃羧甲基甲壳素180 mg/kg。每天称质量,根据体质量调整剂量,连续灌胃45 d。
1.3.5 一般状态观察 观察大鼠健康以及活动状况,饮食、饮水是否正常,记录体质量。
1.3.6 空腹血糖 于末次灌胃后,大鼠禁食不禁水5 h,尾静脉采血,采用试剂盒法测定空腹血糖。
1.3.7 糖耐量实验(O ral glucose tolerance test,OGTT) 45 d后,大鼠禁食不禁水5 h,各实验组分别给予相同浓度水溶性低分子量壳聚糖,模型组给予同体积蒸馏水,20 min后,各组大鼠分别按体质量2.0 g/kg灌胃葡萄糖,分别于灌胃葡萄糖后第0、0.5、2 h测定血糖值(Plasma glucose,PG)计算各组大鼠各时间点血糖曲线下面积(AUG)的变化。
糖耐量曲线下面积=1/2×(PG0h+PG0.5h)×0.5+1/2×(PG2h+PG0.5h)×1.5
1.3.8 肝糖原和肌糖原含量的测定 所有大鼠于末次灌胃后处死,分别取肝脏组织75 mg,肌肉组织85 mg于试管中,按比例加入一定体积碱液,沸水浴煮20 min,流水冷却,加蒸馏水稀释后,试剂盒法测定肝糖原、肌糖原含量。
1.3.9 病理组织切片观察 所有大鼠于末次灌胃后处死,取新鲜胰腺组织,肉眼观察是否有病变,取接近胰尾部分固定,脱水,透明,制成7μm石蜡切片,经HE染色后于显微镜下观察组织学变化,拍照。
1.4 数据统计分析
采用SPSS 11.0软件对数据进行方差分析,各组数据均以SE)表示,组间比较采用Duncan’s法,以P<0.05为具有显著性差异。
2 结果
2.1 水溶性低分子量壳聚糖的分子量测定
经高效液相色谱分析,以不同分子量右旋糖酐标准样分离的保留时间与其对应的分子量值绘制标准曲线,回归方程为Ln(M n)=14.092 28-0.509 7305*T,相关系数为0.995 875 5,方差为0.073 167 69。
水溶性低分子量壳聚糖分子量测定结果见表1。
2.2 水溶性低分子量壳聚糖表征的测定
电位滴定法测定样品的乙酰基取代和羧甲基取代度,结果见表1。

表1 水溶性低分子量壳聚糖的分子量、脱乙酰度及取代度Table 1 Molecular acetyl,carboxymethyl degree of water-soluble low molecular chitosan
2.3 动物实验结果
2.3.1 一般状态观察 与正常大鼠比较,糖尿病大鼠造模后出现多饮、多食、多尿症状,体毛松散,精神萎靡,活动量减少,体质量降低(见表2)。与模型组相比较,各水溶性低分子量壳聚糖组大鼠体质量有所增高,且在一定程度上改善了糖尿病大鼠上述症状。其中,低分子量羧甲基甲壳素组与模型组大鼠相比较,体质量增长率为45.94%,有极显著性差异(P<0.01)。
表2 水溶性低分子量壳聚糖对糖尿病大鼠体质量的影响(n=9,E)Table 2 Effects of water-soluble low molecular chitosan on body weight in diabetic rats(n=9,SE)
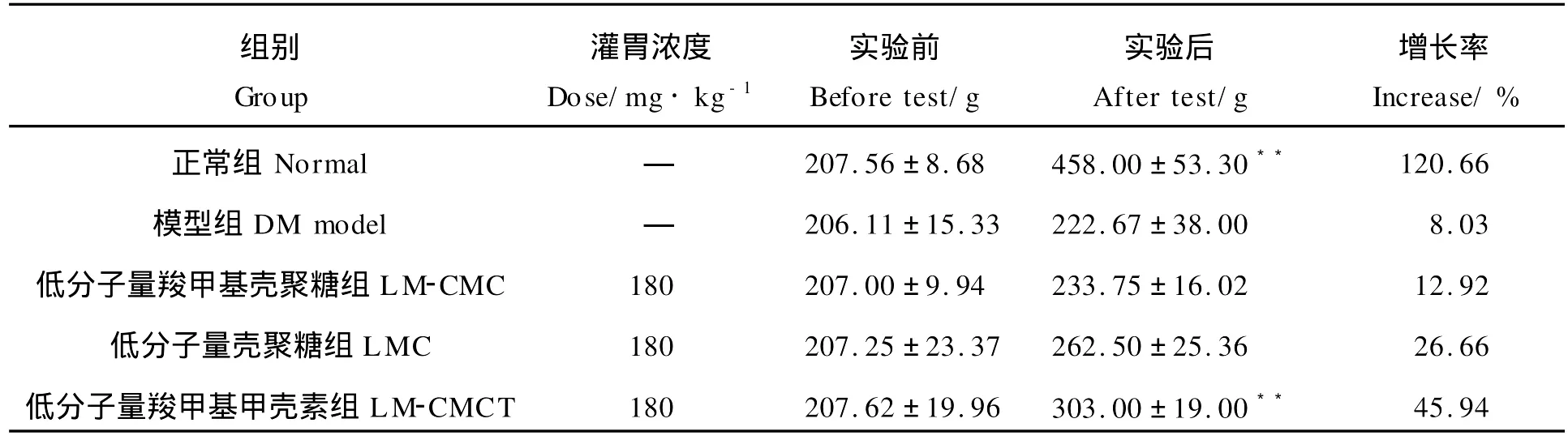
表2 水溶性低分子量壳聚糖对糖尿病大鼠体质量的影响(n=9,E)Table 2 Effects of water-soluble low molecular chitosan on body weight in diabetic rats(n=9,SE)
注:与DM模型组相比较,*P<0.05,**P<0.01。Compared with DM model group,*P<0.05,**P<0.01.
组别Group灌胃浓度Dose/mg·kg-1实验前Befo re test/g实验后After test/g增长率Increase/%正常组Normal—207.56±8.68 458.00±53.30**120.66模型组DM model—206.11±15.33 222.67±38.00 8.03低分子量羧甲基壳聚糖组LM-CMC 180 207.00±9.94 233.75±16.02 12.92低分子量壳聚糖组LMC 180 207.25±23.37 262.50±25.36 26.66低分子量羧甲基甲壳素组LM-CMCT 180 207.62±19.96 303.00±19.00**45.94
2.3.2 水溶性低分子量壳聚糖对大鼠空腹血糖的影响
模型组血糖在造模45 d后为(31.29±2.38)mmol·L-1,各水溶性低分子量壳聚糖组大鼠空腹血糖与模型组相比较有不同程度的降低,其中低分子量壳聚糖组大鼠空腹血糖为(22.58±1.79)mmol·L-1,低分子量羧甲基甲壳素组为(20.64±2.21)mmol·L-1,这两组数据与模型组大鼠空腹血糖相比较有极显著差异(P<0.01,见表3),说明低分子量壳聚糖和低分子量羧甲基甲壳素可以降低糖尿病大鼠的空腹血糖水平。
表3 水溶性低分子量壳聚糖对糖尿病大鼠空腹血糖的影响(n=9,SE)Table 3 Effects of water-soluble low molecular chitosan on fasting p lasma glucose in diabetic rats(n=9,SE)
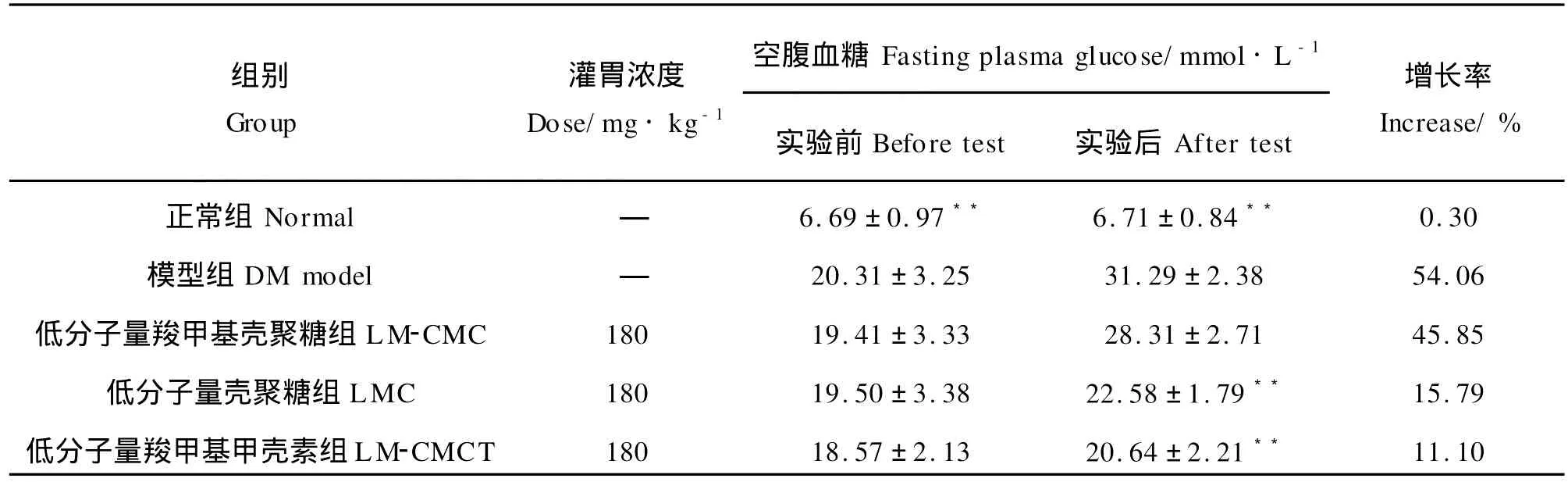
表3 水溶性低分子量壳聚糖对糖尿病大鼠空腹血糖的影响(n=9,SE)Table 3 Effects of water-soluble low molecular chitosan on fasting p lasma glucose in diabetic rats(n=9,SE)
注:与DM模型组相比较,*P<0.05,**P<0.01。Compared with DM model group,*P<0.05,**P<0.01.
组别Group增长率Increase/%空腹血糖Fasting plasma glucose/mmol·L-1正常组Normal—6.69±0.97**6.71±0.84**0.30灌胃浓度Dose/mg·kg-1模型组DM model—20.31±3.25 31.29±2.38 54.06低分子量羧甲基壳聚糖组LM-CMC 180 19.41±3.33 28.31±2.71 45.85低分子量壳聚糖组LMC 180 19.50±3.38 22.58±1.79**15.79低分子量羧甲基甲壳素组LM-CMCT 180 18.57±2.13 20.64±2.21**11.10实验前Before test实验后After test
2.3.3 溶性低分子量壳聚糖对糖尿病大鼠糖耐量的影响 与模型组相比较,各实验组大鼠在不同时相血糖值(PG)均有不同程度降低(见表4)。其中,低分子量壳聚糖组与模型组相比较,PG0h,PG0.5h,PG2.0h均有显著降低(P<0.05),低分子量羧甲基甲壳素组与模型组相比较,PG0h,PG0.5h,PG2.0h降低极显著(P<0.01)。
表4 水溶性低分子量壳聚糖对糖尿病大鼠糖耐量实验各时相血糖值的影响(n=9,SE)Table 4 Effects of water-soluble low molecular chitosan on plasma glucose of each time phase of OGTT in diabetic rats(n=9,SE)

表4 水溶性低分子量壳聚糖对糖尿病大鼠糖耐量实验各时相血糖值的影响(n=9,SE)Table 4 Effects of water-soluble low molecular chitosan on plasma glucose of each time phase of OGTT in diabetic rats(n=9,SE)
注:与DM模型组相比较,*P<0.05,**P<0.01。Compared with DM model group,*P<0.05,**P<0.01.
组别Group灌胃浓度Dose/mg·kg-1血糖Plasma glucose/mmol·L-1 0小时0 h 0.5小时0.5 h 2小时2 h正常组Normal—7.11±0.80**9.12±0.70**7.56±1.18**模型组DM model—33.21±1.92 40.36±9.02 32.98±1.28低分子量羧甲基壳聚糖组LM-CMC 180 29.92±4.75 34.21±5.66 27.80±5.08低分子量壳聚糖组LMC 180 24.80±2.83*29.97±2.09**20.78±5.65**低分子量羧甲基甲壳素组LM-CMCT 180 19.89±4.03**26.91±3.31**23.37±7.56*
以模型组糖耐量曲线下面积(AUC)为100%计算,如表5所示,正常组糖耐量曲线下面积为22.59%,低分子量羧甲基壳聚糖组为85.20%,低分子量壳聚糖组为70.51%,低分子量羧甲基甲壳素组为67.32%,其中低分子量壳聚糖组与低分子量羧甲基甲壳素组有极显著差异(P<0.01)。
通过糖耐量实验中各实验组的不同时相血糖值、糖耐量曲线下面积与模型组相比较,从结果可以看出,低分子量壳聚糖与低分子量羧甲基甲壳素可以明显降低糖尿病大鼠的糖耐量,在机体摄入葡萄糖后快速降低血糖水平。
表5 水溶性低分子量壳聚糖对糖尿病大鼠糖耐量实验曲线下面积的影响(n=9SE)Table 5 Effectsof water-soluble low molecular chitosan on AUC of OGTT in diabetic rats(n=9,SE)

表5 水溶性低分子量壳聚糖对糖尿病大鼠糖耐量实验曲线下面积的影响(n=9SE)Table 5 Effectsof water-soluble low molecular chitosan on AUC of OGTT in diabetic rats(n=9,SE)
注:与DM模型组相比较,*P<0.05,**P<0.01。Compared with DM model group,*P<0.05,**P<0.01.
组别Group灌胃浓度Dose/mg·kg-1糖耐量曲线下面积AUC/mmol·L-1曲线下面积百分数AUC/%正常组No rmal—16.58±0.94**22.59模型组DM model—73.41±10.06 100低分子量羧甲基壳聚糖组LM-CMC 180 62.54±7.84 85.20低分子量壳聚糖组LMC 180 51.76±5.8**70.51低分子量羧甲基甲壳素组LM-CMCT 180 49.42±8.12**67.32
2.3.4 水溶性低分子量壳聚糖对糖尿病大鼠肝糖原和肌糖原的影响 由表6中得知,低分子量壳聚糖组肝糖原含量为(17.48±2.35)mmol·g-1,与模型组相比有极显著提高(P<0.01)。低分子量羧甲基壳聚糖组与低分子量羧甲基甲壳素组大鼠肝糖原含量与模型组相比较也有所升高,但无显著性差异。
水溶性低分子量壳聚糖各组大鼠肌糖原含量与模型组相比较有所增加,但无显著性差异。
表6 水溶性低分子量壳聚糖对糖尿病大鼠肝糖原和肌糖原的影响(n=9,SE)Table 6 Effects of water-soluble low molecular chitosan on hepatic glycogen and muscular glycogen in diabetic rats(n=9,SE)

表6 水溶性低分子量壳聚糖对糖尿病大鼠肝糖原和肌糖原的影响(n=9,SE)Table 6 Effects of water-soluble low molecular chitosan on hepatic glycogen and muscular glycogen in diabetic rats(n=9,SE)
注:与DM模型组相比较,*P<0.05,**P<0.01。Compared with DM model group,*P<0.05,**P<0.01.
组别Group灌胃浓度Dose/mg·kg-1肝糖原Hepatic glycogen/mmol·g-1肌糖原M uscle glycogen/mmol·g-1正常组Normal—20.54±6.11**2.05±0.53**模型组DM model—9.42±3.4 51.62±0.39低分子量羧甲基壳聚糖组LM-CMC 180 13.12±3.47 1.99±0.38低分子量壳聚糖组LMC 180 17.48±2.35**1.99±0.51低分子量羧甲基甲壳素组LM-CMCT 180 9.72±2.23 1.96±0.20
2.3.5 水溶性低分子量壳聚糖对糖尿病大鼠胰腺组织结构的影响 显微观察显示,正常组大鼠胰岛(见图1A)呈球形细胞团,形状规则,由结缔组织膜包被,与外分泌部界限清楚。细胞核核仁清晰,胞浆丰富,胰岛细胞边缘整齐。糖尿病大鼠胰腺均有不同程度的病变,胰岛数目明显减少,萎缩或退化,伴有炎症细胞侵润,且与外分泌腺界限模糊,胰岛细胞向外扩散(见图1B)。各治疗组胰岛形态较模型组有所改善,其中低分子量羧甲基壳聚糖组(见图1C)胰岛细胞数目减少,有细胞肥大现象;低分子量壳聚糖组(见图1D)胰岛细胞保留数目较多,有轻度纤维细胞增生;低分子量羧甲基甲壳素组(见图1E)胰岛边缘轻度纤维化,其他与正常组差别不大。说明水溶性低分子量壳聚糖可以促进受损胰岛细胞修复,可能有刺激胰腺细胞增殖的作用。
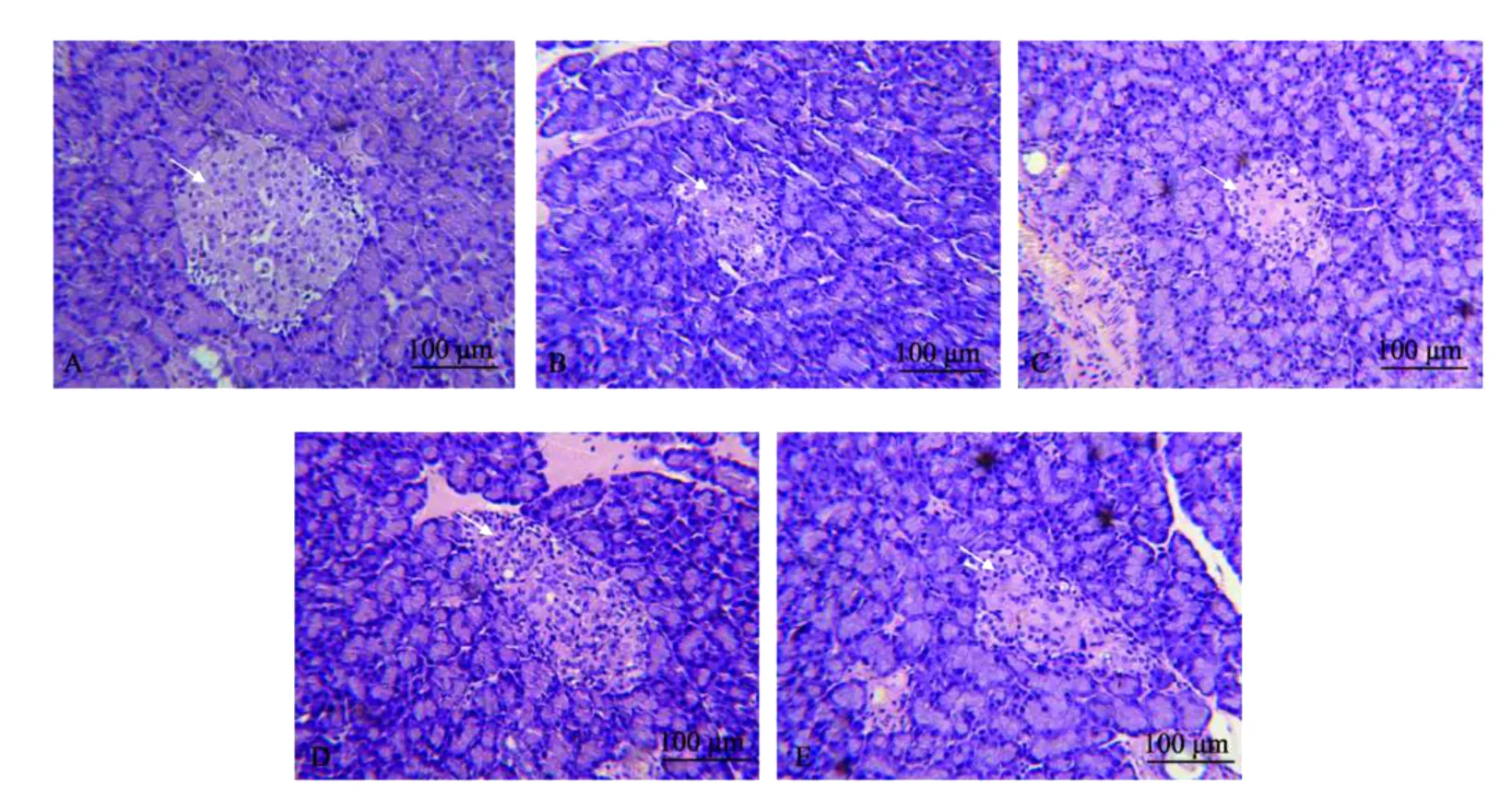
图1 灌胃45 d后各组大鼠胰腺病理组织切片染色观察Fig.1 Observation on pathologic tissue biop sy dyeing of rats pancreas in each group after fed 45 days later
3 讨论
壳聚糖可以经酶解形成低分子量壳聚糖和壳寡糖,也可以经过化学修饰形成不同基团衍生化产物,该产物既具有水溶性,同时具有壳聚糖的生物活性。已有较多关于壳聚糖、壳寡糖降低血糖作用、羧甲基壳寡糖[9]促进大鼠胰岛细胞生长、并能体外显著促进胰岛细胞释放胰岛素等的报道。且Nordtveit等研究发现不完全脱乙酰度的壳聚糖较完全脱乙酰度的壳聚糖更容易被溶菌酶消化[10]。低分子量壳聚糖在肠胃中可以形成胶状粘性纤维,降低肠道内双糖酶活性,延缓胃排空,降低糖吸收速度,增加周围组织对胰岛素的敏感性[11]。综合已有文献,低分子量壳聚糖的调节血糖作用较高分子量壳聚糖调节血糖作用更好,不同结构的低分子量壳聚糖对动物高血糖的调节作用可能不同。
糖原合成是机体储存多余葡萄糖的一个重要途径,胰岛素可以通过激活糖原合成酶磷酸酶来促进肝脏、肌肉中糖原的合成。有研究发现糖尿病大鼠的肝糖原合成酶活性降低[12],本研究发现,水溶性低分子量壳聚糖可以提高糖尿病大鼠肝糖原、肌糖原含量,提示其调节作用可能是通过提高机体对胰岛素的敏感性,从而促进糖原合成,降低血液中葡萄糖含量。
本实验研究了3种不同化学修饰的水溶性低分子量壳聚糖对大鼠高血糖的影响,三者的分子量在10 000~25 000 Da。从分子结构特征看,低分子量羧甲基壳聚糖与低分子量羧甲基甲壳素分子量相近,羧化度相当,但前者乙酰基取代度低(7.50%),后者乙酰基取代度高(89.96%)。而低分子量壳聚糖则不含羧基,其乙酰基取代度(52.71%)介于低分子量羧甲基壳聚糖与低分子量羧甲基甲壳素之间。三者对血糖的调节作用相比较,羧甲基甲壳素降低血糖、改善糖耐量效果最好,低分子量壳聚糖效果次之,因此从分子结构角度推测,水溶性低分子量壳聚糖的乙酰基可能在糖尿病大鼠血糖调节中发挥重要作用。其调节血糖作用机理还有待进一步研究。
[1] 陆再英,钟南山.内科学[M].(第7版).北京:人民卫生出版社,2008:770-771.
[2] Lee H W,Park Y S,Choi JW,et al.Antidiabetic effect of chitosan oligosaccharides in neonatal strep tozotocin-induced noninsulin-dependent diabetesmellitus in rats[J].Biological and Pharmaceutical Bulletin,2003,26(8):1100-1103.
[3] Hsien-Tsung Y,Shan-Ye H A.Comparative study on hypoglycemic and hypocholesterolemic effects of high and low molecular weight chitosan in streptozotocin-induced diabetic rats[J].Food and Chemical Toxicology,2008,46:1525-1534.
[4] Hayashi K,Ito M.Antidiabetic action of low molecular weight chitosan in genetically obese diabetic KK-AyMice[J].Biol Pham Bull,2002,25(2):188-192.
[5] 乔新惠,李邦良,宋岚.甲壳低聚糖对NOD小鼠降血糖作用观察[J].南华大学学报:医学版,2003,31(3):260-261,271.
[6] 刘冰,刘万顺,韩宝芹,等.壳寡糖促胰岛细胞增殖、胰岛素分泌及调节餐后血糖作用的研究[J].同济大学学报:医学版,2006,27(60):6-11.
[7] 徐文峰,廖晓玲.碱量法测定壳聚糖脱乙酰度的研究[J].分析实验室.2008,27(增刊):219-231.
[8] 刘长霞,陈国华,晋治涛,等.N,O-羧甲基壳聚糖羧化度计算式的修正[J].北京化工大学学报,2004,1(2):14-16.
[9] 韩宝芹,刘成圣,王绪敏,等.羧甲基壳聚糖、盐酸氨基葡萄糖及N-乙酰氨基葡萄糖对大鼠胰岛细胞生长及胰岛素分泌量的影响[J].中国生物医学工程学报,2004,23(2):187-191.
[10] Nordtveit R J,Vaarum K M,Smidstord O.Degradation of partially N-acetylated chitosans with hen egg white and human lysozyme[J].Carbohydr Polymers,1996,29(2):163-167.
[11] Choi Y S,Cho S H,Kim H J,et al.Effects of soluble dietary fiberson lipidmetabolism and activitiesof intestinal disaccharidases in rats[J].Nutrtion Science Vitaminol,1998,44:591-600.
[12] 王艳荣,钱荣立,马晓伟.实验性糖尿病大鼠肝糖原合成酶活性的改变[J].北京医科大学学报,1998,30(1):46-18.
