胸腺素α1-胸腺五肽在大肠杆菌中的表达及表达条件优化
2011-01-06王凤山
谢 琦,李 娟,王凤山
(1.桂林医学院 生物技术学院,广西 桂林 541004;2.山东大学 药学院 生化与生物技术药物研究所,山东 济南 250012)
胸腺素α1-胸腺五肽在大肠杆菌中的表达及表达条件优化
谢 琦1,2,李 娟2,王凤山2
(1.桂林医学院 生物技术学院,广西 桂林 541004;2.山东大学 药学院 生化与生物技术药物研究所,山东 济南 250012)
目的 探讨胸腺素α1-胸腺五肽(Tα1-TP5)在大肠杆菌中的表达及表达条件优化。方法 将化学合成的Tα1-TP5基因与原核表达载体pGEX-4T-1融合并转化至E.coli BL21(DE3),异丙基-β-D-硫代半乳糖苷(IPTG)诱导表达。利用SDS-PAGE电泳和AlphaEase凝胶电泳图像分析系统研究培养基组成、诱导时机、诱导温度、诱导剂浓度及诱导时间等条件对融合蛋白表达量的影响。融合蛋白经GST琼脂糖珠亲和色谱纯化及重组肠激酶切割后,电喷雾质谱鉴定Tα1-TP5。结果 选用TB培养基,在菌体对数生长中后期加入终浓度为0.05 mmol/L的IPTG,37℃诱导5 h,GST融合蛋白的表达量最高,占菌体总蛋白的35.8%,且主要以可溶形式表达。Tα1-TP5的分子质量与理论值相似。结论 Tα1-TP5成功在E.coli中表达,并确定了最佳表达条件。
胸腺素α1-胸腺五肽;胸腺融合肽;GST融合蛋白;大肠杆菌;表达条件
胸腺素 α1(Thymosin α1,Tα1)是胸腺组分 5(Thymosin fraction 5)中分离出来的由28个氨基酸组成的多肽,是一种针对T细胞的免疫增强剂,目前被广泛应用于重度感染、肝炎和肿瘤的免疫治疗[1-2]。胸腺五肽 (Thymopentin,TP5)是胸腺生成素Ⅱ第32~36位的氨基酸残基片段,具有诱导T细胞分化、促进T淋巴细胞亚群发育并活化的功能。TP5主要用于治疗免疫缺陷、自身免疫性疾病、传染病、肿瘤和艾滋病等。由于Tα1和TP5具有相似的生物学活性和临床用途,Gao等[3]对二者的融合肽Tα1-TP5在毕赤酵母中进行了表达,活性研究表明Tα1-TP5作用效果在某些方面要大于两者单独使用的效果,但Tα1-TP5在毕赤酵母中的表达量不够理想。因此,本文构建了pGEX-4T-1/Tα1-TP5原核表达载体,并以大肠杆菌(E.coli)作为宿主菌进行了表达。为了提高Tα1-TP5的表达量,本研究通过优化外源基因在E.coli中表达的几个重要影响因素,以期确立GST-Tα1-TP5融合蛋白高效表达的最佳条件,为进一步研究Tα1-TP5融合肽的生物学活性及产业化开发创造条件。
1 材料
Tα1-TP5基因及上下游引物,均由上海生工生物工程有限公司化学合成;E.coli DH5α、BL21(DE3)和载体pGEX-4T-1,均由山东大学药学院生化与生物技术药物研究所保存。
限制性内切酶Bam HⅠ和XhoⅠ、Taq DNA聚合酶、T4DNA连接酶、低分子质量蛋白Marker,大连宝生物公司;DNA Marker、质粒提取试剂盒、胶回收试剂盒,天根生化科技有限公司;异丙基β-D-硫代半乳糖苷(IPTG),Amresco公司;重组肠激酶,上海欣百诺生物技术有限公司;GST琼脂糖珠,上海闪晶分子生物科技有限公司。
2 方法
2.1 pGEX-4T-1/Tα1-TP5 表达质粒的构建
依据人源性的Tα1和TP5的分子结构,设计了一个由三个甘氨酸构成的连接肽将Tα1和TP5相连,Tα1和TP5分别位于融合肽的N端和C端,记作Tα1-(Gly)3-TP5基因,同时在Tα1前端加入肠激酶酶切位点(方框内序列)。所合成的序列如下:5'-GAC GAC GAT GAT AAA TCT GAT GCGGCCGTT GAT ACCTCTTCTGAA ATTACGACCAAA GATCTG AAA GAA AAG AAA GAA GTG GTT GAA GAA GCG GAGAACGGCGGTGGCCGCAAA GATGTGTAC-3'。上游引物P1:5'-TAGGATCCCACCATCATCACCATCACTGTAAAACGACG-3',下游引物 P2:5'-GCAGTCAGCACTCGAGAATGATTACGCCAAGC-3'。在上游引物中增加Bam HⅠ酶切位点和组氨酸标签,下游引物中增加XhoⅠ酶切位点。PCR扩增目的基因后,琼脂糖电泳回收目的基因。目的基因和质粒载体pGEX-4T-1均用Bam HⅠ和XhoⅠ双酶切后再回收。用T4DNA连接酶将目的基因片段与载体片段于16℃连接过夜,连接产物电转化至E.coli DH5α,挑取单菌落,接种于含100μg/mL氨苄西林(Amp)的LB培养基,提取质粒pGEX-4T-1/Tα1-TP5,双酶切鉴定,并送上海生工生物工程有限公司测序。
2.2 GST融合蛋白的诱导表达及可溶性分析
将测序正确的 pGEX-4T-1/Tα1-TP5重组质粒和空白质粒pGEX-4T-1电转化至E.coli表达菌株BL21(DE3),分别取含有重组质粒和空白质粒的转化菌,37℃,220 r/min振荡培养至A600值为0.8时,加入终浓度为1 mmol/L的IPTG,同时设未诱导组(不加IPTG)做阴性对照,诱导表达4 h,离心收集菌体,用12%SDS-PAGE电泳检测,AlphaEase凝胶电泳图像分析系统分析样品中所含GST融合蛋白的比例。将诱导表达后收集的菌体置于冰水浴中超声破菌,12 000 r/min离心10 min,取上清和沉淀与上述菌体一起进行12%SDS-PAGE电泳,分析目的蛋白的可溶表达情况。
2.3 GST-融合蛋白表达条件的优化
2.3.1 培养基的选择 将工程菌分别接种于含氨苄西林(Amp)的LB及TB培养基中,在时间、温度、IPTG浓度等相同的条件下进行诱导表达,收集菌体,进行12%SDS-PAGE分析。
2.3.2 诱导时机的选择 根据2.3.1的实验结果,TB培养基更有利于目的蛋白的表达,故以下实验均使用TB培养基。
含重组质粒的新鲜菌液,以0.5%的接种量接种于TB液体培养基(含100μg/mL Amp)中,根据所测定的该菌株的生长曲线,分别在对数生长初期、中期和中后期,即菌液 A600值分别为 0.5,0.9 和 1.4时,分别加入终浓度为1 mmol/L的IPTG,37℃诱导4 h,收集菌体,进行12%SDS-PAGE分析。
2.3.3 诱导温度的选择 培养含重组质粒的BL21(DE3)至最佳诱导 A600值时,加入终浓度为1 mmol/L的IPTG,分别在25,30和37℃诱导4 h,收集菌体,进行12%SDS-PAGE分析。
2.3.4 IPTG诱导浓度的选择 培养含重组质粒的BL21(DE3)至最佳诱导A600值时,分别加入终浓度为 0.01,0.05,0.1,1.0 和 2.0 mmol/L 的 IPTG,在最佳诱导温度下诱导4 h,收集菌体,进行12%SDSPAGE分析。
2.3.5 诱导时间的选择 培养含重组质粒的BL21(ED3)至最佳诱导A600值时,加入最佳诱导浓度的IPTG,在最佳诱导温度下分别诱导 1,2,3,4,5 和6 h,收集菌体,进行12%SDS-PAGE分析。同时在最优的发酵条件下,用AlphaEase凝胶电泳图像分析系统分析样品中所含GST融合蛋白的比例。
2.4 Tα1-TP5融合肽的纯化及鉴定
将诱导表达的培养物离心,收集菌体并用磷酸盐缓冲液(PBS)重悬,超声破碎,于4℃,8 000 r/min离心20 min。PBS平衡GST琼脂糖珠,加入细胞裂解上清,亲和吸附融合蛋白,轻柔混合10 min后弃上清。用50 mmol/L Tris-HCl缓冲液(pH 8.0)清洗结合了融合蛋白GST琼脂糖珠以除去未结合的杂蛋白。然后用50 mmol/L Tris-HCl缓冲液(pH 8.0)重悬GST琼脂糖珠,在结合了GST融合蛋白的GST琼脂糖珠中加入重组肠激酶(37℃,16 h内降解0.5 mg融合蛋白单位)于37℃反应过夜,经酶解后,GST仍结合在GST琼脂糖珠上,而重组胸腺肽Tα1-TP5在上清中。短暂离心沉淀GST琼脂糖珠,取上清至无菌EP管中,进行电喷雾质谱(ESI-MS)分析。
3 结果
3.1 重组表达质粒的鉴定
重组表达质粒pGEX-4T-1/Tα1-TP5经Bam HⅠ和XhoⅠ双酶切鉴定,可见约216 bp的特异片段,与预计片段大小一致,结果见图1。重组质粒经测序分析证实为 pGEX-4T-1/Tα1-TP5,测序结果为:TAGGATCCCACCATCATCACCATCACTGTAAAACG ACG GCCAGTGAATTCTCCGCGGGTGACGACGATG ATAAATCTGATGCGGCCGTTGATACCTCTTCTGAAA TTACGACCAAAGATCTGAAAGAAAAGAAAGAAGT GGTTGAAGAAGCGGAGAACGGCGGTGGCCGCAAA GATGTGTACTAATAAGAGCTCAA GCTTGGCGTAA TCATTCTCGAGTGCTGACTGC,其中方框内为引物序列。

图1 重组表达质粒的双酶切鉴定Fig.1 Restriction map of recombinant expression vector
3.2 GST-融合蛋白的诱导表达及可溶性分析
SDS-PAGE分析表明,含重组质粒的 BL21(DE3)经诱导后在分子质量32 000处有特异蛋白条带,大小与预期相符,而未诱导组、空载体诱导组未见表达增强的条带。同时通过对超声后的上清和沉淀进行分析可知GST-融合蛋白主要存在上清中,表明GST-融合蛋白主要以可溶的形式进行表达,结果见图2。

图2 表达产物的SDS-PAGE分析Fig.2 SDS-PAGE analysis of expressed product
3.3 GST融合蛋白的最佳表达条件
3.3.1 培养基的选择 在TB培养基中目的蛋白的表达量高于LB,结果见图3。

图3 目的蛋白在不同培养基中的表达情况Fig.3 Expression of target protein in different culture mediums
3.3.2 诱导时机的选择 在菌体生长期的各个阶段加入IPTG均有目的蛋白的表达。比较发现,在菌体对数生长期的中后期(A600约为1.4)时进行诱导,目的蛋白的表达量最高,但只是略高于中期(A600约为0.9),明显高于前期。说明在对数生长的早期诱导不利于目的蛋白的表达。结果见图4。

图4 不同时期诱导目的蛋白表达的情况Fig.4 Expression of target protein in different induction time
3.3.3 诱导温度的选择 在不同温度(25,30,37℃)下进行诱导,目的蛋白的表达量不同。在37℃时,目的蛋白的表达量最高,结果见图5。
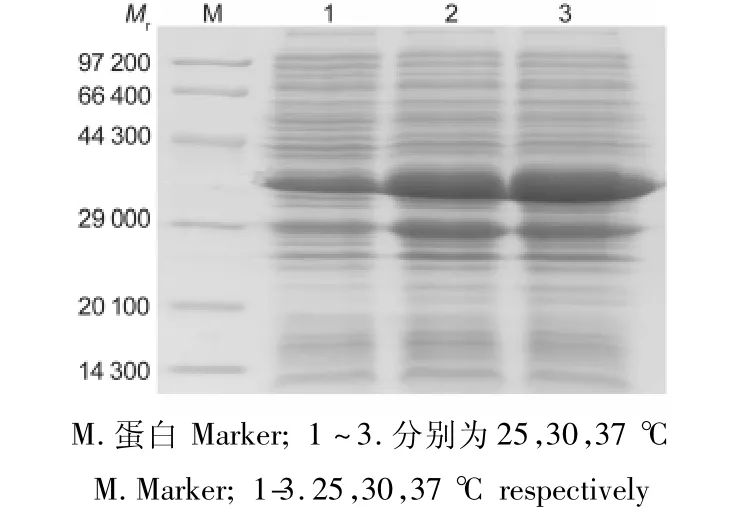
图5 目的蛋白在不同诱导温度下的表达情况Fig.5 Expression of target protein in different induction temperatures
3.3.4 IPTG诱导浓度的选择 结果见图6。IPTG终浓度为0.01 mmol/L时即可诱导目的蛋白的表达,说明工程菌对IPTG的诱导效应十分敏感,较低浓度的IPTG既能启动目的基因的高效表达。IPTG浓度达到0.05 mmol/L后,目的蛋白的表达量不再随IPTG浓度的增加而增加。所以对此工程菌而言,IPTG的最佳诱导浓度是0.05 mmol/L。
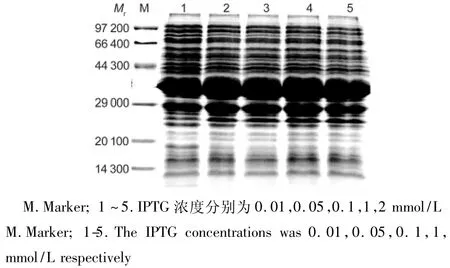
图6 不同浓度IPTG的诱导结果Fig.6 The target protein expression induced by IPTG at different concentrations
3.3.5 诱导时间的选择 结果见图7。加入IPTG后,目的蛋白的表达随着诱导时间的增加而增加,至5 h达到最高,之后目的蛋白的表达不再随时间的增加而增加。故最佳诱导时间为5 h。在最佳发酵条件下,工程菌表达的GST融合蛋白占全菌总蛋白的 35.8%。
3.4 胸腺融合肽Tα1-TP5的鉴定
工程菌表达的GST融合蛋白经GST琼脂糖珠亲和纯化,肠激酶切割后,含目的肽的上清液经ESIMS分析,结果显示其质荷比为3 900,与Tα1-TP5的理论分子质量相吻合。质谱鉴定结果证明Tα1-TP5在大肠杆菌中得到了表达。

图7 诱导时间对目的蛋白表达的影响Fig.7 Effect of induction time on the expression of target protein
4 讨论
Tα1是一种热稳定多肽,血浆半衰期(t1/2)长达2 h,体内活性较高。TP5的t1/2很短,仅有30 s,但却能引起较长时间的免疫调节效果,且极少产生毒副作用,是一种非常安全的药物[4]。如果在两个活性肽之间设计一段Linker来保证两边多肽的完整结构和活性,那么由Tα1和TP5组成的融合肽不仅有可能发挥Tα1和TP5协同作用,还有可能提高TP5的t1/2,达到增效的作用。基于这样的设想,我们构建了pGEX-4T-1/Tα1-TP5重组表达载体,在 E.coli中实现了Tα1-TP5与GST基因的融合表达。
应用重组DNA技术将外源基因转入适当宿主细胞进行异源高效表达,是制备肽类物质的有效方法。影响外源基因在E.coli中表达的因素很多,如启动子启动强度、密码子偏爱性、载体的类型、宿主菌的特征、培养条件及营养状况等,而发酵条件的优化也是蛋白表达的一个关键环节。通过对培养基、诱导时机、诱导温度、诱导剂浓度及诱导时间的优化,可以提高目的蛋白的产量,且具有很强的可操作性。本研究结果表明,优化培养条件可以有效提高目的蛋白的表达量,GST融合蛋白占全菌总蛋白的35.8%。这为进一步研究胸腺融合肽Tα1-TP5的生物学活性和大规模发酵打下了基础。
[1]Sugahara S,Ichida T,Yamagiwa S,et al.Thymosin-alphal increases intrahepatic NKT cells and CTLs in patients with chronic hepatitis B[J].Hepatol Res,2002,24(4):346-354.
[2]Sasaki H,Fujii Y,Masaoka A,et al.Elevatedplasma thymosinalphal levels in lung cancer patients[J].Eur J Cardiothorac Surg,1997,12(6):885-891.
[3]Gao D,Zhang X,Zhang J,et al.Expression of thymosin α1-thymopentin fusion peptide in Pichia pastoris and its characterization[J].Arch Pharm Res,2008,31(11):1471-1476.
[4]左朋飞,韩 香,刘 璐.胸腺五肽的合成及临床应用进展[J].天津医学,2008,20(1):53-57.
Expression and optimization of expression conditions of Tα1-TP5 fusion peptide in E.coli
XIE Qi1,2,LI Juan2,WANG Feng-shan2
(1.School of Biotechnology,Guilin Medical University,Guilin 541004,China;2.Institute of Biochemical and Biotechnical Drug,School of Pharmaceutical Science,Shandong University,Jinan 250012,China)
Purpose To investigate the expression of Tα1-TP5 fusion peptide and optimization of the expression conditions.Methods The chemically synthesized Tα1-TP5 gene was fused with prokaryotic expression vector pGEX-4T-1 and transformed into E.coli BL21(DE3),subsequently induced by IPTG.SDS-PAGE electrophoresis and Alpha Ease gel electrophoresis image analysis system were used to analyze the influence of culture medium,induction starting time,induction temperature,inducer concentration and induction time on the expression level of target protein.GST fusion protein was purified by GST sepharose and cut by recombinant enterokinase.Tα1-TP5 was identified by ESI-MS.Results When using TB as the medium and adding final concentration of 0.05 mmol/L of IPTG into the middle and late logarithmic phase of bacteria to induce for 5 h at 37 ℃,the expression of GST fusion protein was the highest,accounting for 35.8%of the bacterial total protein,and mainly in a soluble form.Identified by ESI-MS,the molecular weight of Tα1-TP5 was identical with theoretical value.Conclusion Tα1-TP5 has been successfully expressed in E.coli and the expression conditions of the GST fusion protein were optimized.
Tα1-TP5;fusion peptide;GST fusion protein;E.coli;expression conditions.
Q78
A
1005-1678(2011)04-0265-04
2011-03-28
谢 琦,女,讲师,研究方向:多肽的合成与活性研究,Tel:0773-2295135,E-mail:xq@glmc.edu.cn; 王凤山,男,通信作者,教授,博士生导师,E-mail:fswang@sdu.edu.cn。
