表面活性剂作为黄原胶发酵促进剂的应用研究
2011-01-06王桂兰张晓元陈晓燕朱希强凌沛学
王桂兰,张晓元,陈晓燕,朱希强,凌沛学
(1.山东大学 药学院,山东 济南 250012;2.山东省生物药物研究院博士后科研工作站,山东 济南 250101)
表面活性剂作为黄原胶发酵促进剂的应用研究
王桂兰1,2,张晓元2,陈晓燕2,朱希强1,2,凌沛学1,2
(1.山东大学 药学院,山东 济南 250012;2.山东省生物药物研究院博士后科研工作站,山东 济南 250101)
目的 通过加入表面活性剂,提高黄原胶发酵产量。方法 初步筛选6种常用的表面活性剂,优选两种优势互补的表面活性剂进行加入量、加入时间、加入比例的优化,采用单因素和正交试验得到最佳工艺参数。结果吐温20、曲拉通X-100协同使用效果最好,发酵0 h加入0.06%曲拉通X-100,48 h加入0.09%吐温20,黄原胶产量提高42.0%。结论 表面活性剂能提高黄原胶发酵产量。
黄原胶;发酵;表面活性剂
黄原胶(xanthan gum),是由甘蓝黑腐病黄单胞菌或野油菜黄单胞菌,以糖类为主要原料,经有氧发酵产生的一种胞外多糖。因其独特的增稠性、触变性和稳定性而广泛应用于食品、医药、化妆品、陶瓷、石油等多种行业。黄原胶是目前世界上生产规模最大的微生物多糖[1],产量为每年10万吨左右,发酵水平达到50 g/L[2]。我国对黄原胶的开发研究始于20世纪60年代,目前的生产水平与国外相比还有较大差距。国内黄原胶主要存在菌种改良、发酵工艺和后处理工艺优化等三个方面的问题[3]。
表面活性剂作为工业“味精”,在发酵工业中主要应用于消泡稳泡、发酵生产纯粹培养时的消毒洗涤以及生物下游产品的分离等[4]。表面活性剂能提高很多发酵产品的产量[4-6],但其在黄原胶发酵中的应用研究则很少。
为了研究表面活性剂对黄原胶发酵的影响,我们在摇瓶发酵的条件下,选用6种常用的表面活性剂,采用单因素法和正交试验设计等方法,先后优化了多个因素,为表面活性剂作为黄原胶发酵促进剂的应用提供数据支持。
1 材料
野油菜黄单胞菌(Xanthomonas campestris pv.campestris 58,Xcc58),本实验室保存。
3-(3-胆胺丙基)二甲氨基-1-丙磺酸(CHAPS)、吐温80(Tween-80)、吐温 20(Tween-20)、司班 20(Span-20)、OP乳化剂、曲拉通X-100(Triton X-100)均为市售化学纯。
WFZ UV-2100型紫外可见分光光度计,尤尼柯(上海)仪器有限公司;日立CR20B2高速冷冻离心机。
种子培养基:蔗糖2%,蛋白胨0.3%,酵母粉0.1%,牛肉膏0.5%,pH 值为7.0;固体培养基加入1.5%琼脂。
发酵培养基:淀粉6%,豆饼粉0.3%,酵母粉0.05%,硫酸镁 0.25%,碳酸钙 0.3%,硫酸亚铁0.001%,pH 值为 7.0。
2 方法
2.1 细菌含量测定
2.1.1 血细胞计数板法 发酵液用水稀释适当倍数,使用血细胞计数板,显微镜下计数,换算成原始发酵液中菌体密度。
2.1.2 紫外吸收法 参照文献[7]中菌体处理方法,将发酵液适当稀释,10 000 r/min离心15 min,去上清。沉淀加入0.01 mol/L盐酸50 mL,分解剩余的碳酸钙,5 000 r/min离心10 min后加入水重悬菌体,600 nm波长处测定吸光度(A)值。
2.2 黄原胶含量测定
采用有机溶剂(乙醇)沉淀法[7]。
2.3 表面活性剂溶液配制
将 Tween-80、Tween-20、OP 乳化剂、Triton X-100均配制成体积分数为10%的水溶液待用,将CHAPS、Span-20均配制成质量分数为6%的水溶液待用。
2.4 微生物的培养
菌液平板划线培养48 h后,挑取单菌落接入种子培养基培养20 h,按5%的接种量接入发酵培养基,250 mL装液量60 mL,250 r/min,30 ℃培养72 h。
3 结果
3.1 菌株基本生长特性
按照2.4 项下方法,在发酵 0,12,24,36,48,60,72 h取样,分别用血细胞计数板法和有机溶剂沉淀法,测定细菌密度和黄原胶产量。菌株生长特性和产胶特性测定结果见图1。
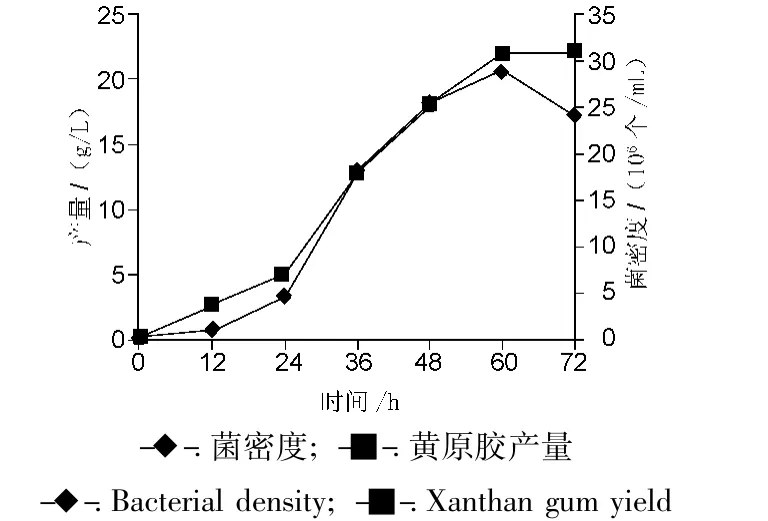
图1 菌密度和产胶量变化曲线Fig.1 The variation plot of bacterial density and xanthan gum yield
0~24 h,新接入的菌株生长缓慢,产胶较少,24~48 h之间,菌株进入对数生长期,生长较快,同时产胶率也大幅增加,48 h以后,菌株生长减缓,但产胶速率仍较大。60 h后,菌株进入衰亡期,含量降低,黄原胶产量增长缓慢。未加表面活性剂前,黄原胶产量约为22 g/L。
3.2 表面活性剂加入量对黄原胶发酵的影响
选用 CHAPS、Tween-80、Tween-20、Span-20、OP乳化剂和Triton X-100等6种常用的非离子表面活性剂。发酵起始分别加入0.01%,0.05%,0.1%,0.2%,0.3%等5个浓度梯度进行实验,以未加入表面活性剂的为对照组。结果见图2~3。
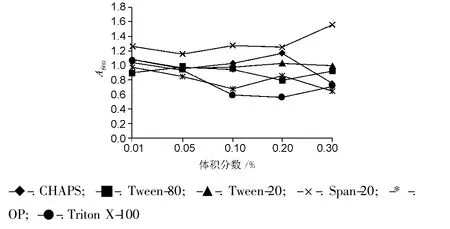
图2 表面活性剂对菌密度的影响Fig.2 Effect of diffierent surfactants on bacterial density
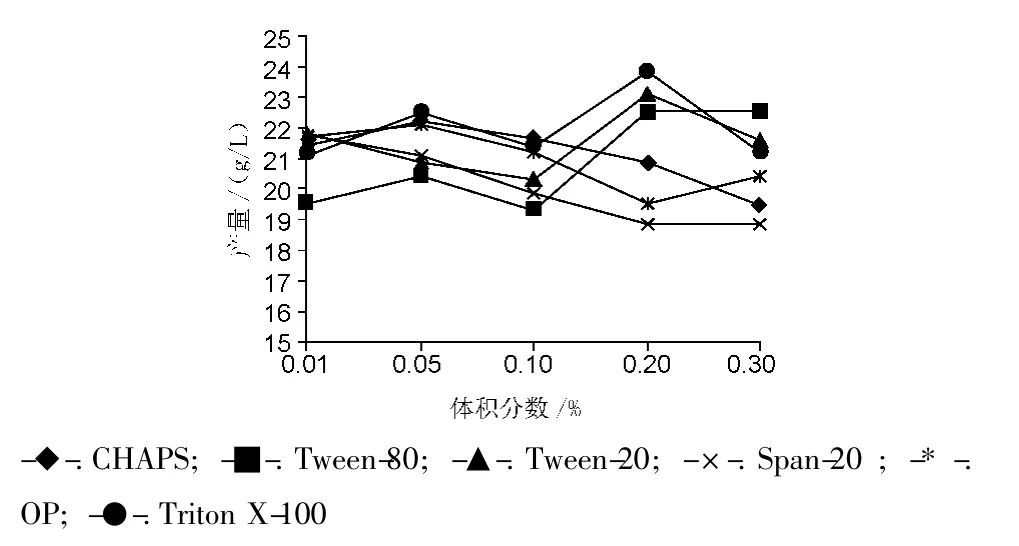
图3 表面活性剂对产胶量的影响Fig.3 Effect of different surfactants on xanthan gum yield
对照组中菌体A600为1.328,从图2可知,加入不同浓度表面活性剂后,发酵液中菌密度总体呈下降趋势。不同表面活性剂对菌体毒性大小不一,Span-20影响最小,Triton X-100影响最大。
加入CHAPS、Span-20、OP乳化剂后,产胶量随着浓度的增大呈降低趋势,但大都高于对照组黄原胶产量(20.15 g/L)。而加入 Tween-80、Tween-20、Triton X-100后,产胶量呈上升趋势,在0.2%的加入浓度时,加入Tween-20、Triton X-100的发酵液,产胶量都达到23 g/L以上,比对照组分别提高了14.6%和18.2%。因此优选 Tween-20、Triton X-100这2两种表面活性剂进行进一步优化。
3.3 表面活性剂加入时间对黄原胶发酵的影响
为了进一步探明表面活性剂的作用机制,得到更高的黄原胶产量,分别对这两种表面活性剂的加入时间进行优化,在发酵 0,12,24,36,48 h 分别加入 Tween-20、Triton X-100,终浓度为 0.2%,以未加入表面活性剂的为对照组。结果见图4~5。
如图4所示,Triton X-100对菌体的毒性强于Tween-20,但对于同一种表面活性剂,不同时间点加入,对菌密度影响并不明显。而从图5可见,加入Triton X-100后的产胶量明显偏高,在0 h加入,产量达到23.18 g/L,与对照组的产胶量(19.40 g/L)相比,提高了19.5%。但实验中发现加入Triton X-100的发酵液会产生大量泡沫,不利于大规模工业化生产。与Triton X-100相比,Tween-20是一种较温和的表面活性剂,在36 h加入,产胶量达到了22.79 g/L,比对照组的产胶量提高了17.5%,略低于加入Triton X-100的发酵液。综上所述,Tween-20、Triton X-100这两种表面活性剂各有利弊,可以考虑共同使用,发挥协同效果。

图4 表面活性剂不同加入时间对菌密度的影响Fig.4 Effect of different addition time of surfactants on bacterial density
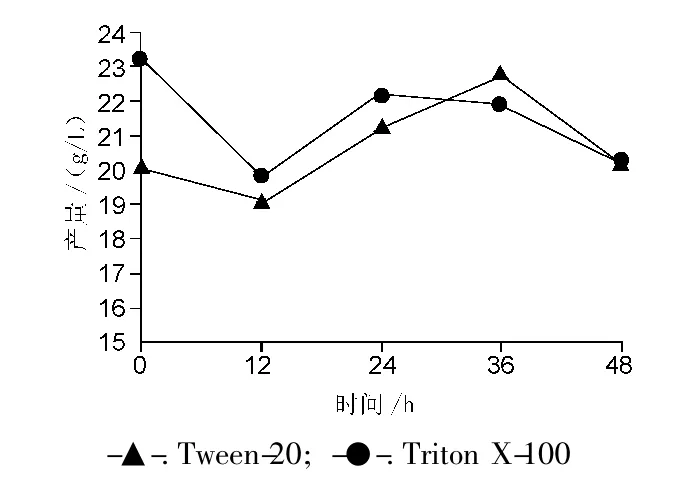
图5 表面活性剂不同加入时间对产胶量的影响Fig.5 Effect of different addition time of surfactants on xanthan gum yield
3.4 Tween-20和Triton X-100浓度比对黄原胶发酵的影响
为了使Tween-20、Triton X-100达到较好的协同效果,将其分别在发酵0,36 h按照不同浓度比一起加入发酵液,以单独加入Tween-20、Triton X-100的为对照组。结果见图6。
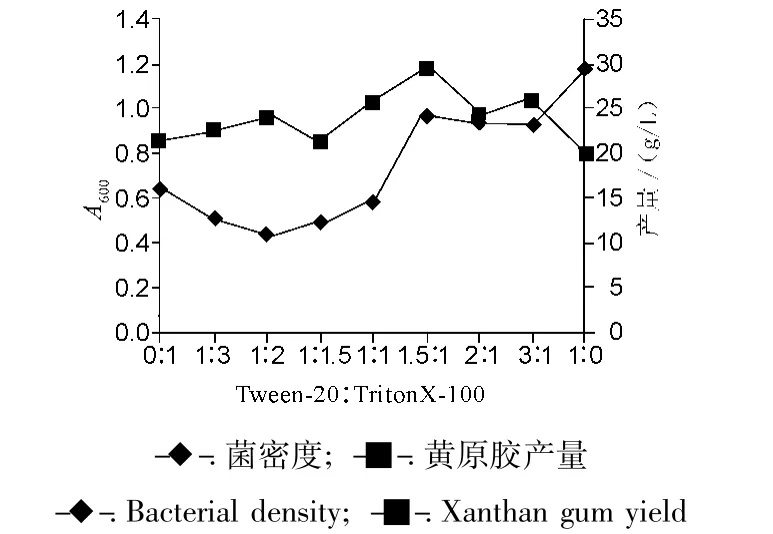
图6 不同浓度比对菌密度和产胶量的影响Fig.6 Effect of different addition ratio on bacterial density and xanthan gum yield
结果表明,由于Triton X-100毒性较大,随着其加入比例的降低,菌密度呈明显上升趋势,产胶量曲线则呈现先升高后降低的趋势。在Tween-20、Triton X-100 浓度比为1.5∶1 时,达到最大值29.28 g/L,比单独加入Tween-20和Triton X-100的产胶量分别提高了37.7%和47.3%。可见Tween-20和 Triton X-100确实存在良好的协同效果。
3.5 正交试验确定表面活性剂最佳添加量和添加时间
为进一步验证Tween-20与Triton X-100的协同效果,得到表面活性剂的最佳加入量和加入时间,选用L9(34)正交表进行正交试验。正交试验因素水平表如表1所示,实验结果见表2。

表1 正交试验因素水平Tab.1 Factors and levels of the orthogonal test

表2 正交试验方案与结果分析Tab.2 Scheme and result of the orthogonal test
由表2极差R可知,4个因素对实验结果影响大小顺序为B>C>A>D。正交试验得到的最优组合为A2B1C1D3。即两种表面活性剂的最优添加工艺为,发酵0 h加入0.06%Triton X-100,48 h加入0.09%Tween-20。
验证上述正交试验所得最优工艺,按照最优工艺参数进行新一批发酵,设未加入表面活性剂的对照组。实验得到加入表面活性剂的产胶量达到30.22 g/L,比对照组的产胶量(21.28 g/L)提高了42.0%。
4 讨论
传统理论认为[2,8],表面活性剂可以抑制细胞膜脂肪酸的合成,从而改变细胞膜的组成成分及其通透性,使发酵产物更容易渗透出来,从而提高发酵的产率。近几年,有人提出一种新型的调控酮戊二酸脱氢酶活性的作用机理[2,9],认为表面活性剂影响了发酵体系中蛋白激酶等关键酶的含量。
从本研究结果可以看出,表面活性剂对菌体生长的确有一定作用,加入表面活性剂的发酵液中菌体密度降低,但是当表面活性剂浓度超过0.1%时,菌体含量降低不明显,可能因为表面活性剂与细胞膜作用基本呈饱和状态。
表面活性剂可以作为黄原胶发酵促进剂,在一定程度上提高黄原胶产量。但由于菌种发酵能力等条件限制,产胶量仍未达到理想水平。黄原胶生产的发展方向必定是通过基因改造、诱变等手段努力提高菌种发酵能力,在此基础上不断研究新型发酵添加剂,优化发酵条件,进一步提高黄原胶产量。
[1]刘清泉.黄原胶产业的现状及发展趋势[J].中国食品添加剂,2002(6):5-7.
[2]陈 超,王君高,周喜燕,等.黄原胶发酵条件优化研究[J].中国酿造,2009(4):121-123.
[3]杜风光,陈伟红,闫德冉,等.我国黄原胶生产的现状、存在的问题及对策[J].食品科学,2001,22(10):97-99.
[4]卫云路,郑 成,宁正祥.表面活性剂作为发酵促进剂的国内外研究进展[J].化工进展,2008,27(7):880-885.
[5]Beom SK,Hak-Ryul K,Ching T H.Effect of surfactant on the production of oxygenated unsaturated fatty acids by Bacillus megaterium ALA2[J].New Biotechnol,2010,27(1):33-37.
[6]Radmacher E,Stansen K C,Besra G S,et al.Ethambutol,a cell wall inhibitor of Mycobacterium tuberculosis,elicits L-glutamate efflux of Corynebacterium glutamicum[J].Microbiol,2005,151(5):1359-1368.
[7]Psomas SK,Liakopoulou-Kyriakides M,Kyriakidis D A.Optimization study of xanthan gum production using response surface methodology[J].Biochem Eng J,2007,35(3):273-280.
[8]Huchenq A,Marquat M,Weiby M,et al.Glutamate excretion triggering mechanism:A reinvestigation of the surfactant-induced modification of cell lipids[J].Ann Microbiol(inst Pasteur),1984,135B(1):53-67.
[9]Niebisch A,Kabus A,Schults C,et al.Corynebacterial protein kinase G controls 2-oxoglutarate dehydrogenase activity via phosphorylation status of the OdhIprotein[J].Biol Chem,2006,281(18):12300-12307.
Study on application of surfactants as the xanthan gum fermentation promoter
WANG Gui-lan1,2,ZHANG Xiao-yuan2,CHEN Xiao-yan2,ZHU Xi-qiang1,2,LING Pei-xue1,2
(1.School of Pharmaceutical Science,Shandong University,Jinan 250012,China;2.Postdoctoral Scientific Research Workstation,Institute of Biopharmaceuticals of Shandong Province,Jinan 250101,China)
Purpose To improve the fermentation yield of xanthan gum by adding surfactants.Methods Six surfactants were tested as accelerants,and two were chosen to optimize the addition dosage,addition time and addition ratio respectively.Monofactorial experiments and orthogonal test were investigated to find out the combined effect of the two kinds of surfactants.Results Tween-20 and Triton X-100 were the best,and by adding 0.06%Triton X-100 in the beginning of fermentation,adding 0.09%Tween-20 at 48 h in the fermentation period,the yield of xanthan gum could be improved 42.0%.Conclusion Surfactants can promote xanthan gum production.
xanthan gum;fermentation;surfactants
RQ464.1
A
1005-1678(2011)06-0429-04
2010-07-20
国家“十一五”科技支撑计划(编号2008BAI63B08)
王桂兰,女,硕士研究生,微生物与生化药学专业;凌沛学,男,通信作者,研究员,博士生导师,Tel:0531-81213003,E-mail:peixue.ling@bausch.com。
