膜技术在酶法生产L-色氨酸中去除蛋白质和色素的应用研究
2011-01-06韦平和彭加平周锡樑
韦平和,彭加平,周锡樑
(常州工程职业技术学院 江苏省应用酶工程技术研究开发中心,江苏 常州 213164)
膜技术在酶法生产L-色氨酸中去除蛋白质和色素的应用研究
韦平和,彭加平,周锡樑
(常州工程职业技术学院 江苏省应用酶工程技术研究开发中心,江苏 常州 213164)
目的 用超滤-纳滤膜分离法去除L-色氨酸酶法转化液中的蛋白质和色素。方法 L-色氨酸转化液经适当处理后,输入超滤膜和纳滤膜设备,分别收集输出的清液和浓液,然后检测其透光率并用加入碱或乙醇方式,检查转化液中蛋白质、色素的去除效果。结果 在转化液pH调节至5.5~6.0、温度控制在20~25℃的膜分离工艺条件下,经超滤-纳滤输出的清液,加入碱或乙醇无蛋白质析出,透光率达85%以上,比使用活性炭脱色处理的滤液高2.7倍。结论 膜分离法去除转化液中蛋白质和色素的效果明显优于传统的絮凝剂沉淀蛋白质和活性炭脱除色素,从而为酶法生产L-色氨酸提供了一条绿色、先进的纯化工艺。
膜分离;L-色氨酸;超滤;纳滤;蛋白质;色素
目前,L-色氨酸的生产方法主要是发酵法和酶法,发酵法是以葡萄糖、甘蔗糖蜜等廉价原料为碳源,利用谷氨酸棒杆菌、枯草杆菌等L-色氨酸产生菌,经微生物细胞内的复杂代谢而生成L-色氨酸;酶法主要是利用色氨酸酶,经酶促反应将底物L-丝氨酸(L-半胱氨酸或丙酮酸)和吲哚合成 L-色氨酸[1]。酶法以其终产物积累量高、反应周期短以及与环境友好等优点而为人们所重视,Terasawa等[2]以高表达的E.coli色氨酸酶催化L-丝氨酸和吲哚合成L-色氨酸;韦平和等[3-4]采用自主构建的色氨酸酶基因工程菌WW-4,分别催化L-丝氨酸和吲哚、L-半胱氨酸和吲哚合成 L-色氨酸;庞敏等[5]用 E.coli色氨酸酶催化DL-丝氨酸和吲哚合成L-色氨酸;李鑫等[6]以色氨酸酶和丝氨酸羟甲基转移酶双酶催化甘氨酸、甲醛和吲哚合成L-色氨酸。但是,上述酶法合成途径形成的L-色氨酸转化液,与发酵法形成的发酵液一样,同样含有菌体、蛋白质和色素等杂质,影响L-色氨酸的提取和纯化,有效去除这些杂质,则是提高L-色氨酸回收率和产品质量的关键。
发酵液或转化液中菌体、蛋白质和色素等杂质的去除方法主要有离心、絮凝、活性炭脱色和膜分离等方法,其中膜分离法是将膜技术应用于物料分离、浓缩、提纯的一项新技术,具有在常温下进行、无相态变化、节能和环保等特点,近年来已在各个工业领域及科学研究中广泛应用。本文以酶法合成的并经陶瓷膜去除菌体的L-色氨酸转化液为对象,研究了采用超滤膜、纳滤膜分离技术去除L-色氨酸转化液中蛋白质和色素的工艺条件,试图为酶法生产L-色氨酸提供一条绿色、先进的纯化工艺。
1 材料
L-色氨酸转化液:以本室构建的色氨酸酶基因工程菌WW-4,按文献[4]将底物L-半胱氨酸和吲哚经酶促反应制备获得。
L-半胱氨酸购自上海康达氨基酸厂;吲哚购自上海润捷化学试剂有限公司;乙醇、氢氧化钠为分析纯;硫酸镁及其它试剂均为国产化学纯。
UV-7502PCS紫外可见分光光度计(上海精密仪器仪表有限公司);PHS-3B型精密酸度计(上海雷磁仪器厂);SenLong 30 L双层玻璃反应釜(北京世纪森朗实验仪器有限公司)。
陶瓷膜(国产0.2~80μm滤管)设备、超滤膜(国产UF-16011W2膜)设备、纳滤膜(美国海德能ESNA1-LF膜)设备,均为浙江湖州富优得膜分离科技有限公司产品。
2 方法
2.1 转化液预处理
取L-色氨酸转化液20 L,输入陶瓷膜设备,去除菌体,分别收集清液和浓液,浓液再加入适量纯水洗涤,继续收集清液至原转化液体积。
2.2 絮凝与超滤去除转化液中的蛋白质
2.2.1 絮凝 将经预处理的转化液升温至70℃,调整 pH 8.5 ~9.0,加入 0.4% 硫酸镁作絮凝剂,沉淀去除蛋白质,过滤后检测滤液的透光率及检查蛋白质去除效果。
2.2.2 超滤 将经预处理的转化液调整pH 4.2~6.5,在压力0.18 ~0.24 mPa下输入超滤膜设备超滤,分别收集输出的清液和浓液,然后检测清液和浓液的透光率,检查蛋白质去除效果。
2.3 二次絮凝并活性炭与超滤-纳滤去除转化液中的色素和蛋白质
2.3.1 二次絮凝并活性炭 将经预处理的滤液升温至75 ~80 ℃,调整 pH 4.5 ~5.0,加入0.2%硫酸镁和1%活性炭,沉淀去除蛋白质和脱除色素,过滤后检测滤液的透光率,检查色素脱除及蛋白质去除效果。
2.3.2 超滤-纳滤 将2.2.2项下的清液在压力0.6~1.0 mPa下输入纳滤膜设备,分别收集清液和浓液,然后检测其透光率,检查色素脱除和蛋白质去除效果。
2.4 透光率的测定
取待检液约20 mL,调节温度20℃后,取适量置10 mm比色杯,于460 nm波长处测量相对于水的透光率。
2.5 蛋白质的检查
2.5.1 方法1 取待检液约25 mL,调节温度20℃后,滴入4 mol/L氢氧化钠溶液,调整 pH 9.0~10.0,振摇3 min,静置10 min,观察是否产生白色絮状物。
2.5.2 方法2 取待检液约25 mL,调节温度20℃后,加入无水乙醇3 mL,振摇3 min,静置10 min,观察是否产生白色絮状物。
3 结果
3.1 超滤去除转化液中蛋白质的效果
结果见表1~2。超滤膜法去除L-色氨酸转化液中蛋白质的效果远远优于絮凝法。转化液经超滤膜分离后的清液检查蛋白质,只出现微量的絮状物;而絮凝法处理后的滤后转化液,仍能检出大量蛋白质存在。
3.2 超滤-纳滤去除转化液中色素及蛋白质的效果
结果见表3~4。L-色氨酸转化液经超滤再进行纳滤膜分离后的清液透光率可达85%以上,比使用活性炭脱色处理后的滤液高约2.7倍,说明纳滤膜分离法比活性炭脱色法对转化液中的色素脱除更为有效。超滤-纳滤膜分离后的清液,未检出蛋白质絮状物,而用絮凝法虽经二次加入硫酸镁沉淀蛋白质,仍检查出有蛋白质的白色絮状物。
3.3 转化液pH对超滤-纳滤去除蛋白质和膜通量的影响
L-色氨酸转化液pH对膜分离过程去除蛋白质的效果有一定影响,在放大实验时发现转化液在pH 5.0以下的蛋白质去除效果不如在pH 5.0以上的。在pH 5.0以下的膜分离清液中,加入乙醇可略见白色絮状物,透光率也明显偏低,而pH 5.0以上的膜分离清液中无白色絮状物出现,透光率可达85%以上,结果如图1。

表1 硫酸镁去除转化液中蛋白质的效果Tab.1 The efficiency of removing proteins from the conversion solution with magnesium sulfate

表2 超滤去除转化液中蛋白质的效果Tab.2 The efficiency of removing proteins from the conversion solution with UF

表3 硫酸镁并活性炭去除转化液中色素及蛋白质的效果Tab.3 The efficiency of removing pigments and proteins from the conversion solution with magnesium sulfate and activated carbon

表4 超滤-纳滤去除转化液中色素及蛋白质的效果Tab.4 The efficiency of removing pigments and proteins from the conversion solution with UF combined with NF

图1 不同pH转化液对经超滤-纳滤后清液透光率的影响Fig.1 Effect of different pH values of conversion solution on transmittance of the clear filtrate after UF-NF membrane filtration
由图1可知,转化液pH对蛋白质的去除效果在pH 6.5为好,但在放大实验时又发现pH 6.5的转化液在膜分离过程中膜通量下降较快。选择pH 5.2,5.7和6.5三种不同 pH 值的L-色氨酸转化液,分别检测其在膜分离过程中膜通量的变化,结果见图2。pH 5.2的转化液在滤过时对选用的ESNA1-LF膜的Zeta电位无太大改变,因此对膜通量影响不大,而pH 6.5的转化液有可能改变了膜的Zeta电位,使膜通量受影响。因此,采用超滤-纳滤膜法去除L-色氨酸转化液中的蛋白质,综合考虑多方面的影响,转化液的pH值应调至5.5~6.0较为合适。

图2 三种pH转化液对纳滤过程中膜通量的影响Fig.2 Effect of three kinds of pH value of conversion solution on permeate flux in the NF process
3.4 转化液温度在膜分离过程中对膜通量的影响
转化液温度在膜分离过程中对膜通量的影响较大,放大实验时直接应用经陶瓷膜去除菌体的L-色氨酸转化液进行超滤和纳滤,开始温度约30℃,膜通量90 L/(m2·h),1 h后温度升至45℃,膜通量仅40 L/(m2·h)。为考察合适的温度,本研究比较了在10,20,25,30,35 和 40 ℃ 条件下分离 pH 5.8转化液100 L的膜通量变化,结果见图3。在20℃以下膜通量没有什么变化,35℃以上膜通量在30 min后迅速下降。因此,应用膜法去除L-色氨酸转化液中的蛋白质和色素,转化液的温度控制在20~25℃较为合适。
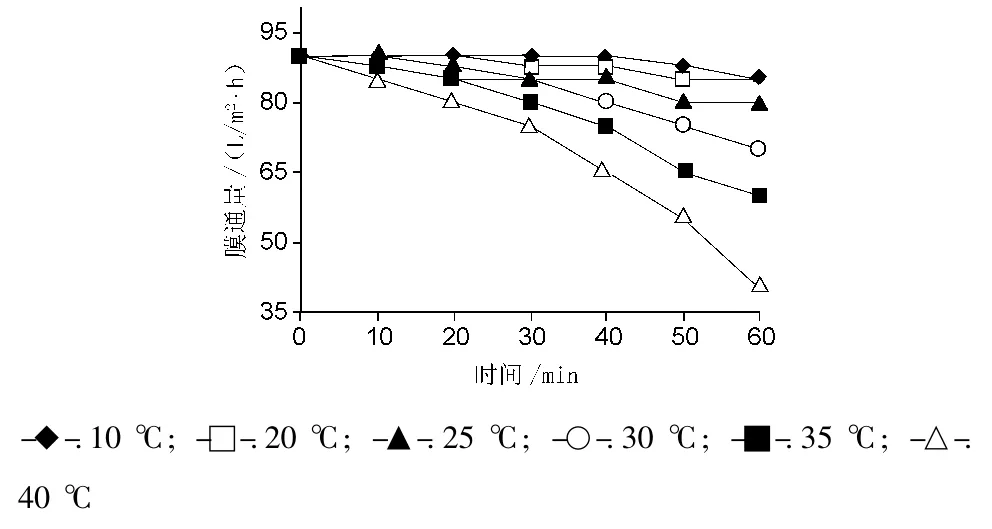
图3 不同温度转化液对纳滤过程中膜通量的影响Fig.3 Effect of different temperatures of conversion solution on permeate flux in the NF process
4 讨论
研究结果表明,膜分离法对L-色氨酸转化液的蛋白质去除效果远远优于絮凝法,究其原因是转化液经相对分子质量(Mr)7 000超滤膜和Mr500纳滤膜分离后,Mr大于500的蛋白质及蛋白质碎片已被截留在浓液中,而絮凝剂是很难将Mr为几百的蛋白质碎片全部凝聚的,活性白土也不可能将全部凝聚的蛋白质吸附,故经絮凝法处理后的滤后转化液仍残留较多的蛋白质。传统的活性炭脱色法并不能把色素全部脱除,经脱色后的滤液透光率只有30%左右,而Mr500的纳滤膜则能将小分子色素截留在浓液中,故经纳滤后的清液透光率能达到85%以上。目前纳滤膜的型号较多,本文未涉及对纳滤膜选型的讨论,但研究结果表明用于L-色氨酸转化液的色素脱除,选用ESNA1-LF纳滤膜是正确的。
L-色氨酸转化液在pH 5.0以下的蛋白质去除效果不如在pH 5.0以上,这可能与转化液中的主要蛋白——色氨酸酶的pI有关。韦平和等[7]报道重组E.coli色氨酸酶合成反应的最适pH为7.0,庞敏等[8]认为 E.coli色氨酸酶在 pH 5.5 ~7.5 范围内较稳定,Suzuki等[9]发现 Symbiobacterium thermophilum耐高温色氨酸酶的pI为4.9,据此推测本文所选用的重组E.coli色氨酸酶,其pI值应该明显高于5.0。在转化液pH为4.2和4.5等明显低于色氨酸酶pI值(5.0以上)时,色氨酸酶蛋白带正电荷而影响其凝聚,从而影响超滤-纳滤去除L-色氨酸转化液中蛋白质碎片的效果。另外,转化液 pH在4.2和4.5等较低情况下,膜的Zeta电位较低,易引起纳滤膜对蛋白质碎片截留率的下降,也在一定程度上影响转化液中蛋白质的去除效果。
转化液温度在20℃以下膜通量没有什么变化,35℃以上膜通量在30 min后迅速下降。这一结果与其它应用膜技术分离氨基酸方面的报道不同[10-11],究其原因,这些研究者处理的是发酵液,菌体没有破碎,游离蛋白质不多,在较高温度下有利于溶液黏度下降和扩散系数增大,所以可提高膜通量。然而,酶法生产L-色氨酸需应用菌体破碎后游离出的色氨酸酶作为催化剂,并将底物转化为L-色氨酸,因此溶液体系有很大差别。酶法合成的转化液在经陶瓷膜去除破碎的菌体后,溶液中仍含有大量的游离蛋白质及其碎片。张立卿等[12]认为膜具有柔韧性,当温度升高时膜膨胀使得膜孔径增大,造成膜吸附增加,而膜孔径增大又易引起膜孔窄化和膜孔堵塞。L-色氨酸转化液中的各种蛋白质特别是色氨酸酶,在较高温度下容易发生变性而形成较大的絮凝物沉淀,这些蛋白絮凝物易吸附于膜孔内,从而导至膜孔堵塞。因此,较高温度时膜孔径增大、膜孔窄化和蛋白质絮凝物被吸附于膜孔内而导致膜孔堵塞,应是膜通量下降的主要原因。
[1]Mateus D M R,Alves SS,Fonseca M M R D.Kinetics of L-tryptophan production from indole and L-serine catalyzed by whole cells with tryptophanase activity[J].JBiosci Bioeng,2004,97(5):289-293.
[2]Terasawa M,Fukushima M,Kurusu Y,et al.L-Tryptophan production by the application of high expressed tryptophanase in Escherichia coli[J].Process Biochem Int,1990,25:172-175.
[3]韦平和,吴梧桐,王 旻,等.色氨酸酶基因工程菌酶法合成L-色氨酸[J].中国现代应用药学杂志,1999,16(6):37-39.
[4]韦平和,吴梧桐.以L-半胱氨酸和吲哚酶法合成L-色氨酸[J].药物生物技术,2000,7(4):197-199.
[5]庞 敏,王海磊,姚建铭,等.以吲哚和DL-丝氨酸为底物固定化酶法合成 L-色氨酸[J].食品与发酵工业,2008,34(10):6-9.
[6]李 鑫,刘 军,赵沁沁,等.共表达SHMT和TPase载体的构建及双酶法合成 L-色氨酸[J].化学工程学报,2010,26(9):1302-1308.
[7]韦平和,吴梧桐,余方兵.色氨酸酶基因工程菌固定化及其培养条件的研究[J].中国生化药物杂志,1999,20(6):271-274.
[8]庞 敏,李朝生,冯瑞彩,等.大肠杆菌色氨酸酶的制备及酶学性质[J].食品科学,2011,32(1):189-192.
[9]Suzuki S,Hirahara T,Horinouchi S,et al.Purification and properties of thermostable tryptophanase from an obligately symbiotic thermophile,Symbiobacterium thermophilum[J].Agric Biol Chem,1991,55(12):3059-3066.
[10]冯志彬,孙玉华,徐庆阳,等.膜分离法提纯L-苏氨酸的研究[J].现代化工,2006,26(增刊2):291-293.
[11]谢希贤,曹华杰,杜 军,等.采用膜分离技术高效分离提取L-亮氨酸[J].食品与发酵工业,2008,34(12):180-182.
[12]张立卿,王 磊,王旭东.纳滤膜物化特征对膜分离及膜污染影响研究[J].水处理技术,2009,35(1):24-29.
Applied research of removing proteins and pigments in enzymatic production of L-tryptophan with membrane separation technology
WEI Ping-he,PENG Jia-ping,ZHOU Xi-liang
(Applied Enzyme Engineering Technology R&D Center of Jiangsu,Changzhou Institute of Engineering Technology,Changzhou 213164,China)
Purpose The ultrafiltration(UF)combined with nanofiltration(NF)membrane separation was used to remove proteins and pigments from enzymatic conversion solution of L-tryptophan.Methods The conversion solution of L-tryptophan with certain treatments was inputed into UF and NF membrane filtration equipments,and then clear filtrate and cloudy filtrate through these equipments were collected respectively.The efficiency of removing proteins and pigments from the conversion solution with membrane separation was examined by determining the transmittance of the filtrate and adding alkali or ethanol into the filtrate.Results The conversion solution was adjusted to pH 5.5-6.0,and feeding temperature was 20-25 ℃.Under these operating conditions,no proteins were precipitated from the clear filtrate by adding alkali or ethanol.The transmittance of the clear filtrate at 460 nm was above 85%which was of 2.7 times as high as that of activated carbon decolorization.Conclusion The efficiency of membrane separation for removing proteins and pigments from the conversion solution was obviously better than traditional flocculation precipitation and activated carbon decolorization used in the experiment.It developed a green and advanced purification process for enzymatic production of L-tryptophan.
membrane separation;L-tryptophan;ultrafiltration;nanofiltration;protein;pigment
TQ464.7
A
1005-1678(2011)06-0421-05
2011-06-10
常州市科技攻关项目(CE20100018);江苏省高校“青蓝工程”资助项目
韦平和,男,博士,副教授,主要从事生物活性物质的发酵制备和酶法合成研究,Tel:0519-86332163,E-mail:phwei@czie.email.net。
