海洋异养细菌对无机氮吸收的研究
2010-12-28王秋璐周燕遐王江涛袁泽轶
王秋璐,周燕遐,王江涛,袁泽轶
(1. 国家海洋信息中心, 天津 300171; 2. 中国海洋大学, 山东 青岛 266100)
海洋异养细菌对无机氮吸收的研究
王秋璐1,周燕遐1,王江涛2,袁泽轶1
(1. 国家海洋信息中心, 天津 300171; 2. 中国海洋大学, 山东 青岛 266100)
着眼于海洋异养细菌对无机氮的吸收研究,在不同的海区和河流中,通过对环境因素的分析和比较,发现不同环境影响因子作用下,异养细菌对无机氮吸收具有选择性,同时也发现,这与异养细菌本身的生理特性也有一定关系。
海洋异养细菌,无机氮,选择性吸收
传统观点认为,浮游植物吸收营养盐进行光合作用生成有机物[2]。海水中的溶解有机物含量丰富,占总有机物的90%以上,海洋细菌利用溶解有机物转化成自身的生物量迅速地生长繁殖,或者将有机物矿化分解成无机物,进行再循环生产[21]。细菌无疑是很重要的分解者,它们具有分解有机物的各种酶,吸收藻类分解过程中产生的溶解有机物,并通过代谢释放无机物;后来随着人们对海洋生产力进一步研究发现,其实际值往往与先前估计的值相背离,这时人们开始怀疑除了浮游植物是营养盐的主要吸收者外,还存在另外的吸收者,它就是异养细菌。之后很多研究也证明,异养细菌不仅分解有机物释放营养盐,同时也吸收利用营养盐。在营养盐含量很低的大洋水域(初级生产力和细菌数量较低),细菌可吸收的溶解有机物很少,这时就可能与浮游植物竞争利用营养盐。Eppley等人 (1977)[3]也发现在南太平洋中部无机氮的吸收速率与14CO2固定速率相比要高,这种偏差主要是由于异养细菌对氮盐的吸收造成。
由此,人们开始注意到海洋中除浮游植物外的另一部分粒径<1 µm的微微型浮游生物,其中包括了自养型蓝细菌,原绿球藻和异养细菌。在开阔的大洋中,它们的数量甚至超过了浮游植物的总和,并且认为它们对初级生产力的贡献占到了50%左右[16]。80年代中后期,大量研究工作集中到了异养细菌对无机氮吸收研究上。但是由于当时的技术条件限制,人们还无法真正把异养细菌和微微型的自养生物分离开,单独对其吸收动力学进行研究。所以观点上出现了明显的分歧:一部份研究结果表明在海洋环境中< 1 µm的浮游生物对氨氮的吸收是非常少的 (< 20%)[5,4,22]。而另外的一些研究表明< 1 µm的浮游生物对氨氮(N-NH4)的吸收占到了总吸收的50%以上[23]。但当时对硝氮 (N-NO3) 的吸收却得到了共识,认为异养细菌对硝氮的吸收可以忽略。
随着研究的进一步加深,技术方法的改进,15N同位素添加培养方法和粒径分离方法的引入。人们可以采用实验室培养方法,先通过粒径分离技术,将粒径< 1 µm的浮游生物(主要是异养细菌)分离出来,然后添加含有15N同位素的氮源(N-NO3,N-NH4,溶解自由氨基酸 (DFAA),尿素等)进行培养,比较异养细菌对各种营养物的吸收情况[6,24,11,14]。然而这种方法仍然存在问题,主要是因为微微型的浮游植物与细菌在粒径大小上有重叠,从而无法真正的将其分离。后来Wheeler & Kirchman (1986)[25]使用了抗生素(主要是放线酮和氯霉素)抑制蛋白质的合成,研究发现几乎所有的氨基酸都被原核生物所利用,真核生物和原核生物都对氨盐有吸收,其中78%的氨盐是被原核生物吸收的,而这其中的一大部分又是被异养细菌利用。所以抗生素的使用成为对异养细菌活力进行估计的有效方法。一般认为,基质中DFAA含量高低与异养细菌对N-NH4吸收或排出有关:细菌首先利用氨基酸,当DFAA浓度较高时,会抑制细菌吸收N-NH4的酶;且只有满足其本身生物利用之后才开始分解氨基酸产生N-NH4。而当DFAA浓度较低时,利用N-NH4有关的酶不被抑制,异养细菌就会吸收 N-NH4。Wayne等人研究发现异养细菌偏爱的氮源主要是 DFAA和N-NH4,对N-NO3和尿素的吸收相对较少[26],然而不同的海区,不同的季节,结果往往又有不同[20]。有一些研究已经证明异养细菌对N-NO3的吸收比例也是相当高的[8,19]。可以认为,有关异养细菌对氮源利用尚须进一步研究,特别是有关异养细菌群落生活的基质组分和细菌的营养生理学的研究最为重要。
随着国外众多学者和研究人员对异养细菌无机氮吸收研究的关注,异养细菌不再单一的扮演矿化分解者,它参加到了整个氮循环过程中而直接影响了氮的源和汇[11,12],尤其是异养细菌对N-NO3的吸收直接影响了对新生产力的估算[13],使我们对以往方法:利用碳氮比例,并已知碳的吸收量来计算氮的吸收速率产生质疑,结果往往会低估了氮源的吸收。此外,研究还表明,异养细菌对氮源吸收还会影响海水中溶解有机碳的利用、溶解有机碳与颗粒有机碳之间垂直输送,但是它们之间的内在机制至今还不是很清楚。
1 不同海区和河流中异养细菌对无机氮的吸收
针对不同海区中氮源的吸收研究,90年代前期的大量工作聚焦在异养细菌如何利用有机和无机氮问题上。研究表明,某一海区的生产力高,溶解有机氮(DON,主要指DFAA)含量丰富时,异养细菌主要作为分解者利用有机物,并将其矿化分解成无机物。而当所研究的海区是贫营养海区或者处于异养状态时,DFAA的含量不能满足异养细菌对N源的需要时,异养细菌会更偏爱的吸收N-NH4,有时也会选择溶解的结合态氨基酸 (DCAA),而N-NO3则被认为是最不喜欢的N源。80年代后期,观点出现了分歧:Horrigan[8]等人发现了异养细菌对N-NO3的吸收,这一发现也被后来Kirchman (1991)[28]等人研究证明:N-NH4,N-NO3和尿素都被< 0.8 µm的异养细菌所吸收,然而在kirchman (1992)[10]另外的研究中却发现:异养细菌偏爱的无机氮源是N-NH4而不是N-NO3,这与先前Wheeler & Kirchman (1986)研究相符:细菌吸收的N-NH4占到其总无机氮吸收50%以上。除此以外,在南极水域的研究同样发现,细菌对N-NH4的吸收非常重要尤其是在春季的水华时期[29]。但是为什么会选择吸收N-NH4,而不是其他形态的无机氮源 (N-NO3,N-NO2),至今没有明确的说法。在各个海区包括大洋和河口区域各个形态的无机氮含量和分布不同的情况下是否会有相同的结果成为了人们关注的焦点,由此研究不断进行。
1.1 河流,河口区异养细菌对无机氮的吸收
河口区是典型的异养环境,异养呼吸大于初级生产。在这一区域内,异养细菌对无机氮吸收成为了非常重要的一部分,但吸收比例应环境而不同。Hoch & Kirchman (1995)[7]的研究认为通常在河口区上游,当DFAA相对含量较高时,异养细菌对N-NH4吸收是相当低的(平均占到总N-NH4吸收的5% ~ 10%),然而在河口区下游和沿岸附近或DFAA含量较低的大洋水中,对N-NH4的吸收是较高的。例如,在Delaware河流域,1988年的调查显示细菌对N-NH4吸收在河口的下游是最高的 (10% ~ 25%),然而在盐度< 20‰的内河N-NH4吸收才不到5%。同样的1990年,细菌对N-NH4的吸收在沿岸附近和河流入海口处平均占到了 15% ~ 35%,尤其是在夏季当 DFAA的浓度很低时,细菌所利用的氮源 50%是由 N-NH4支持的[7]。Wheeler&Kirchman(1986)[25]在Georgia和Gulf海湾的研究中发现DFAA的吸收达到58%以上, N-NH4吸收达25%以上,而其他形式的氮源几乎可以忽略。Middelburg&Nieuwenhuize对法国的Loire河口进行了研究表明:在夜间细菌对N-NH4的吸收占到了90%以上。在最近的几十年中,由于人为的污水排放,河流和河口区域的硝酸盐浓度急剧上升。有研究已经表明:高浓度的硝酸盐含量很有可能引起了细菌对其吸收,尽管这也许并不是细菌偏爱的氮源。例如,在Hudson河口区连续做了几个月的培养实验,微生物对N-NO3的吸收是非常大量的。在英国的Thames河口区研究发现,冬季无机氮的吸收主要发生在河口区的上游,其中在内河流域N-NO3成为了主要的被吸收成分,这与该流域f值(f=新生产力/总生产力)相一致,高达06 ~ 0.9[18]。所以对不同的河流区域内无机氮吸收研究是非常有意义的。通过人们已经对世界的许多河流和河口区进行的调查比较分析可以看出:在西欧的河流区域中 (Thames,Hudson) 异养细菌显示了对N-NO3的吸收一定程度的偏爱;然而在北美的河流中 (Delaware,Chesapeake) 异养细菌更加偏爱N-NH4。所以一般的认为当研究的区域内流入的有机质有较高的C : N比例,较高的细菌周转速率,以及周围环境中硝酸盐的浓度较高时,异养细菌更多的选择了N-NO3的吸收。所以对于氮源的吸收偏爱,后来人们喜欢用RPI值表示:[17]

其中:RPIx代表了异养细菌对某种氮源的偏爱指数,Ux表示这种氮源的吸收速率,X表示这种氮源的浓度。当把各个氮源浓度固定在同一水平时,异养细菌对氮源的偏爱次序为氨基酸>氨氮,硝氮和尿素是几乎可以被忽略的[25]。然而当使用RPI值来估计氮源优先选择时一定要谨慎,原因可能是这一比值只是一个简单的数理计算过程很难用于解释异养细菌生理上的选择关系,尤其是在对N-NH4,DFAA吸收时与细菌群落生理特性有密切的关系。
1.2 大洋水中异养细菌对无机氮的吸收
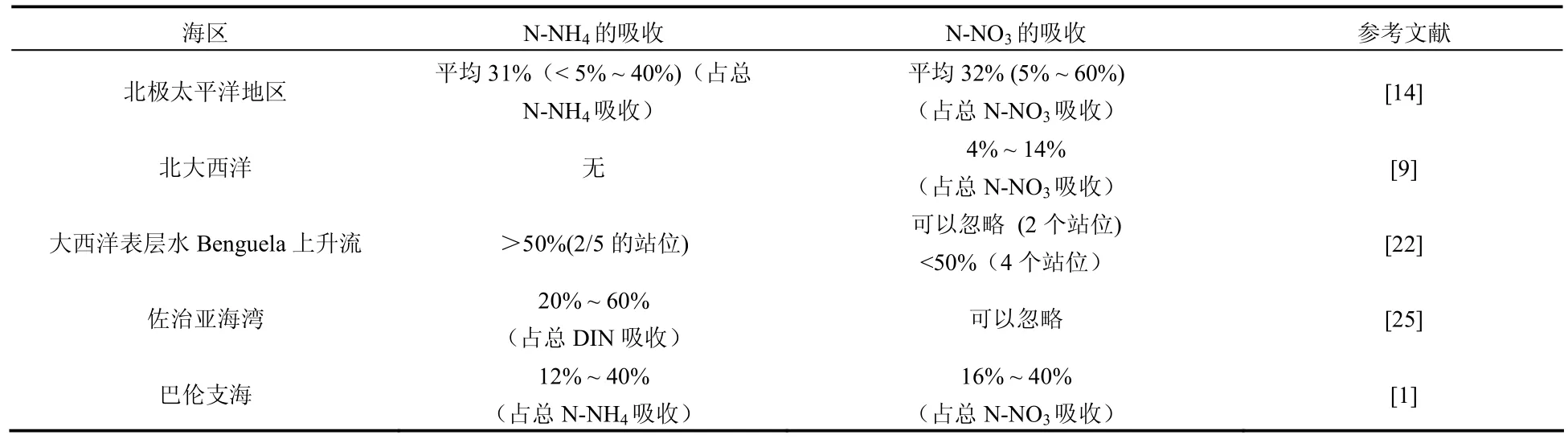
表1 世界主要海区中异养细菌对无机氮的吸收研究Tab.1 Research of the assimilation of inorganic nitrogen by marine heterobacteria in global sea areas
从上表可以看出,在世界各大洋海区异养细菌对N-NH4和N-NO3的吸收比例也是不同的,Kirchman(1998)[14]指出,虽然异养细菌对N-NH4和N-NO3的利用比例几乎相当,但在所选的站位同时测定两者的吸收速率时发现,异养细菌对N-NO3吸收大于N-NH4的吸收。细菌对N-NH4的吸收速率与细菌的生物量及DFAA的周转速率之间有很好的相关性,但对N-NO3吸收却几乎不与任何生物参数有关系。Kirchman(1994)[9]发现在北大西洋春季水华时,异养细菌利用的N-NO3占到总吸收N-NO3的4 ~ 14%,但始终低于在北极太平洋地区异养细菌对N-NO3利用的保守估计。研究发现这主要受到了碳源和能量的限制[15],细菌同化吸收 N-NO3被认为是很奢侈的行为[10],所以藻类和细菌往往更偏爱选择吸收需要能量较低的N-NH4。然而,在北极太平洋地区出现的相反结果,主要是由该海区的特点决定的,水温低,硝酸盐的含量高,叶绿素浓度低,硝酸盐支持了细菌的生长。但可惜的是作者只给出了异养细菌对 N-NH4和 N-NO3的吸收占到各自总吸收的比例,并没有给出细菌利用的DIN中N-NH4和N-NO3的比例。Allen等人 (2002)[1]对Barents海(位于欧洲北岸)进行了研究发现,从巴伦支海到北极结冰区边缘 (MIZ),细菌对总DIN的吸收比例显著增加10% ~ 40%,异养细菌对N-NH4和N-NO3的利用分别占各自总吸收的12% ~ 40%,16%~ 40%,其中调查的15个站位中12个站位N-NO3这一比例高于N-NH4, 但是从作者分析的不同营养盐吸收与总 DIN吸收的关系中,我们却发现,虽然异养细菌对 N-NO3的吸收占总 N-NO3吸收的比例高于N-NH4,但异养细菌对N-NO3的吸收占细菌总DIN吸收的比例在15个站位中只有4个是高于N-NH4的,并且主要位于临近MIZ区的中层和底层。所以说,在研究异养细菌对DIN的吸收问题时,我们可以从两个方向进行,一个是异养细菌与浮游植物之间对DIN的吸收比例;另一个是异养细菌所利用的DIN中不同氮源的吸收比例,从而可以更加全面的理解这一问题。
2 结 语
异养细菌对无机氮的吸收问题受到越来越多研究者的关注,世界范围内的不同海区和河流的调查研究正在进行。目前我国的近海研究主要还是集中在藻类等浮游植物对营养盐的吸收上,对异养细菌的关注还很少。因此这一方向将会有广阔的发展前途,对我国的近海调查研究起到非常重要的作用。
[1] Allen A E, Howard-Jones M H, Booth M G, et al. Importance of heterotrophic bacterial assimilation of ammonium and nitrate in the Barents Sea during summer [J]. Journal of Marine Systems, 2002, 38: 93– 108.
[2] Dugdale R C, Goering J J. Uptake of new and regenerated forms of nitrogen in primary productivity [J]. Limnol Oceanogr, 1967, 12: 196-206.
[3] Eppley R W, Sharp J H, Renger E H, et al. Nitrogen assimilation by phytoplankton and other microorganisms in the surface waters of the central North Pacific ocean [J]. Mar. Biol,1977, 39: 111-120.
[4] Glibert P M. Regional studies of daily, seasonal and size fraction variability in ammonium remineralization [J]. Mar Biol,1982, 70: 209-222.
[5] Harrison W G. Experimental measurements of nitrogen remineralization in coastal waters [J]. Limnol Oceanogr, 1978, 23: 684-694.
[6] Harrison W G, Laura J E. Inorganic nitrogen uptake by marine picoplankton: Evidence for size partitioning [J]. Limnol Oceanogr,1988, 33(3):468-475.
[7] Hoch M P, Kirchman D L. Ammonium uptake by heterotrophic bacteria in the Delaware estuary and adjacent coastal waters [J]. Limnol Oceanogr,1995, 40(5): 886-897.
[8] Horrigan S G, HagstrÖm A, Koike I, et al. Inorganic nitrogen utilization by assemblages of marine bacteria in seawater culture [J]. Mar Ecol Prog Ser, 1988, 50: 147–150.
[9] Kirchman D L, Ducklow H W, MacCathy J J, et al. Biomass and nitrogen uptake by heterotrophic bacteria during the spring phytoplankton bloom in the North Atlantic Ocean [J]. Deep-Sea Res.-Part I, 1994, 41 (5/6): 879–895.
[10] Kirchman D L, Moss J, Keil R G. NO3 uptake by heterotrophic bacteria: does it change the f-ratio?[J]. Arch Hydrobiol, 1992, 37: 129–138.
[11] Kirchman D L. The uptake of inorganic nutrients by heterotrophic bacteria [J]. Microb Ecol, 1994, 28: 255-271.
[12] Kirchman D L. Incorporation of thymadine and leucine in the subarctic Pacific: application to estimating bacterial production [J]. Mar Ecol Prog Ser,1992, 82: 301-309.
[13] Kirchman D L. Uptake and regeneration of inorganic nutrients by marine heterotrophic bacteria in Wiley, New York [J]. Microbial Ecology of the Oceans, 2000: 261-288.
[14] Kirchman D L, Wheeler P A. Uptake of ammonium and nitrate by heterotrophic bacteria and phytoplankton in the sub-Arctic Pacific [J]. Deep-Sea Res, 1998, 45: 347-365.
[15] Kirchman D L, Richard G. K. Carbon limitation of ammonium uptake by heterotrophic bacteria in the subarctic Pacific [J]. Limnol Oceanogr, 1990,35(6): 1258-1266.
[16] Luis Tupas, Isao Koike. Amino acid and ammonium utilization by heterotrophic marine bacteria grown in enriched seawater [J]. Limnol Oceanogr,1990, 35(5): 1145-l 155.
[17] McCarthy J J, Taylor W R, Taft J L. Nitrogenous nutrition of the plankton in the Chesapeake Bay. I. Nutrient availability and phytoplankton preferences [J]. Limnology and Oceanography, 1977, 22: 996-1011.
[18] Middelburg J J, Nieuwenhuize J. Nitrogen uptake by heterotrophic bacteria and phytoplankton in the nitrate-rich Thames estuary [J]. Mar Ecol Prog Ser, 2000, 203: 13-21.
[19] Parker R R, Sibert J, Brown T J. Inhibition of primary productivity through heterotrophic competition for nitrate in a stratified estuary [J]. Fish Res Board Can, 1975, 32: 72– 77.
[20] Wheeler P A, Kirchman D L, Landry M R, et al. Diel periodicity in ammonium uptake and regeneration in the oceanic subarctic Pacific:Implications for interactions in microbial food webs [J]. Limnol Oceanogr, 1989, 34(6): 1025-1033.
[21] Pomeroy L R. The ocean’s food web, a changing paradigm [J]. Bio Science, 1974, 24: 499-504.
[22] Probyn T A. Nitrogen uptake by size-fractionated phytoplankton populations in the southem Benguela upwelling system [J]. Mar Ecol Prog Ser,1985, 22: 249-258.
[23] Probyn T A, Painting S J. Nitrogen uptake by size-fractionated phytoplankton populations in Antarctic surface waters [J]. Limnol Oceanogr, 1985,30: 1327-1332.
[24] Probyn T A. Size-fractionated measurements of nitrogen uptake in aged upwelled waters: implications for pelagic food webs [J]. Limnol Oceanogr,1990, 35: 202-210.
[25] Wheeler P A, Kirchman D L. Utilization of inorganic and organic nitrogen by bacteria in marine systems [J]. Limnol Oceanogr, 1986, 31(5):998-1009.
[26] Gardner W S, Chandler J F, Laird A G. Organic nitrogen mineralization and substrate limitation of bacteria in Lake Michigan [J]. Limnol Oceanogr,1989, 34(2): 478-485.
[27] Kirchman D L, Suzuki Y, Garside G, et al. High turnover rates of dissolved organic carbon during a spring phytoplankton bloom [J]. Nature, 1991,352: 612-614.
[28] Tupas L M, Koike I, Karl D M, et al. Nitrogen metabolism by heterotrophic bacteria assemblages in Antarctic coastal waters [J]. Polar Biol, 1994,14: 195-204.
Research of the assimilation of inorganic nitrogen by marine heterobacteria
WANG Qiu-lu1,ZHOU Yan-xia1,WANG Jiang-tao2,YUAN Ze-yi1
(1. National Marine Data and Information Center, Tianjin 300171, China; 2. Ocean University of China, Qingdao 266100, China)
The problem of the uptake of inorganic nitrogen by heterobacteria is discussed. The selectivity of DIN uptake by heterobacteria is discovered by the comparison of different sea-zone and estuaries. At the same time, the factors are pointed out.
marine heterobacteria; inorganic nitrogen(DIN); selectively assimilate
Q935
A
1001-6932(2010)02-0231-05
2009-08-20;
2009-09-17
王秋璐 (1982-),女,硕士,助理工程师。主要从事海洋生态化学数据处理方面研究。电子邮箱:shelleyqing@hotmail.com
