氯气灭活饮用水中隐孢子虫的影响因素
2010-12-26冉治霖李绍峰黄君礼崔崇威袁一星哈尔滨工业大学市政环境工程学院黑龙江哈尔滨50090深圳职业技术学院建筑与环境工程系广东深圳58055
冉治霖,李绍峰,黄君礼,崔崇威,袁一星 (.哈尔滨工业大学市政环境工程学院,黑龙江 哈尔滨 50090;2.深圳职业技术学院建筑与环境工程系,广东 深圳 58055)
氯气灭活饮用水中隐孢子虫的影响因素
冉治霖1,李绍峰2*,黄君礼1,崔崇威1,袁一星1(1.哈尔滨工业大学市政环境工程学院,黑龙江 哈尔滨 150090;2.深圳职业技术学院建筑与环境工程系,广东 深圳 518055)
应用荧光活体染色法研究 Cl2在水体中杀灭隐孢子虫的效果,并探讨投加量、作用时间、浑浊度、pH值、温度、有机物含量等对Cl2灭活隐孢子虫效果的影响规律,找出最佳投加量和作用时间.结果显示,隐孢子虫浓度1×106个/mL,温度22℃,pH7.0,浊度为1.0NTU,氯气投加量大于6.3mg/L,反应时间360min,隐孢子虫的灭活率可以达到预期灭活效果(灭活率>99.0%).隐孢子虫的灭活率与氯气投加量和作用时间成正相关;灭活率随着浑浊度增加逐渐下降,浑浊度0.1~20.0NTU范围内,氯气投加量为6.3mg/L,作用时间大于900min,即可保证隐孢子虫的灭活率符合预定要求;在弱酸性条件下氯气灭活隐孢子虫能力强于碱性条件,反应温度(5.0~35.0℃)范围内,隐孢子虫的灭活率与温度成正相关;HA浓度0~10.0mg/L,作用时间为360min时,灭活率随有机物浓度增加而降低.当作用时间为900min时,水中隐孢子虫的灭活率均大于99.0%.
氯气;灭活;隐孢子虫;影响因素
隐孢子虫(Cryptosporidium)是一种常见的肠道原虫病原体,具有广泛的脊椎动物宿主,包括哺乳动物、啮齿动物、鸟类、爬行动物和鱼类等[1].受感染的宿主可排放出大量卵囊污染废水、地表水和地下水[2-3].如果水处理不充分,饮用水中的隐孢子虫就会对人类造成严重威胁,特别是免疫功能缺陷者如婴儿,老人以及艾滋病患者等,被感染后会引起腹泻,甚至危及生命[4].近年来水源性隐孢子虫病不断爆发,水中隐孢子虫的污染及其消毒问题备受关注[5-6].据美国疾病控制预防中心估计,每年约有250万人感染隐孢子虫病[7].而我国于1987年在南京首次发现了人隐孢子虫病病例,之后在江苏、重庆、安徽、内蒙、福建、山东和湖南都有相关病例报道[8].
现有研究去除隐孢子虫的水处理工艺和技术有光催化[9]、紫外[10]、臭氧[11]等.本文使用自制Cl2对饮用水中隐孢子虫进行灭活,探讨投加浓度、灭活时间、温度、pH值、浊度、有机物等因素的影响,以期获取影响 Cl2灭活水中隐孢子虫效果的最佳条件.
1 材料与方法
1.1 材料
Cl2由启普发生器制取,多参数水质分析仪(Merck NOVE 60)测定氯浓度.隐孢子虫(Cryptosporidium)采于患病猴,经过筛、硫酸锌漂浮和蔗糖梯度离心等步骤,得到浓度为 1.0×107个/mL隐孢子虫样品.以2.5%重铬酸钾悬浮保存于4℃冰箱.
试剂:4,6-二脒基-2-苯基-吲哚(DAPI, Sigma),普匹碘胺(PI,Sigma USA),HBSS平衡盐溶液(Sigma USA).
1.2 荧光活体染色
取 0.5mL PBS(磷酸缓冲溶液)保存样品,加入1mL HBSS平衡盐溶液漂洗 2次;沉淀于 160μL HBSS平衡盐溶液中,加入20μL DAPI, 20μL PI储备液,37℃温浴1h;温浴后加入1mL HBSS 清洗3次,洗去未染上颜色的DAPI和PI;涂片,荧光显微镜下镜检,各样品分别取200个孢囊镜检.
1.3 实验方法
启普发生器产生的 Cl2通入一棕色瓶,内装有1L 0.01mol/L的磷酸钠缓冲液,调节pH值.使用德国Merck公司生产的 NOVE 60多参数水质分析仪测定氯浓度.取若干支 10mL比色管分别加入稀释后不同浓度的 Cl2缓冲溶液,迅速加入1×106个/mL 隐孢子虫悬浮液,摇床转速为100r/min,避光反应.首先,检测不同作用时间对隐孢子虫的灭活效果,同时检测反应体系中 Cl2的剩余浓度,找出最佳 Cl2投加量和作用时间.接着探讨在最佳灭活条件下不同浑浊度、温度、pH值、有机物浓度等对灭活效果的影响.
2 结果与讨论
2.1 隐孢子虫活性评价
本实验采用荧光活体染色法评价隐孢子虫活性,图 1为同一视野中隐孢子虫经过PI染色,在自然光和绿光下的照片.由图 1a可见,自然光下隐孢子虫周围有淡绿色光环.绿光照射(图 1b)隐孢子虫发出耀眼红光为PI+型,PI-型不发光.其中PI+型为已死的隐孢子虫.
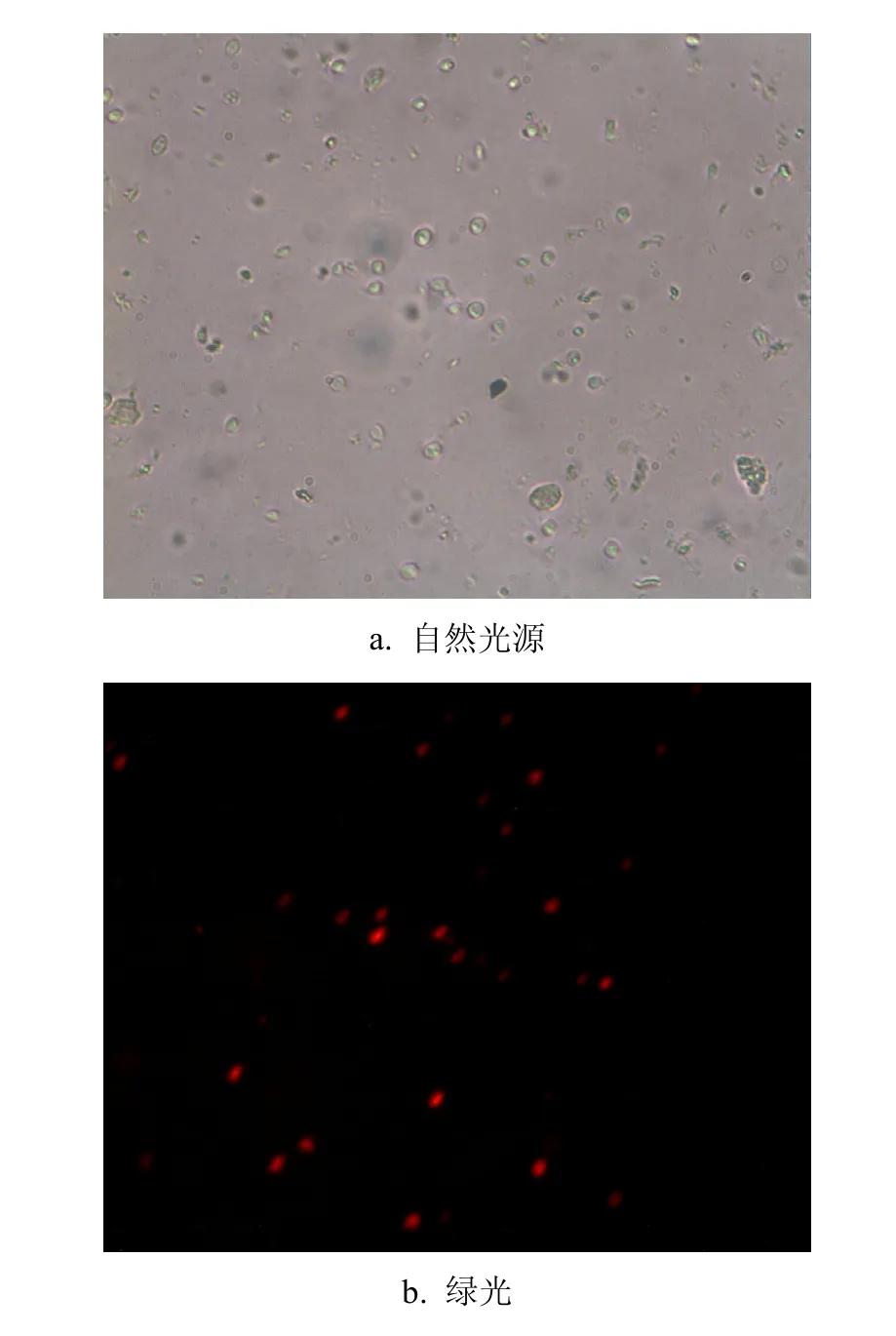
图1 荧光活体染色图片Fig.1 Photo of Cryptosporidium detected by fluorescence staining method
2.2 Cl2投加量和作用时间对灭活率的影响
取10mL比色管,分别加入初始浓度为10.1, 8.2,6.3,3.1,1.5,0.6mg/L的氯气溶液,加入 1×106个 /mL隐孢子虫悬浮液,温度20℃, pH7.0,浊度为1.0NTU,避光反应.由图 2可见,随着反应时间的增加,隐孢子虫的存活率降低,特别是当氯气投量大于6.3mg/L,反应360min(水中余氯小于3mg/L,符合国家生活饮用水卫生标准对出水余氯的要求),隐孢子虫的存活率小于1%,可以达到预期灭活效果(灭活率>99.0%).如果氯气投加量为3.1mg/L,作用时间必须大于 900min,方可达到灭活效果.
氯气加入水中可转变为盐酸和次氯酸.其反应式如下:
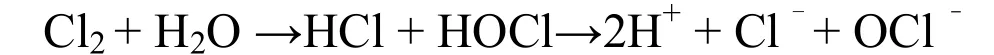
反应生成的次氯酸体积小,具有很强的穿透力,呈电中性,能扩散到带负电的细菌表面,并迅速穿过微生物的细胞膜进入生物体内,破坏其多种酶系统(主要是磷酸葡萄糖去氢酶的巯基被氧化破坏)及染色体系统[12],使之失去活力而死亡.另一方面次氯酸性质很不稳定,容易释放出新生态氧.新生态氧与铵盐、硫化氢、氧化亚铁、亚硝酸盐及有机物腐败后产生的物质相结合,进而氧化水中的有机物和一些无机物质,从而抑制了依靠这些物质为营养的大部分微生物的生长.
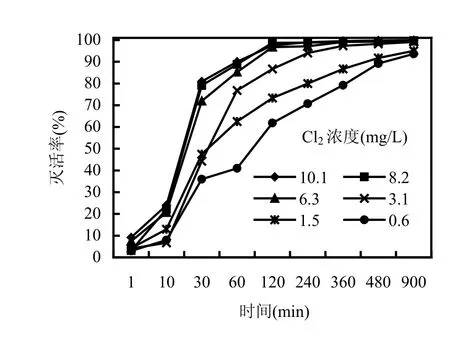
图2 Cl2投加量和作用时间对隐孢子虫活性的影响Fig.2 Viability of Cryptosporidium effected by different concentrations of Cl2 and contact time
2.3 浊度对灭活率的影响
由于天然水中含有各种悬浮物及胶体物质,影响了水体的浊度,而Falabi等[13]研究表明,贾第鞭毛虫的去除与浊度有显著关系,本研究在pH7.0,氯气投加量为 6.3mg/L,作用时间分别为360,480,900min,设置反应体系的浑浊度为 0.1, 0.5,1.0,2.0,5.0,10.0,20.0 NTU,检测隐孢子虫灭活率,结果见图 3.由图 3可见,氯气作用时间为360min时,随着浑浊度的增加(0.1~20.0NTU),隐孢子虫的灭活率下降(99.5%下降至 86.5%),饮用水的浊度越低,氯气灭活水中隐孢子虫卵囊越容易.随着作用时间的增加(480,900min),水中隐孢子虫的灭活率逐渐增高,尤其是作用时间大于900min,浑浊度0.1~20.0NTU范围内,灭活率均大于 99%.原因可能是水中的悬浮物或胶体物质对隐孢子虫有一定的吸附作用,阻碍了氯气消毒效果,从而影响了灭活率,另一方面,隐孢子虫暴露时间的增加本身就有一定数量的虫体裂解,从而提高了系统总的灭活率[14].出水厂浊度要求1.0NTU以下,因此实际生产中,氯气投加量为6.3mg/L,作用时间大于 900min,即可保证隐孢子虫的灭活.
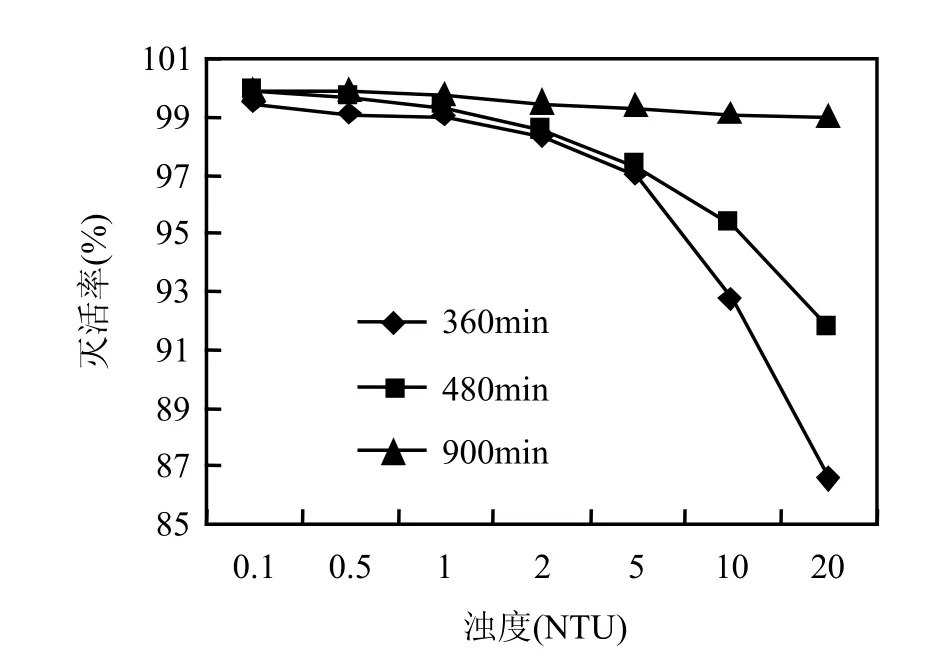
图3 浊度对隐孢子虫灭活效果的影响Fig.3 Effect of different turbidities on the inactivation ratio of Cryptosporidium
2.4 pH值对灭活率的影响

图4 不同pH值下隐孢子虫灭活率的比较Fig.4 Comparison the inactivation ratio of Cryptosporidium under different pH values
饮用水的pH值范围在6~9,设置较高或较低的 pH 值实际应用价值较小[15],因此选取PH6,7,7.5,8,9进行实验.氯气投加量为6.3mg/L,作用时间360,480min,浑浊度为1.0 NTU时,不同pH值的反应体系,氯气对隐孢子虫的灭活作用变化不大(97.3%~99.9%),酸性条件略好于碱性条件(图4).作用时间大于480min后,pH值在6~9范围内,隐孢子虫灭活率均大于99%,达到预定灭活要求.
酸性条件略好于碱性条件的原因主要是:氯气溶于水后,部分与水反应,生成次氯酸和盐酸.次氯酸是弱电解质,在水中会电离成次氯酸根和氢离子,在水中起主要消毒杀菌作用的是次氯酸,而次氯酸根的杀菌能力远远低于次氯酸.因此,在弱酸性条件下,氯气的杀灭隐孢子虫能力较强,而在碱性条件下,由于大多数的次氯酸电离成次氯酸根而使其灭活能力大大降低.
2.5 温度对灭活率的影响
在pH7.0,浊度为1.0NTU,氯气的投加浓度为6.3mg/L,作用时间 360,480min时,分别设置反应温度为 5,15,22,30,35℃,检测隐孢子虫的存活率,结果见图5.由图5可见,作用时间为360min时,反应温度(5.0~35.0℃)范围内,隐孢子虫的灭活率与温度呈正相关,灭活率从 95.4%上升为 99.8%,当时间增加为480min后,隐孢子虫灭活率均大于99%,达到预定的灭活要求.其原因可能是较低的温度促使隐孢子虫进入休眠状态,消毒剂不易灭活隐孢子虫,较高的温度对隐孢子虫具有一定的灭活作用,从而提高了灭活率.
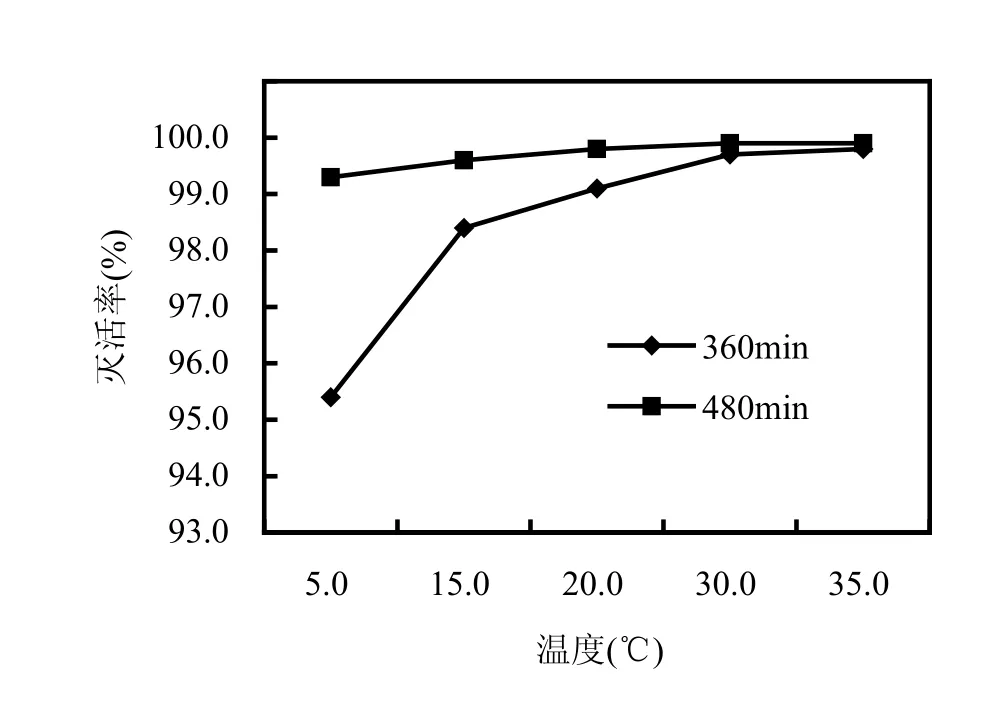
图5 不同温度下隐孢子虫灭活率的比较Fig.5 Comparison the inactivation ratio of Cryptosporidium under different temperatures
2.6 有机物对灭活率的影响
腐殖酸(HA)在自然水体中含量较高,是动植物残体经过复杂的物理,化学,生物等过程转化而成的一种广泛存在于水体,土壤中的高分子聚合物,为饮用水中主要的去除对象.本实验以HA为有机物代表成分,分别设置HA浓度为0,0.5,1.0, 2.0,3.0,5.0,10.0mg/L,氯气投加量6.3mg/L,作用时间分别为360,480,900min,考察其对Cl2灭活隐孢子虫的影响(图6).

图6 不同浓度HA对隐孢子虫灭活效果的影响Fig.6 Effect of different HA concentrations on the inactivation of Cryptosporidium
由图6可见,HA浓度0~10.0mg/L,作用时间为 360min时,隐孢子虫的灭活率分别为99.1%,98.0%,95.2%, 86.7%, 75.7%,66.9%,62.1%.灭活率与有机物浓度呈负相关.这主要由于可溶性有机物的存在消耗了一定量的 Cl2,从而降低了Cl2的消毒效果.当作用时间为900min时,水中隐孢子虫的灭活率均大于99.0%.
3 结论
3.1 隐孢子虫1×106个/mL,温度22℃,pH7.0,浊度为 1.0NTU,氯气投加量大于 6.3mg/L,反应360min,隐孢子虫的灭活率>99.0%.隐孢子虫的灭活率与氯气投量和作用时间成正相关.
3.2 氯气投加量为 6.3mg/L,氯气的作用时间为360min时,随着浑浊度的增加(0.1~20.0NTU),隐孢子虫的灭活率下降(由99.5%下降至86.5%),浑浊度 0.1~20.0NTU 范围内,氯气投加量为6.3mg/L,作用时间大于 900min,即可保证隐孢子虫的灭活.
3.3 在弱酸性条件下隐孢子虫的灭活率略好于碱性条件下,反应温度(5.0~35.0℃)范围内,隐孢子虫的灭活率与温度成正相关,随着HA浓度的升高,灭活率降低.
3.4 当氯气投加量为 6.3mg/L,作用时间为900min,在饮用水消毒的浑浊度、温度、pH值、有机杂质浓度范围内,隐孢子虫的灭活率均在99.0%以上.
[1] Smith H V, Nichols R. Cryptosporidium: Detection in water and food [J]. Expermental Parasitology, 2009,123(4):1-19.
[2] Reinoso R, Becares E, Smith H V. Effect of various environmental factors on the viability of Cryptosporidium parvum oocysts [J]. Journal of Applied Microbiology, 2008,104:980-986.
[3] Lobo M L, Xiao L, Antunes F, et al. Occurrence of Cryptosporidium and Giardia genotypes and subtypes in raw and treated water in Portugal [J]. Letterin Applied Microbiology, 2009,48:732-737.
[4] Xiao L, Feng Y. Zoonotic Cryptosp-oridiosis [J]. FEMS Immunol. Med. Microbiol., 2008,52:309-323.
[5] Montemayor M, Galofre B, Ribas F, et al. Comparative study between two laser scanning cytometers and epifluorescence microscopy for the detection of Cryptosporidium oocysts in water [J]. Cytometry Part A, 2007,71(3):163-169.
[6] Kevin R, Janes, Petr M. Neural network models of Cryptosporidium parvum inactivation by chlorine dioxide and ozone [J]. Environmental Engineering and Science, 2007,6(5): 477-482.
[7] Furness B W, Beach M J, Roberts J M. Giardiasis surveillance -United States, 1992–1997 [J]. Morbidity and Mortality Weekly Report CDC Surveillance Summary, 2000,49:1-13.
[8] 金云霄,张立成,傅金祥.介水隐孢子虫病的防治措施与方法 [J].给水排水, 2005,31(4):42-45.
[9] Hodon R, Daniel G, John C C. Photocatalytic inactivation of Cryptosporidium parvum with TiO2and low-pressure ultraviolet irradiation [J]. Water Research, 2008,42:1523-1530.
[10] King B J, Hoefel D, Daminato D P. Solar UV reduces Cryptosporidium parvum oocyst infectivity in environmental waters [J]. Journal of Applied Microbiology, 2008, 104:1311-1323.
[11] Kima J H, Michael S E, Guntenc U. Modeling Cryptosporidium parvum oocyst inactivation and bromate in a flow-through ozone contactor treating natural water [J]. Water Research, 2007,41: 467-475.
[12] 穆效群,马 铃,谭壮生,等.氯化消毒对中水遗传毒性的影响[J]. 毒理学杂志, 2008,22(2):137-140.
[13] Falabi J A, Gerba C P, Karpiscak M M. Giardia and Cryptosporidium removal from waste-water by a duckweed (Lemna gibbal) covered pond [J]. Letters in Applied Microbiology, 2002,34(5):384-387.
[14] Fernando M H, Elvira A M, Kevin G M, et al. Disinfection of drinking water contaminated with Cryptosporidium parvum oocysts under natural sunlight and using the photocatalyst TiO2[J]. Journal of Photochemistry and Photobiology B: Biology, 2007,88:105-111.
[15] Sun X B, Cui F Y, Zhang J X. Inactivation of Chironomid larvae with chlorine dioxide [J]. Journal of Hazardous Materials, 2007, 142: 348-353.
Effect of various factors on chlorine inactivating Cryptosporidium in water.
RAN Zhi-lin1, LI Shao-feng2*, HUANG Jun-li1, CUI Chong-wei1, YUAN Yi-xing1(1.School of Municipal and Environmental Engineering, Harbin Institute of Technology, Harbin 150090, China;2.Department of Building and Environmental Engineering, Shenzhen Polytechnic Institute, Shenzhen 518055, China). China Environmental Science, 2010,30(6):786~790
In order to study the effect of Cl2inactivating Cryptosporidium in water, different factors as Cl2concentration, contact time, pH, temperature, turbidity and organic content which might influence the inactivation were studied by using fluorescence staining method. With the Cryptosporidium concentration was 1×106/mL, turbidity 1.0NTU, temperature 22℃, pH 7.0, and after 360 min reaction, under the condition that the Cl2concentrations was 6.3mg/L, the inactivation ratio could be more than 99%. The lower turbidity was, the higher inactivating ratio could be
. If the inactivating time achieved 900min, it could meet the presetting inactivation ratio with turbidity 0.1~20.0 NTU. The ability of Cl2inactivating Cryptosporidium was stronger under acidic condition than that in alkali circumstance. With the increasing temperature, the inactivating effect was increased. When the reaction system contained different concentration of organics(0~10.0 mg/L) and the inactivating time 360min, the inactivation ratio reduced with concentration increasing. Besides, when the inactivating time achieved 900min, the inactivation ratio could achieve 99%.
Cl2;inactivating;Cryptosporidium;effect factors
2009-10-29
国家“863”项目(2006AAZ309)
* 责任作者, 教授, solve28@163.com
X505
A
1000-6923(2010)06-0786-05
冉治霖(1980-),男,河南郑州人,哈尔滨工业大学市政环境工程学院博士研究生,主要从事水污染控制及污水资源化技术.发表论文8篇.
