白头鹎肝脏和肌肉冬夏两季的代谢产热特征比较
2010-12-25郑蔚虹方媛媛姜雪华张国凯柳劲松
郑蔚虹,方媛媛,姜雪华,张国凯,柳劲松
(温州大学 生命与环境科学学院,浙江 温州 325035)
白头鹎肝脏和肌肉冬夏两季的代谢产热特征比较
郑蔚虹,方媛媛,姜雪华,张国凯,柳劲松*
(温州大学 生命与环境科学学院,浙江 温州 325035)
动物能量代谢的生理生态特征与物种的分布和丰富度密切相关,基础代谢率(basal metabolic rate,BMR)是恒温动物维持正常生理机能的最小产热速率,是内温动物能量预算的重要组成部分。该文以白头鹎(Pycnonotus sinensis)为研究对象,分别在冬季和夏季测定了白头鹎的体重、BMR、肝脏和肌肉的线粒体蛋白质含量、线粒体呼吸及细胞色素C氧化酶(cytochrome c oxidase,COX)活力及血清中甲状腺素(T4)及三碘甲腺原氨酸(T3)含量的变化,从细胞和酶学水平上解释白头鹎基础产热的季节适应规律。耗氧量采用封闭式流体压力呼吸测定仪测定,肝脏和肌肉的线粒体状态4呼吸及COX活力采用铂氧电极−溶氧仪测定。结果显示:白头鹎的体重和BMR冬季显著高于夏季;肝脏和肌肉的线粒体呼吸,以及肝脏和肌肉的COX活力冬季明显高于夏季;血清T3浓度冬季较高,夏季较低。这些结果表明:在野外自然条件下,肝脏和肌肉在细胞水平产热能力的提高和血清T3含量的增加是白头鹎BMR增加的细胞学机制之一,同时是白头鹎抵御冬季寒冷的一种重要方式。
白头鹎;肝脏;肌肉;产热特征
由于环境条件的变化和生理需求的改变,鸟类在其生存过程中常常出现可预见性的季节性变化(Swanson & Garland, 2009; Zheng et al, 2008a)。环境条件包括温度的波动、光周期、食物的可利用率及营养组成的变化;体内的改变可能是由于繁殖、冷驯化(cold acclimation)或季节性驯化(seasonal acclimatization)所引起的能量需求增加(Starck & Rahmaan, 2003)。在众多变化条件中,气候条件的变化在鸟类生活史对策(life-history traits)的进化上起着非常重要的作用,是推动鸟类表型变化的源动力之一(Starck & Beese, 2001)。表型可塑性(phenotypic plasticity)是有机体在不同环境中呈现不同表型,表现不同特征和特性的能力,是生物对环境的一种适应。其表型的改变包括行为、生理、形态及生活史对策等等(Guglielmo & Williams, 2003; McKechnie et al, 2006)。对表型可塑性的研究已经成为进化生态学的主题之一,阐明推动代谢率进化的选择压力有助于了解鸟类在形态学、生理学、行为学和生活史对策上的进化(Starck & Rahmaan, 2003; McKechnie et al, 2006; Lindsay et al, 2009a)。
鸟类的适应性产热主要包括两大类:专性产热(obligatory thermogenesis)和选择性产热(facultative thermogenesis)。前者是指维持动物细胞的完整性和稳定性所必需的那部分热量,产生于所有器官,如基础代谢率(basal metabolic rate, BMR);后者是指动物对环境胁迫、季节信号等生态因子做出的有别于专性产热的代谢反应,只发生在部分组织中,又称为兼性产热、调节性产热或适应性产热,主要包括非颤动性产热(nonshivering thermogenesis, NST)、颤抖性产热(shivering thermogenesis, ST)以及食物诱导的产热(diet-induced thermogenesis, DIT)(Himms-Hagen, 1990; Ge et al, 2008)。由于测定方式和测定条件的不同,代谢产热有多种表述方式,如BMR、最大代谢率(maximal metabolic rate, MMR)、持续代谢率(sustained metabolic rate)、野外活动代谢率(field metabolic rate)等。无论何种表述方式,代谢产热反映的是物种的特异性特征(Wang et al, 2009;Swanson & Garland, 2009)。BMR是恒温动物维持正常生理机制的最小产热速率,是动物在清醒时维持身体各项基本功能所需的最小能量值(AL-Mansour, 2004; McKechnie & Wolf, 2004; Barceló et al, 2009)。现在BMR已经成为种间和种内能量代谢水平比较的重要参数,它能反映不同物种不同个体的能量消耗水平(Yuni & Rose, 2005)。BMR作为动物能量消耗的重要参数,与生物体的许多生活史特征、生理特征和行为特征密切相关,对其研究有助于了解动物在形态学、生理学、行为学和生活史对策上的进化(Burton & Weathers, 2003)。
许多鸟类面临气候变化和食物供给等季节性问题,这些问题将限制鸟类的能量利用,特别是白天活动的鸟类,冬季白天的缩短进一步影响取食效率,为此鸟类通过形态、生理和行为等方面的调整来适应不同季节的能量需求,包括降低代谢活动水平、基础代谢的漂移(shifts in basal metabolism)、改变体重和体内脂肪的含量(Rozman et al, 2003; Zheng et al, 2008b)。大型鸟类对寒冷的耐受性可以通过增加隔热层来完成。例如疣鼻天鹅(Cygnus olor)和黑琴鸡(Tetrao tetrix)在冬季可以通过增加羽毛的厚度和提高皮下脂肪的含量来改善隔热性能(Bech, 1980; Marjakangus, 1992)。然而,小型鸟类由于身体大小的限制,使它们的毛皮隔热不能无限地增加,抵抗冬季寒冷的主要方式可能是增加产热(Swanson & Liknes, 2006; Swanson, 2007)。冬季驯化(winter-acclimatized)和冷适应(coldacclimated)的鸟类常常表现出比夏季驯化(summeracclimatized)和暖适应(warm-acclimated)的鸟类有较高的BMR(Lindsay et al, 2009b)。研究表明,许多小型鸟类的BMR具有明显的季节性变化,如白胸鳾(Sitta carolinensis)和毛啄木鸟(Picoides pubescens)(Liknes & Swanson, 1996)、家麻雀(Passer domesticus)(Arens & Cooper, 2005)、树麻雀(P. montanus)(Liu et al, 2008;Zheng et al, 2008a)和白头鹎(Zheng et al, 2008b)。大量研究表明,鸟类在冷胁迫条件下,伴随BMR的提高,其产热能力增加(Arens & Cooper, 2005; Swanson & Liknes, 2006; Swanson, 2007; Zheng et al, 2008a; 2008b)。冬季鸟类对冷耐受能力的提高和较高的BMR可以解释鸟类在低温条件下有大而持久的能量输出(Swanson et al, 2009)。
肝脏是恒温动物最大和最重要的代谢活性器官,同时兼有产热功能(Villarin et al, 2003)。在基础状态下,肝脏对机体总的产热量的贡献可以达到25%。BMR水平的提高部分是由于增加肝脏的线粒体呼吸速率或特异性氧化酶活力(Li et al, 2001)。在有氧代谢中,主要的氧气消耗和ATP的合成发生在肌肉线粒体中,了解肌肉线粒体的能量代谢对于理解其功能十分重要(Rasmussen et al, 2004)。线粒体质子漏(线粒体状态4呼吸)形成了由呼吸链驱动的质子泵出和质子回漏的无效循环通路,是基础代谢率的重要组成部分(Brand et al, 2001)。线粒体蛋白含量和细胞色素C氧化酶(COX)活力代表了细胞水平上的氧化产热能力,鸟类提高专性产热的潜在机制之一是提高组织的COX的活力和线粒体呼吸(Li et al, 2001; Collin et al, 2003)。甲状腺激素(thyroid hormone)主要包括甲状腺素(thyroxine, T4)和三碘甲腺原氨酸(triiodothyronine ,T3),对动物的BMR有重要作用,增加代谢产热的重要生理基础之一是甲状腺功能状态或甲状腺激素水平产生了变化,从而调节机体的产热能力(Liu et al, 2006; Peng et al, 2010)。血清中缺乏甲状腺激素鸟类的BMR或静止代谢率(resting metabolic rate,RMR)降低30%或更多,明显降低对寒冷的耐受性,表明鸟类的专性产热至少30%依赖于甲状腺激素(Enrique & Silva, 2003)。
白头鹎(Pycnonotus sinensis)为留鸟,属雀形目(Passeriformes)鹎科(Pycnonotidae)。世界分布于欧亚大陆及非洲北部、中南半岛。在我国主要分布于东南沿海地区、太平洋诸岛屿。西起四川、云南东北部;东至沿海一带,包括海南和台湾;北达陕西南部及河南;南及广西西南等地。白头鹎在浙江省是一种最常见的雀形目鸟类之一(Zheng & Zhang, 2002)。白头鹎食性很杂,随着季节的变化而不同,春夏季以动物性食物为主,秋冬两季吃植物性食物为主。白头鹎分布范围广,数量大,它是具有代表性且一年四季都易获得的良好材料,有利于开展季节性试验(Zheng et al, 2008b)。伴随全球气候的变暖,白头鹎有向北方扩散的趋势,目前发现白头鹎已扩散至东北等地(Song, 2006)。已发现白头鹎具有较高的体温、较低的BMR和较宽的热中性区(Zhang et al, 2006),其代谢产热存在明显的季节性变化(Zheng et al, 2008b),内部器官(如肝脏、心脏、肾脏和消化道)及肌肉重量都与BMR的大小呈正相关,认为白头鹎体内存在代谢活性器官,这些器官组织具有很高的代谢活性,是白头鹎BMR的主要决定因素(Zhang et al, 2008)。然而,在自然状态下,关于白头鹎细胞产热机理的季节性变化,国内外仍缺乏研究。本文以白头鹎为实验对象,测定了野外条件下白头鹎肝脏和肌肉线粒体蛋白含量、线粒体呼吸和COX活力,试图从细胞水平进一步解释白头鹎产热的季节性变化及其生理适应对策。
1 材料与方法
1.1 实验动物
15只白头鹎于2006年冬季(12月下旬至次年1月,8只:4♀、4♂)和2007年夏季(6月下旬至7月,7只:2♀、5♂)捕自浙江省温州市地区(27°29’N,120°51’E),标记并分笼(每笼1只)饲养于温州大学动物实验房。在自然光照和室温平均为21.3℃(18—26℃)的环境条件下自由取食和饮水,一天后用于实验。
1.2 代谢测定
动物的代谢率以每小时单位体重的耗氧量表示[ml O2/(g·h)]。耗氧量采用封闭式流体压力呼吸测定仪测定(Górecki, 1975),水浴控制呼吸室温度,温度控制在±0.5℃以内。呼吸室体积为3.6 L,用KOH和硅胶吸收呼吸室内的CO2和水分。实验温度为25℃。代谢率(MR)的测定每天在14:00—20:00时间进行。实验前动物禁食4 h,放入呼吸室内适应1 h,每隔5 min记录一次,选择两个连续的﹑稳定的最低值计算MR,共测定1 h的耗氧量。
1.3 线粒体的制备及呼吸的测定
代谢测定结束后,于次日将动物的颈割断杀死,迅速而小心取出肝脏和肌肉,按照Sundin et al(1987)介绍的方法,将肝脏和肌肉置于0.25 mol/L蔗糖溶液中清洗(冰浴),然后将剪碎的组织放入玻璃-Teflon匀浆器内,加入一定体积的匀浆液匀浆(100 mmol/L KCl、50 mmol/L Tris-HCl、5 mmol/L MgSO4、1 mmol/L EDTA, pH 7.2),于3 000 r/min离心7 min,取上清液于10 000 r/min(10 min两次),得到线粒体。
肝脏和肌肉的线粒体状态4呼吸采用铂氧电极-溶氧仪(英国Hansatech, DW-1)测定,反应温度为30℃,反应杯的总体积为2 mL,加入1.98 mL基质液(225 mmol/L sucrose、50 mmol/L Tris/HCl、5 mmol/L MgCl2、1 mmol/L EDTA、5 mmol/L KH2PO4, pH 7.2)和0.02 mL线粒体提取液(Estabrook, 1967),以琥珀酸作底物。
1.4 细胞色素C氧化酶(COX)的测定
COX按改良的Sundin et al(1987)的方法,采用铂氧电极-溶氧仪测定,反应温度为30℃,反应杯的总体积为2 mL,加入1.99 mL基质液(100 mmol/L KCl、20 mmol/L TES、1 mmol/L EGTA、2 mmol/L MgCl2、4 mmol/L KH2PO4、60 mmol/L BSA, pH 7.2)和0.01 mL线粒体提取液,以细胞色素C作底物。
1.5 蛋白含量的测定
以牛血清蛋白作为标准,采用Lowry et al(1951)的方法,测定肝脏和肌肉的蛋白质含量。
1.6 血清甲状腺素(T4)和三碘甲腺原氨酸(T3)浓度测定
采用中国原子能研究院生产的T3和T4放射免疫药盒进行测定(Liu et al, 2006)。
1.7 统计分析
利用SPSS统计软件包进行t-检验处理,为了避免代谢率指标受体重的影响而导致分析结果出现误差,采用体重为协变量的协方差分析(ANCOVA)比较代谢率相对大小和体重的季节性差异。文中数据以平均值±标准误(Mean±SE)表示,P<0.05即认为差异显著。
2 结 果
2.1 体重和基础代谢率(BMR)
白头鹎的体重季节之间差异显著。冬季较高,夏季较低,冬季白头鹎的体重比夏季高24%(表1)。白头鹎的BMR存在明显的季节性变化,冬季单位体重BMR(O2/g·h)比夏季白头鹎的BMR高出29%(表1)。以动物整体做单位(O2/h),白头鹎冬季的BMR比夏季BMR高出59%(表1)。白头鹎单位体重BMR和动物整体BMR经协方差校正体重后,均出现明显差异,冬季单位体重BMR比夏季高出61%(F(1,12)=6.646,P<0.05);冬季整体BMR比夏季高出59%(F(1,12)=10.518,P<0.01)。
2.2 肝脏线粒体蛋白、线粒体呼吸和COX活力
季节性变化对白头鹎肝脏线粒体蛋白含量有显著影响,冬季肝脏线粒体蛋白含量比夏季高出53%(表1)。冬季肝脏的线粒体状态4呼吸明显升高,单位线粒体呼吸[nmol O2/(min·mg) protein]比夏季高出28%,每克组织线粒体呼吸[μmol O2/ (min·g) tissue]比夏季高出94%(表1)。冬季白头鹎肝脏COX活力明显高于夏季,单位酶活力[nmol O2/ (min·mg) protein] 增加了50%(t=2.324,df=13,P<0.05),每克组织酶活力(μmol O2/ min·g tissue)增加了128%(t=3.923,df=13,P<0.01)(图1)。
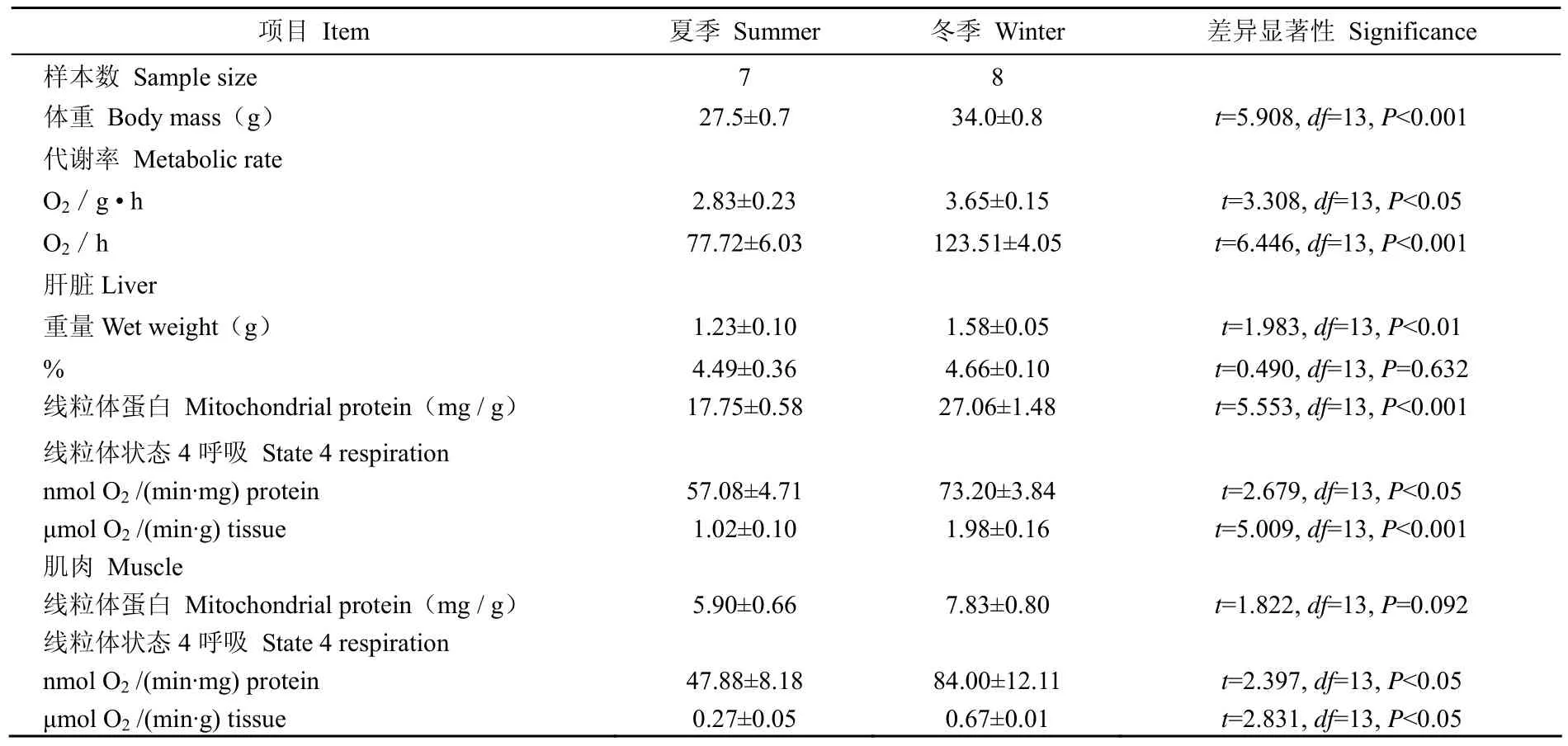
表 1 白头鹎肝脏和肌肉冬夏两季产热特征Tab. 1 Character in thermogenesis of liver and muscle in Chinese bulbul Pycnonotus sinensis between summer and winter
2.3 肌肉线粒体蛋白、线粒体呼吸和COX活力
与夏季相比,冬季白头鹎的肌肉线粒体蛋白没有明显的变化(表1),但状态4呼吸有明显的变化,单位线粒体呼吸比夏季高出75%,每克组织线粒体呼吸比夏季高出148%(表1)。冬季白头鹎肌肉COX与夏季相比,差异显著。单位酶活力增加了66%(t=3.026,df=13,P P<0.05),每克组织酶活力增加了146%(t=5.234,df=13,P<0.001)(图2)。
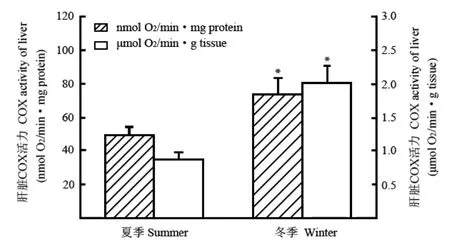
图 1 冬夏两季白头鹎肝脏COX活力的变化Fig. 1 Changes on mitochondrial COX activity of liver in Chinese bulbuls between summer and winter

图 2 冬夏两季白头鹎肌肉COX活力的变化Fig. 2 Changes on mitochondrial COX activity of muscle in Chinese bulbuls between summer and winter
2.4 血清T4和T3含量
白头鹎血清T3含量存在明显的季节性变化,冬季血清T3含量比夏季高出75%(t=6.752,df=13,P<0.001);而血清T4含量没有明显的季节性变化(t=1.603,df=13,P>0.05)(图3)。
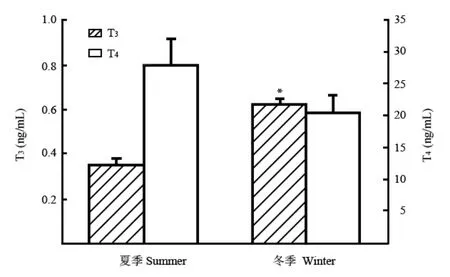
图 3 冬夏两季白头鹎血清T4和T3含量的变化Fig. 3 Serum T3 and T4 in Chinese bulbuls between summer and winter
3 讨 论
冬季活动的小型鸟类,通过调整体重、体脂含量、代谢率、行为、激素、生理和生化指标等一系列策略来适应可变的外界环境(Swanson & Liknes, 2006; Swanson, 2007; Zheng et al, 2008a; 2008b; Chamane & Downs, 2009)。本研究表明,白头鹎的产热能力明显受季节性环境变化的影响,表现出冬季BMR、生理和生化等指标明显增加,而夏季表现出相反的结果。
3.1 体重和BMR的季节性变化
3.1.1 体重 许多外界因素,如温度、光照、食物的质和量及自身的生理状态在鸟类体重调节方面起着重要的作用,体重已成为衡量鸟类生存代价(living costs)的重要指标之一(McNab, 2009)。冬季鸟类体重的增加可以部分解释为动物能量储备和(或)产热调节的改变(Liknes & Swanson, 1996)。本研究表明,白头鹎的体重表现出明显的季节性变化,冬季白头鹎的体重比夏季高处24%(表1)。体重的这一变化趋势与在许多温带其他小型鸟类相一致(Liknes & Swanson, 1996; Zheng et al, 2008a; Chamane & Downs, 2009),如燕雀(Fringilla montifringilla)冬季体重比夏季高出15%(Pohl, 1971);白胸鳾和毛啄木鸟冬季的体重分别比夏季高出5%和7%(Liknes & Swanson, 1996);冬季树麻雀的体重与夏季相比,增加了4%(Zheng et al, 2008a)。Chamane& Downs(2009)在研究南非红翅椋鸟(Onychognathus morio)时也发现类似的结果,该鸟冬季的体重显著增加。冬季体重的增加可以降低体表面积的比率(ratio of surface-to-volume),可以减少热量的散失(Schmidt-Nielsen, 1997)。
3.1.2 BMR 当外界环境温度降低时,动物需要增加能量消耗而保持恒温。小鸟类在冬季保持活动性,主要依赖于增加对寒冷的耐受性和(或)降低对能量的消耗,这可以通过行为、形态和生理机制的变化得以实现(Liu & Li, 2006; Swanson, 2007),而小型鸟类抵抗寒冷的主要方式可能是增加产热(Swanson, 2007; Swanson & Garland, 2009)。许多小型鸟类的BMR伴随季节驯化(seasonal acclimatization)和冷适应(cold acclimation)而增加,如树麻雀(Zheng et al, 2008a)、白胸鳾和毛啄木鸟(Liknes & Swanson, 1996)、艾米花蜜鸟(Chalcomitra amethystina)(Lindsay et al, 2009a; b)、红领带鹀(Zonotrichia capensis)(Maldonado et al, 2009)和戴胜百灵(Alaemon alaudipes)(Williams & Tieleman, 2000)。相似的结果也出现在许多小型哺乳动物,如长爪沙鼠(Meriones unguiculatus)(Zhang & Wang, 2007)、布氏田鼠(Microtus brandti)(Li & Wang, 2005)、高原鼠兔(Ochotona curzoniae)(Wang et al, 2006a)和根田鼠(M. oeconomus)(Wang et al, 2006b)等。内温动物要保持高而恒定的体温,主要的机制之一是改变产热和散热的比率,使身体达到热平衡(Schmidt-Nielsen, 1997)。由于小型鸟类有相对较大的体表面积,散热量相对较高,高的代谢产热可以弥补小型鸟类散热的损失。大量的研究结果表明,鸟类无论在种内和种间水平上,高的代谢产热与鸟类对冷的耐受性显著正相关,好的耐受能力与高的产热能力相伴(Swanson & Garland, 2009)。从季节的角度讲,小型鸟类冬季高的代谢率和对寒冷耐受的改善普遍存在,这些研究说明,高代谢率是小型鸟类在冬季寒冷条件下生存的必备条件,同时也可以作为衡量小型鸟类对寒冷耐受能力的指标(Swanson & Garland, 2009)。白头鹎冬季单位体重的BMR和整体BMR分别是夏季的1.3和1.6倍,提示冬季BMR的增加可以改善对冷环境的胁迫,是其重要适应对策之一。鸟类提高BMR的潜在机制包括增加某些营养器官和(或)组织(nutritional organs and/or tissue)的重量(Swanson & Garland, 2009)、提高某些营养器官和(或)组织的线粒体呼吸、氧化酶的活力和与增加代谢相关的激素水平(Collin et al, 2003; Liu et al, 2008;Zheng et al, 2008a)。
3.2 细胞水平上产热能力的季节性变化
3.2.1 肝脏 化学产热是动物体温调节的重要基础,其热能来自细胞内代谢、细胞内线粒体呼吸和氧化磷酸化作用。质子漏(proton leak)是质子返回基质时不通过ATP合成酶复合体进行ATP合成,而直接通过线粒体内膜回到基质的过程。这一过程中,贮存在质子动力势中的自由能全部以热的形式释放。质子漏在动物的基础代谢中占有重要的地位,对细胞的呼吸和整体的代谢率都有重要的贡献。肝脏是动物氧气消耗的重要器官,承担了呼吸率的15%—20%,离体的肝细胞在静息状态下用于驱动质子漏的氧耗比率可以达到26%(Villarin et al, 2003)。细胞色素C氧化酶是线粒体内重要的呼吸酶之一,其酶活力的变化可以反映出组织内代谢产热的差异(Li et al, 2001; Zheng et al, 2008a)。在季节性驯化中,动物的组织可以通过增加组织特殊产热能力(即从质上增加产热能力)和(或)增加单位组织重量的产热能力(即以量上增加产热)来提高动物的整体产热能力(Zheng et al, 2008a; Liu et al, 2009)。我们的研究结果显示,白头鹎冬季肝脏的单位线粒体呼吸和每克组织线粒体呼吸分别增加了28%和94%(表1);COX的单位酶活力和每克组织酶活力分别增加了50%和128%(图2),表明白头鹎冬季肝脏的代谢产热明显高于夏季肝脏的代谢产热。相似的结果发现于树麻雀(Liu et al, 2008;Zheng et al, 2008a)、树雀鹀(Spizella arborea)(Swanson, 2001)、白胸鳾和毛啄木鸟(Liknes & Swanson, 1996)等小型鸟类和高原鼠兔(Wang et al, 2006a)、根田鼠(Wang et al, 2006b)、布氏田鼠(Li & Wang, 2005)、长爪沙鼠(Zhang & Wang, 2007)和树鼩(Tupaia belangeri)(Li et al, 2001)等小型哺乳动物。
3.2.2 肌肉 肌肉的单位重量代谢效率相对较低(lower mass-specific metabolic rates),但由于肌肉将近占鸟类身体的40%,是鸟类基础产热和ST的主要贡献者之一(Swanson et al, 2009)。Porter(2001)发现骨骼肌线粒体质子漏对于呼吸速率和有效P/O比有很强的控制作用,细胞内有效P/O比是最大值的34%。因此,骨骼肌的线粒体质子漏在能量代谢中的作用比肝脏的还要重要。研究表明,骨骼肌产热能力的增加是由肌肉重量的增加和(或)线粒体呼吸及酶活力的提高所决定的(Zheng et al, 2008a; Swanson et al, 2009)。Williams et al(2000)将戴胜百灵分别放在15℃和36℃温度条件下驯化3周,然后测量各组动物的BMR和肌肉的干重,结果发现进行低温驯化的戴胜百灵,其BMR显著高于高温驯化组。与之相对应,低温驯化的戴胜百灵,肌肉重量也高于高温处理组。Zhang et al(2008)在研究白头鹎的代谢率与器官重量在季节驯化中的可塑性变化中发现白头鹎的胸肌在季节驯化中发生显著变化,冬季最高。白头鹎冬季肌肉的单位线粒体呼吸和每克组织线粒体呼吸分别是夏季的1.8和2.5倍(表1);COX的单位酶活力和每克组织酶活力分别增加了66%和146%(图3),表明白头鹎冬季的肌肉的代谢产热明显高于夏季肌肉的代谢产热。这一结果与许多寒温带小型鸟类的肌肉产热特点相似(Swanson et al, 2009)。Zheng et al(2008a)在研究树麻雀时发现其经季节性驯化后其肌肉的COX活力冬季较高,夏季较低,并认为是树麻雀抵御冬季寒冷的重要方式之一。Liu et al(2009)在研究小型哺乳动物布什田鼠的肌肉代谢产热时也发现类似的现象,并认为肌肉的线粒体呼吸和COX活力的不同是造成布什田鼠整体代谢产热差异的主要原因之一。我们的结果显示冬季白头鹎肌肉的单位线粒体呼吸和每克组织线粒体呼吸均明显增加,COX单位酶活力和每克组织酶活力明显提高,相应BMR与之发生平行的变化,表明肌肉细胞水平上能学参数的变化与整体代谢水平相一致。
专性产热对动物维持稳定的体温和正常的生理机能起着非常重要的作用,因而线粒体蛋白含量、线粒体呼吸和细胞色素氧化酶活力等产热指标对动物维持体温和正常的生理机能有重要的作用(Zheng et al, 2008a; Swanson et al, 2009)。以上可见白头鹎肝脏和肌肉组织线粒体呼吸和细胞色素C氧化酶活力的升高可以部分体现出其整体代谢水平的提高。
3.3 血清T4和T3含量的季节性变化
甲状腺激素对动物的基础代谢有调节作用,甲状腺活性的增加往往与基础代谢的增加相伴行(Yen, 2001)。甲状腺激素可以刺激线粒体的增殖;改变线粒体的结构组成,加速底物的氧化;提高Na+-K+-ATP酶的活性和细胞的能量需要,促进线粒体底物的氧化等途径来提高动物的专性产热(Liu et al, 2006; Marín-García, 2010。同时,甲状腺激素可以通过增加骨骼肌的重量、提高肌肉组织的细胞色素C氧化酶的活力和线粒体呼吸等途径提高动物的选择性产热(Collin et al, 2003)。缺乏甲状腺激素,肌肉的产热能力明显降低(Dridi et al, 2004)。低温可以通过增加血液中有功能作用的甲状腺激素、通过促进组织和血液中的T4脱碘转变为T3、提高T3转化率和利用率和增加T3的分泌等途径提高动物的基础产热能力(Yen, 2001)。Jenni-Eiermann et al(2002)发现一些小型鸟类,如白冠带鹀(Zonotrichia leucophrys)、家麻雀和红腹滨鹬(Calidris canutus)血清中甲状腺激素含量的季节性波动与BMR的季节性变化相伴行,认为甲状腺激素参与了鸟类的季节性代谢调节。Zheng et al(2008a)在研究树麻雀产热的季节性变化时发现血清的T3含量与BMR具有明显的相关性,认为血清中甲状腺激素刺激树麻雀的整体代谢产热。Liu et al(2006)报道当小鹀(Emberiza pusilla)饲喂甲状腺激素后表现出伴随肝脏和肌肉线粒体呼吸和COX活力的增加,整体代谢水平明显提高,并认为甲状腺激素通过刺激线粒体呼吸和提高COX活力,在小鹀的产热调节中起到非常重要的作用。Peng et al(2010)的研究结果表明,白头鹎经甲状腺激素处理后,肝脏和肌肉的单位线粒体呼吸和每克组织线粒体呼吸升高;细胞色素C氧化酶单位酶活力和每克组织酶活力增加,认为甲状腺激素通过刺激肝脏肌肉线粒体呼吸,提高酶活,使白头鹎的整体产热能力增加。冬季白头鹎血清T3含量是夏季的1.8倍。冬季白头鹎甲状腺激素增加时,伴随着肝脏和肌肉组织中氧化酶活力的提高,使机体产热增加。
比较表1到图3,显示出白头鹎在季节性驯化过程中从整体、器官到生理和生化的可塑性变化,小型鸟类通过形态、生理和生化的改变来适应外界环境(Maldonado et al, 2009)。白头鹎通过增加肝脏和肌肉的重量(Zhang et al, 2008)以及肝脏和肌肉的线粒体呼吸、COX活力及血清甲状腺激素含量来提高产热能力以适应冬季的环境条件,具有重要意义。
致谢:中国科学院动物研究所王德华研究员和北京师范大学生命科学院李庆芬教授提供Kalabukhov- Skvortsov呼吸测定仪;美国南达科塔大学Dr. D. L. Swanson惠赠部分文献资料,特此致谢。
AL-Mansour MI. 2004. Seasonal variation in basal metabolic rate and body composition within individual sanderling birdCalidris alba[J].J Biol Sci, 4: 564-567.
Arens JR, Cooper SJ. 2005. Metabolic and ventilatory acclimatization to cold stress in house sparrowsPasser domesticus[J].Physiol Biochem Zool, 78: 579-589.
Barceló G, Salinas J, Cavieres G, Canals M, Sabat P. 2009. Thermal history can affect the short-term thermal acclimation of basal Metabolic rate in the passerineZonotrichia capensis[J].J Therm Biol, 34: 415-419.
Bech C. 1980. Body temperature, metabolic rate, and insulation in winter and summer acclimatized Mute Swans (Cygus olor) [J].J Comp Physiol: B, 136: 61-66.
Brand MD, Boutilier RG, Wass M, St-Pierre J, Bishop T. 2001. Mitochondrial Proton Leak in Metabolic Depression [M]//Storey KB. Molecular Mechanisms of Metabolic Arrest: Life in Limbo. Oxford: BIOS Scientific Publishers Ltd, 59-76.
Burton CT, Weathers WW. 2003. Energetics and thermoregulation of the Gouldian finch (Erythrura gouldiae) [J].Emu:Austral Ornithology, 103: 1-10.
Chamane SC, Downs CT. 2009. Seasonal effects on metabolism and thermoregulation abilities of the Red-winged Starling (Onychognathus morio) [J].J Therm Biol, 34: 337-341.
Collin A, Buyse J, Van As P, Darras VM, Malheiros RD, Moraes VMB, Reyns GE, Taouis M, Decuypere E. 2003. Cold-induced enhancement of avian uncoupling protein expression, heat production and triiodothyronine concentrations in broiler chicks [J].Gen Comp Endocrinol, 130: 70-77.
Dridi S, Onagbesan O, Swennen Q, Buyse J, Decuypere E, Taouis M. 2004. Gene expression, tissue distribution and potential physiological role of uncoupling protein in avian species [J].Comp Biochem Physiol, 139A: 273-283.
Enrique J, Silva MD. 2003. The thermogenic effect of thyroid hormone and its clinical implications [J].Ann Int Med, 139: 205-213.
Estabrook RW. 1967. Mitochondrial Respiratory Control and Polarographic Measurement of ADP/O ratio [M]//Estabrook RW, Pullman ME. Methods in Enzymes. New York: Academic Press, 41-47.
Ge CR, Gao SZ, Jia JJ, Mark J. 2008. Diet-dnduced thermogenesis [J].Agrc Sci Chn, 7: 1133-1139.
Górecki A. 1975. Kalabukhov-Skvortsov Respirometer and Resting Metabolic Rate Measurement [M]// Grodziński W. Methods for Ecological Energetics. Oxford: Blackwell Scientific, 309-313.
Guglielmo CG, Williams TD. 2003. Phenotypic flexibility of body composition in relation to migratory state, age, and sex in the western sandpiper (Calidris mauri) [J].Physiol Biochem Zool, 76: 84-98.
Himms-Hagen J. 1990. Brown Adipose Tissue Thermogenesis: Role in the Thermoregulation, Energy Regulation and Obesity [M]// Schonbaum E, Lomax P. Thermoregulation Physiology and Biochemistry. New York: Pergamon Press, 327-414.
Jenni-Eiermann S, Jenni L, Piersma T. 2002. Temporal uncoupling of thyroid hormones in Red Knots: T3peaks in cold weather, T4during moult [J].J Ornithol, 143: 331-340.
Li QF, Sun RY, Huang CX, Wang ZK, Liu XT, Hou JJ, Liu JS, Cai LQ, Li N, Zhang SZ, Wang Y. 2001. Cold adaptive thermogenesis in small mammals from different geographical zones of China [J].Comp Biochem Physiol, 129A: 949-961.
Li XS, Wang DH. 2005. Regulation of body weight and thermogenesis in seasonally acclimatized Brandt's vole (Microtus brandti) [J].Horm Behav, 48: 321-328.
Liknes ET, Swanson DL. 1996. Seasonal variation in cold tolerance, basal metabolic rate, and maximal capacity for thermogenesis in whitebreasted nuthatchesSitta carolensisand downy woodpeckersPicoides pubescens, two unrelated arboreal temperate residents [J].J Avian Biol, 27: 279-288.
Lindsay CV, Downs CT, Brown M. 2009a. Physiological variation in Amethyst Sunbirds (Chalcomitra amethystina) over an altitudinal gradient in winter [J].J Exp Biol, 212: 483-493.
Lindsay CV, Downs CT, Brown M. 2009b. Physiological variation in Amethyst Sunbirds (Chalcomitra amethystina) over an altitudinal gradient in summer [J].J Therm Biol, 34: 190-199.
Liu JS, Chen YQ, Li M. 2006. Thyroid hormones increase liver and muscle thermogenic capacity in the little buntings (Emberiza pusilla) [J].J Therm Biol, 31: 386-393.
Liu JS, Li M. 2006. Phenotypic flexibility of metabolic rate and organ masses among tree sparrowsPasser montanusin seasonal acclimatization [J].Acta Zool Sin, 52: 469-477.[柳劲松, 李 铭. 2006.树麻雀代谢率和器官重量在季节驯化中表型的可塑性变化. 动物学报, 52(3): 469-477.]
Liu JS, Li M, Shao SL. 2008. Seasonal changes in thermogenic properties of liver and muscle in tree sparrowsPasser montanus[J].Acta Zool Sin, 54 (5): 777-784.[柳劲松, 李 铭, 邵淑丽. 2008. 树麻雀肝脏和肌肉产热特征的季节性变化. 动物学报, 54(5): 777-784.]
Liu JS, Yang M, Sun RY, Wang DH. 2009. Adaptive thermogenesis in Brandt's vole (Lasiopodomys brandti) during cold and warm acclimation [J].J Therm Biol, 34: 60-69.
Lowry OH, Rosebrough NJ, Farr AL, Randall RJ. 1951. Protein measurement with Folin phenol reagent [J].J BiolChem, 193: 265-275.
Maldonado KE, Cavieres G, Veloso C, Canals M, Sabat P. 2009. Physiological responses in rufous-collared sparrows to thermal acclimation and seasonal acclimatization [J].J Comp Physiol: B, 179: 335-343.
Marín-García J. 2010. Thyroid hormone and myocardial mitochondrial biogenesis [J].Vascul Pharmacol, 52(3-4): 120-130.
Marjakangus A. 1992. Winter activity patterns of the black grouse (Tetrao tetrix) [J].Orin Fenn, 69: 184-192.
McKechnie AE, Wolf BO. 2004. The allometry of avian basal metabolic rate: good predictions need good data [J].Physiol Biochem Zool, 77: 502-521.
McKechnie AE, Freckleton RP, Jetz W. 2006. Phenotypic plasticity in the scaling of avian basal metabolic rate [J].Proc Royal Soc: B, 273: 931-937.
McNab BK. 2009. Ecological factors affect the level and scaling of avian BMR [J].Comp Biochem Physiol, 152A: 22-45.
Peng LJ, Tang XL, Liu JS, Meng HT. 2010. The effects of thyroid hormone on basal thermogenesis in Chinese bulbul (Pycnonotus sinensis) [J].Acta Ecol Sin,30(6):1500-1507.[彭丽洁, 唐小丽, 柳劲松, 孟海涛. 2010. 甲状腺激素对白头鹎基础产热的影响. 生态学报, 30(6):1500-1507.
Pohl H. 1971. Seasonal variation in metabolic functions of bramblings [J].Ibis, 113: 185-193.
Porter RK. 2001. Mitochondrial proton leak: a role for uncoupling proteins 2 and 3? [J]Biochim Biophys Acta, 1504: 120-127
Rasmussen UF, Vielwerth SE, Rasmussen VH. 2004. Skeletal muscle bioenergetics: A comparative study of mitochondria isolated from pigeon pectoralis, rat soleus, rat biceps brachii, pig biceps femoris and human quadriceps [J].Comp Biochem Physiol, 137A: 435-446.
Rozman J, Runciman D, Zann RA. 2003. Seasonal variation in body mass and fat of zebra finches in south-eastern Australia [J].Emu: Austral Ornithology, 103: 11-19.
Schmidt-Nielsen K. 1997. Animal Physiology: Adaptation and Environment [M]. Cambridge: Cambridge University Press.
Song ZM. 2006. A New bird record in Northeast:Pycnonotus sinensis[J].J Mudanjiang Norm Univ:Natural Science, 54: 1-2.[宋泽明. 2006. 东北鸟类新记录——白头鹎. 牡丹江师范学院学报: 自然科学版, 54: 1-2.]
Starck JM, Beese K. 2001. Structural flexibility of the intestine of Burmese python in response to feeding [J].J Exp Biol, 204: 325-335.
Starck JM, Rahmaan GHA. 2003. Phenotypic flexibility of structure and function of the digestive system of Japanese quail [J].J Exp Biol, 206: 1887-1897.
Swanson DL. 2001. Are summit metabolism and thermogenic endurance correlated in winter-acclimatized passerine birds? [J]J Comp Physiol:B, 171: 475-481.
Swanson DL. 2007. Cold hardiness and summit metabolism in North American kinglets during fall mignation [J].Acta Zool Sin, 53: 600-606.
Swanson DL, Garland TJr. 2009. The evolution of high summit metabolism and cold tolerance in birds and its impact on present-day distribution [J].Evolution, 63: 184-194.
Swanson DL, Liknes ET. 2006. A comparative analysis of thermogenic capacity and cold tolerance in small birds [J].J Exp Biol, 209: 466-474.
Swanson DL, Sabirzhanov B, VandeZande A, Clark TG. 2009. Seasonal variation of myostatin gene expression in pectoralis muscle of house sparrows (Passer domesticus) is consistent with a role in regulating thermogenic capacity and cold tolerance [J].Physiol Biochem Zool, 82: 121-128.
Sundin U, Moore G, Nedergaard J, Cannon B. 1987. Thermogenin amount and activity in hamster brown fat mitochondria: Effect of cold acclimation [J].Am J Physiol, 252: R822-R832.
Villarin JJ, Schaeffer PJ, Markle RA, Lindstedt SL. 2003. Chronic cold exposure increases liver oxidative capacity in the marsupialMonodelphis domestica[J].Comp Biochem Physiol, 136A: 621-630.
Wang DH, Yang M, Liu QS, Zhang ZQ, Zhang XY, Chi QS, Xu DL. 2009. Physiological ecology in small mammals and evolutionary theory [J].Acta Theriol Sin, 29(4): 343-351.[王德华, 杨 明, 刘全生, 张志强,张学英, 迟庆生, 徐德立. 2009. 小型哺乳动物生理生态学研究与进化思想. 兽类学报, 29(4): 343-351.]
Wang JM, Zhang YM, Wang DH. 2006a. Seasonal thermogenesis and body mass regulation in plateau pikas (Ochotona curzoniae) [J].Oecologia, 149: 373-382.
Wang JM, Zhang YM, Wang DH. 2006b. Seasonal regulations of energetics, serum concentrations of leptin, and uncoupling protein 1 content of brown adipose tissue in root voles (Microtus oeconomus) from the Qinghai-Tibetan plateau [J].J Com Physiol:B, 176: 663-671.
Williams J, Tieleman BI. 2000. Flexibility in basal metabolic rate and evaporative water loss among hoopoe larks exposed to different environmental temperatures [J].J Exp Biol, 203: 3153-3159.
Yen PM. 2001. Physiological and molecular basis of thyroid hormone action [J].Physiol Rev, 81: 1097-1142.
Yuni LPEK, Rose RW. 2005. Metabolism of winter-acclimatized new Holland honeyeatersPhylidonyris novaehollandiaefrom Hobart, Tasmania [J].Acta Zool Sin, 51: 338-343.
Zhang GK, Fang YY, Jiang XH, Liu JS , Zhang YP. 2008. Adaptive plasticity in metabolic rate and organ masses amongPycnonotus sinensis, in seasonal acclimatization [J].Chn J Zool, 43 (4): 13-19.[张国凯, 方媛媛, 姜雪华, 柳劲松, 张永普. 2008. 白头鹎的代谢率与器官重量在季节驯化中的可塑性变化. 动物学杂志, 43(4): 13-19.]
Zhang YP, Liu JS, Hu XJ, Yang Y, Chen LD. 2006. Metabolism and thermoregulation in two species of passerines from south-eastern China in summer [J].Acta Zool Sin, 52: 641-647.[张永普,柳劲松,胡旭建,杨 扬,陈丽丹. 2006. 我国东南部地区夏季两种雀形目鸟类的代谢产热特征及其体温调节. 动物学报, 52(4): 641-647.]
Zhang ZQ, Wang DH. 2007. Seasonal changes in thermogenesis and body mass in wild Mongolian gerbils (Meriones unguiculatus) [J].Comp Biochem Physiol, 148A: 346-353.
Zheng GM, Zhang CZ. 2002. Birds in China [M]. Beijing: China Forestry Publishing House.
Zheng WH, Li M, Liu JS, Shao SL. 2008a. Seasonal acclimatization of metabolism in Eurasian tree sparrows (Passer montanus) [J].Comp Biochem Physiol, 151A: 519-525.
Zheng WH, Liu JS, Jiang XH, Fang YY, Zhang GK. 2008b. Seasonal variation on metabolism and thermoregulation in Chinese bulbul [J].J Therm Biol, 33: 315-319.
Comparison of Thermogenic Character of Liver and Muscle in Chinese BulbulPycnonotus sinensisBetween Summer and Winter
ZHENG Wei-Hong, FANG Yuan-Yuan, JIANG Xue-Hua, ZHANG Guo-Kai, LIU Jin-Song*
(School of Life and Environmental Sciences, Wenzhou University, WenzhouZhejiang325027,China)
Acclimatization to winter conditions is an essential prerequisite for survival of small passerines. Seasonal changes in a bird's physiology and behavior are considered to be part of an adaptive strategy for survival and reproductive success. Changes in photoperiod, ambient temperature and food availability trigger seasonal acclimatization in physiology and behavior of many birds. In the present study, seasonal adjustments in several physiological, hormonal, and biochemical markers were examined in wild-captured Chinese bulbuls (Pycnonotus sinensis) from the Zhejiang Province in China. Oxygen consumption was measured using the closed-circuit respirometer containing 3.6 L animal chambers. State-4 respiration in liver and muscle mitochondria was measured at 30℃ with a Clark electrode. The activities of cytochrome C oxidase (COX) in liver and muscle were measured polarographically at 30℃ using a Clark electrode. The protein content of mitochondria was determined by the Folin phenol method, with bovine serum albumin as standard. In winter sparrows had higher body mass and basal metabolic rate (BMR). The contents of mitochondrial protein in liver, and state-4 respiration and COX activity in liver and muscle increased significantly in winter. Circulating level of serum triiodothyronine (T3) was significantly higher in winter than in summer. Together, these data suggest that Chinese bulbuls mainly coped with cold by enhancing thermogenic capacities through increased activity of respiratory enzymes activities. The results support the view that prominent winter increases in BMR are manifestations of winter acclimatization in Chinese bulbuls and that seasonal variation in metabolism in bulbuls is similar to that in other small wintering birds.
Chinese bulbul;Pycnonotus sinensis; Liver; Muscle; Thermogenic character
郑蔚虹(1961–),女,副教授。研究方向:动物生态学、分子生物学。E-mail: zwh@wzu.edu.cn
Q958.11; Q959.739.08
A
0254-5853-(2010)03-0319-09
10.3724/SP.J.1141.2010.03319
2010-01-11;接受日期:2010-03-08
国家自然科学基金项目(30870377;30670324);浙江省自然科学基金项目(Y506089)
*通讯作者(Corresponding author),E-mail: ljs@wzu.edu.cn
