荧光法研究茶碱与牛血清白蛋白的相互作用
2010-12-09李改仙李建晴卫艳丽
李改仙,李建晴*,卫艳丽
(1.晋中学院 化学化工学院,山西 晋中 030600;2.山西大学 环境科学与工程研究中心,山西 太原 030006)
荧光法研究茶碱与牛血清白蛋白的相互作用
李改仙1,李建晴1*,卫艳丽2
(1.晋中学院 化学化工学院,山西 晋中 030600;2.山西大学 环境科学与工程研究中心,山西 太原 030006)
应用荧光和紫外光谱法研究了茶碱(TH)与牛血清白蛋白(BSA)相互作用的光谱特性.测定了TH与BSA在10℃、28℃和40℃温度下的结合常数KA分别为1.96×104L/mol、3.80×104L/mol,1.57×105L/mol,结合位点数n分别为1.0,1.1,1.2.实验表明:TH对BSA内源荧光的猝灭机理主要为静态猝灭;计算得到热力学参数H为26.229 KJ/mol,S为174.809 J/(mol·K).TH主要以疏水作用力与BSA相互作用;同步荧光技术研究表明,BSA的荧光主要源于TH色氨酸残基,表明TH对BSA的构象有影响.
茶碱;牛血清白蛋白;荧光光谱法;紫外光谱;静态猝灭
茶碱(Theophylline,TH)属黄嘌呤甲基衍生物,是目前常用的平喘药之一,具有较强和持久的利尿作用,以及扩张冠状动脉、兴奋心肌的作用[1].血清白蛋白是血浆中含量最丰富的蛋白质,具有贮运内源代谢产物和外源药物小分子等重要生理功能.因此进行蛋白质的定量测定,研究蛋白质与其他物质的相互作用具有十分重要的意义[2-3].本文运用荧光光谱、紫外可见光谱研究了茶碱与牛血清白蛋白(BSA)的相互作用,基于荧光猝灭现象计算了TH与BSA的表观结合常数KA和结合位点数n,从药物小分子结构角度讨论了药物-蛋白质作用规律,进一步对黄嘌呤甲基衍生物类药物与BSA作用机理的研究提供了实验数据.
1 实验部分
1.1 仪器与试剂
CARY Eclipse荧光分光光度计(自带恒温装置,美国VARIAN公司);pHS-2ST数显酸度计(上海天达仪器有限公司).
茶碱(SIGMA公司,配成1.0×10-3mol/L的储备液,使用时稀释),牛血清白蛋白(BSA,上海伯奥生物科技有限公司,配成1.0×10-4mol/L的储备液,使用时适当稀释),Britton-Robison缓冲溶液.其余药品均为分析纯.实验用水为亚沸二次蒸馏水.所用溶液于4℃下保存.
1.2 实验方法
1.2.1 TH-BSA的荧光光谱
10 mL比色管中依次加入1.0 mLBSA储备液、不同量的TH储备液、2 mLpH=7.4的B-R缓冲溶液,蒸馏水定容,室温下放置30 min.在λex/λem=280/350 nm处扫描BSA的荧光光谱及BSA在TH作用下的荧光猝灭光谱.在Δλ=15 nm和Δλ=60 nm扫描酪氨酸和色氨酸的同步荧光光谱.1 cm比色皿,激发和发射狭缝均为5.0 nm.
1.2.2 TH-BSA的紫外光谱
10 mL比色管中依次加入0.5 mLTH储备液,不同量的BSA储备液,3.0 mL pH=7.4的B-R缓冲溶液,蒸馏水定容,以与试样中BSA浓度相对应的BSA溶液作参比,放置30 min.在室温下,考察不同浓度BSA对TH紫外吸收光谱的影响.
2 结果与讨论
2.1 TH-BSA的荧光光谱
选用pH=7.4的酸度条件,固定BSA的浓度,改变TH的浓度,测得含不同浓度TH时BSA荧光光谱如图1.由图1可见,随着TH的浓度的增加,BSA的荧光逐步被猝灭.BSA的峰形变化不大,发射峰的位置λem没有显著移动,表明TH与BSA发生了作用.
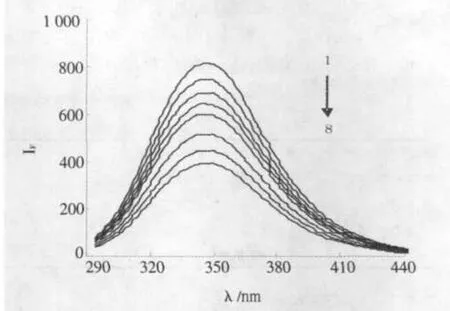
图1TH对BSA的荧光猝灭光谱Fig.1Fluorescence spectra of BSA with TH CTH=0,0.5,1.0,1.5,2.0,3.0,4.0,5.0(ⅹ10-5mol/L)CBSA=1.0ⅹ10-5mol/L
2.2 BSA的荧光猝灭机理及猝灭常数的确定
引起BSA荧光猝灭有静态猝灭和动态猝灭[4],动态猝灭符合Stern-Volmer方程:F0/F=1+KSV[Q]=1+Kqτ0[Q].静态猝灭符合Lineweaver-Burk 双倒数方程:1/(F0/F)=1/F0+KD/(F0[Q]).分别测定10、28、40℃下TH与BSA的荧光猝灭光谱,以F0/F对[Q]作Stern-Volmer曲线.以(F0-F)-1对[Q]-1作Lineweav⁃er-Burk双倒数曲线.其线性回归方程、相关系数r见表1,猝灭常数KSV及解离常数KD见表2.
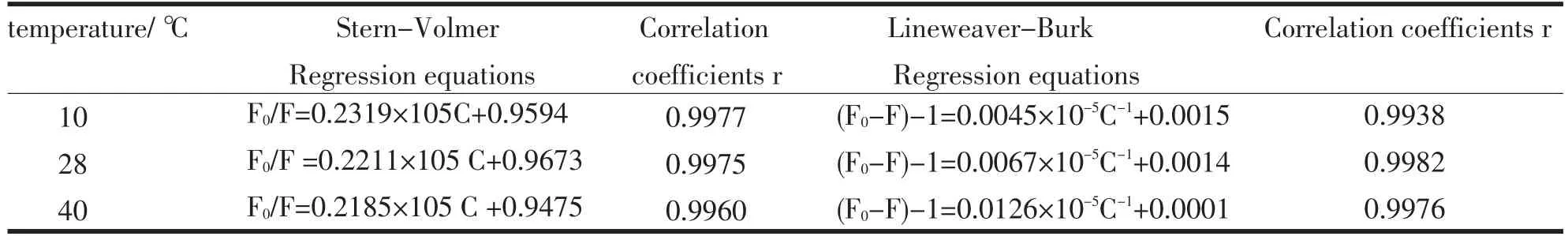
表1 Stern-Volmer和Lineweaver-Burk线性方程和相关系数Tab.1 Regression equations and correlation coefficients
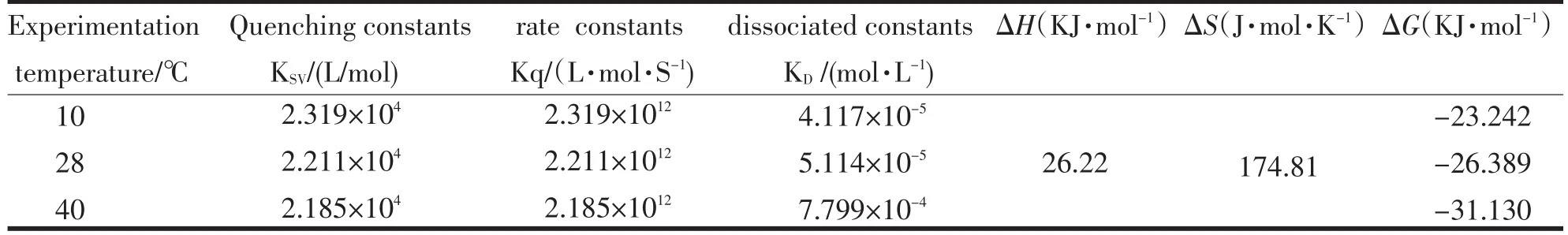
表2 猝灭反应常数和热力学参数Tab.2Quenching constants and thermodynamic parameters
2.3 TH与BSA作用的结合常数KA、结合位点数n[5]
假设探针小分子Q与生物大分子B存在n个等同且独立的结合位点,Q与B之间相互作用关系符合Langmuir单分子吸附模型:log((F0-F)/F)=log⁃KA+nlog[Q].由log((F0-F)/F)对log[Q]作图,由直线截距可得结合常数KA,斜率可求得结合位点数n,不同温度下的结果见表3.
2.4 TH与BSA作用方式的热力学研究
探针小分子与蛋白质之间的作用力包括氢键作用力,范德华力,静电作用和疏水作用[6].由Gibbs-Helmholtz方程lnK=-ΔH/RT+ΔS/R计算可得其热力学参数进行推断.实验条件下的KA值(表3)所示,以lnK对1/T作图.由直线的斜率和截距可计算出TH与BSA作用的热力学函数,结果见表2.结果表明:TH与BSA之间的作用力主要以疏水作用为主[7].

表3 不同温度下TH与BSA的结合位点数与结合常数Tab.3Binding constants and sites of BSA with TH under different temperatures
2.5 TH对BSA构象的影响
蛋白质在溶液中存在同分异构体,随溶液环境的变化表现出可以逆转的构象.由Δλ=15 nm所得的同步荧光只显示蛋白质酪氨酸残基的荧光.Δλ=60 nm所得的同步荧光只显示蛋白质色氨酸残基的荧光[8].图2、3分别为TH存在时BSA酪氨酸和色氨酸残基的荧光光谱.由于药物分子与BSA的结合,导致BSA的色氨酸残基所处环境的疏水性降低,最大发射波长发生红移.TH存在时酪氨酸残基的发射波长也略有移动.在此实验条件下,BSA的荧光主要来源于色氨酸残基,药物分子的加入引起了BSA构象的变化.
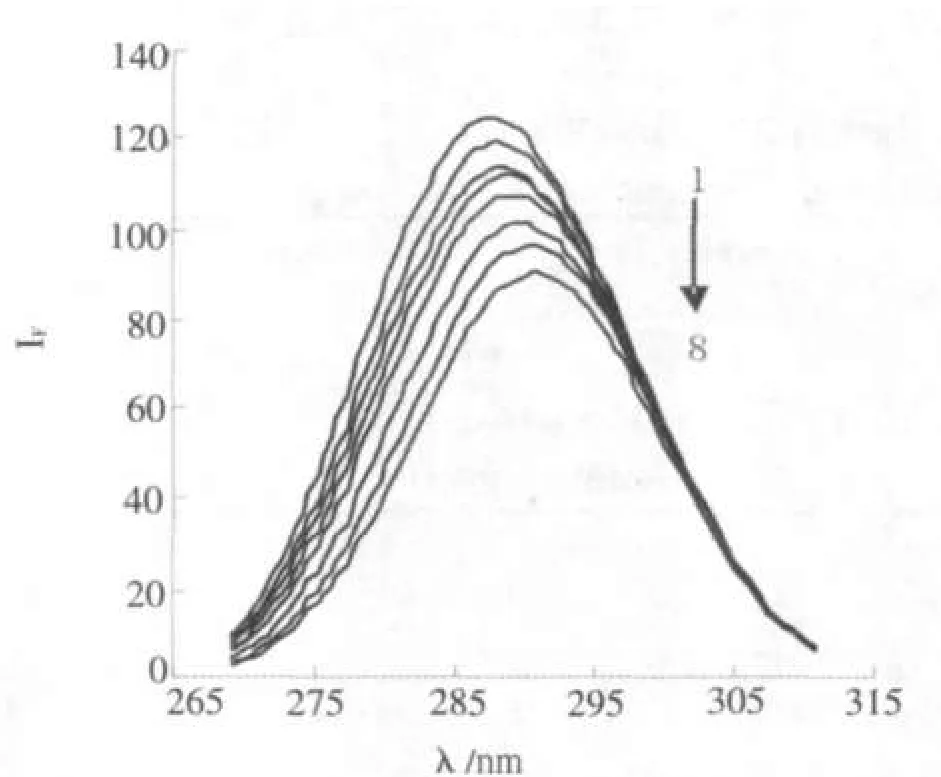
图2TH存在下BSA的同步荧光光谱,Δλ=15nmFig.2 The synchronal fluorescence spectra of BSA CTH=0,0.5,1.0,1.5,2.0,3.0,4.0,5.0(10-5mol/L),CBSA=1ⅹ10-5mol/L
2.6 TH与BSA相互作用的紫外光谱法验证研究[9-10]
依据实验方法得到TH与不同浓度BSA结合后的紫外吸收光谱图(图4).BSA与TH的结合常数,可以通过BSA与TH相互作用前后的吸光度值与BSA浓度之间的关系求出:
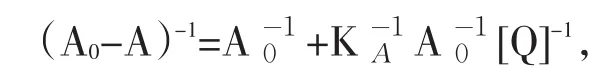
其中A0为BSA不存在时的体系吸光度,A为加入不同量BSA后体系的吸光度.
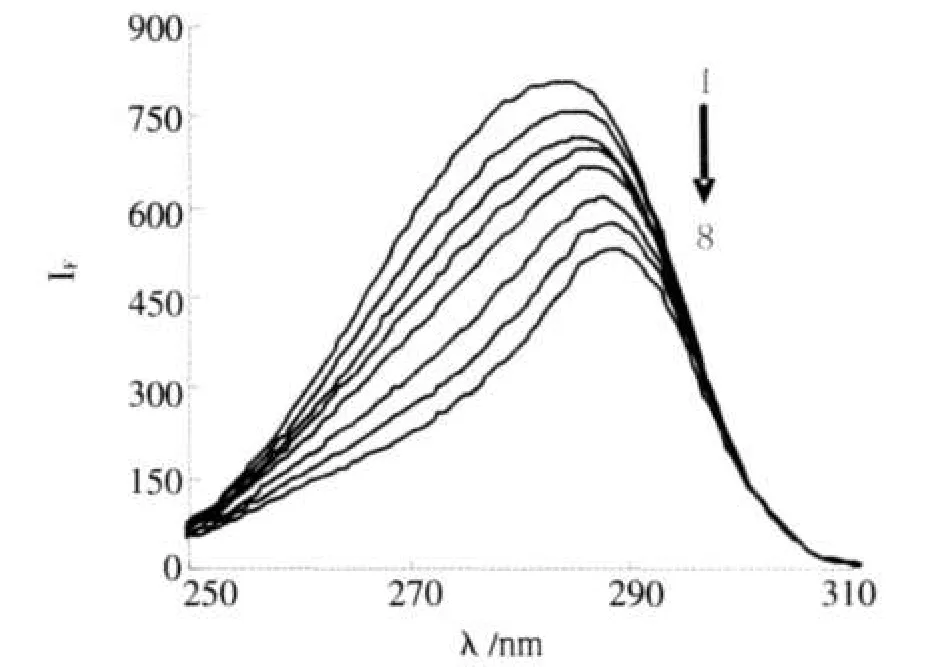
图3TH存在下BSA的同步荧光光谱,Δλ=60nmFig.3 The synchronal fluorescence spectra of BSA CTH=0,0.5,1.0,1.5,2.0,3.0,4.0,5.0(10-5mol/L),CBSA=1ⅹ10-5mol/L
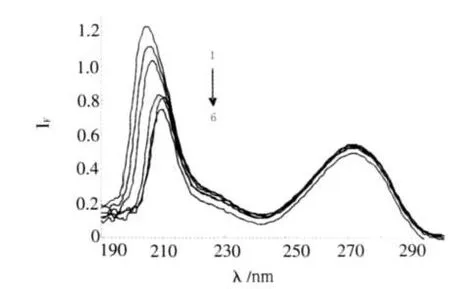
图4TH-BSA体系的紫外吸收光谱Fig.4UV spectra of TH-BSA systerm CTH=5×10-5mol/L;CBSA=0,0.2,0.4,0.8,1.0,1.2(10-6mol/L)
由图4可见,TH在205nm处的吸收峰均有规律的降低且发生显著红移.说明TH与BSA形成了配合物.以上述波长处的吸收峰值考察BSA浓度对TH紫外吸收性质的影响.作(A0-A)-1对[BSA]×10-5的Lineweaver-Burk双倒数曲线图,可得KA,结果见表4.2.6共存物质的影响实验
在前面的实验条件下,对常见的几种生物体有机物质和共存无机离子的干扰进行了测定,测定以相对误差±5%左右为标准,计算共存物质存在的浓度,结果列于表5.表42种光谱法测得TH-BSA相互作用体系的结合常数、线性回归方程和相关系数r Tab.4 Binding paraments,regression equations and correlation coefficient(r)of the interaction systerm studied by different methods
作用体系 方法 KA(L/mol) 线性回归方程 相关系数r TH-BSA 3.9428×1045.3672×105FS UVS log(F0-F)/F=1.0655log[Q]+4.5958(A0-A)-1=1.5197[Q]-1+0.861 0.9979 0.9965表5 共存物质的影响Tab.5 Influence of coexisting substances(CTH=1.0×10-5mol/L)
coexisting substances Cu2+Fe3+Pb2+Al3+Zn2+Ca2+Mg2+Ni2+DL-半光氨酸 柠檬酸 L-苯丙氨酸 DL-苹果酸C共存(×10-5mol/L) 0.6 0.5 0.8 6.8 13.7 110 2400 1.8 3.65 860 15.6 820
结果表明:由于BSA可与许多金属离子发生作用,各种金属离子与BSA的结合部位不同,结合力也有差别.金属离子的存在会影响TH与蛋白的结合能力,即影响TH与BSA的结合常数.
[1]国家医药管理总局中草药情报中心站.植物有效成分手册[M].北京:人民卫生出版社,1986:16-40.
[2]景顺杰,李建晴,王淑芬,等.6-糠氨基嘌呤与牛血清白蛋白相互作用的研究[J].分析科学学报,2008,24(2):181-184.
[3]李建晴,朱海斌,卫艳丽.可可碱与牛血清白蛋白作用光谱特性的研究[J].分析科学学报,2009,25(3):301-304.
[4]许金钩,王尊本.荧光分析法[M].3版.科学出版社,2006:64-72.
[5]Alain M,Mkhel B,Michel D.How to Illustrate Li⁃gand-Protein Binding in a Class Experiment[J].Journal of Chemical Education,1986,63(4):365-366.
[6]Orwcora J,Bochs B.In silico prediction of drug-binding strengths to human serum albumin[J].J Chromatogr B.Biomed Appl.,1996,677(1):1-28.
[7]郭兴家,李晓舟,徐淑坤,等.荧光猝灭法研究胆红素与牛血清白蛋白的相互作用[J].分析试验室,2007,26(4):11-15.
[8]Dockal M,Carter D C,Ruker F.Conformational Tran⁃sitions of the Three Recombinant Domains of Human Se⁃rum Albumin Depending on pH[J].Biol Chem,2000,275:3042-3050.
[9]谭韬,黄锐,夏之宁.改进荧光光谱法研究药物与血清白蛋白的相互作用[J].分析化学,2007,35(10):1415-1420.
[10]刘丽珍,郑思宁,彭亦如.2,10,18,26-四磺酸基酞菁锌的合成及其与牛血清白蛋白的作用[J].分子科学学报,2005,21(5):156-62.
Study on the Interactions Between Theophylline and Bovine Serum Albumins by Fluorescence Spectroscopy
LI Gaixian1,LI Jianqing1*,WEI Yanli2
(1.College of Chemistry and Chemical Engineering,Jingzhong College,Jingzhong030600,China;2.Environmental-science and Engineering-study center,Shanxi University,Taiyuan030006,China;)
The interactions between Theophylline and bovine serum albumin(BSA)were studied by fluorescence and UV absorption spectroscopy.The binding constants KA(1.96×104,3.80×104,1.57×105)and binding sites n(1.0,1.1,1.2)were measured at different temperatures of 10℃,28℃and 40℃.The results revealed that Theophylline has strong abili⁃ty to quench the intrinsic fluorescence of BSA and the interactions has been verified as static quenching procedure.Ac⁃cording themodynamic parameters the acting forces were determined to be hydrophobic force.
Theophylline;Bovine Serum Albumin;Fluorescence;Ultraviolet absorption spectures;Energy transfer
O 657.31
A
1674-4942(2010)04-0396-04
2010-05-30
国家自然科学基金(20875059);山西省归国留学人员基金(200809)
*通讯作者
毕和平
