热休克蛋白90在硫化氢保护PC12细胞对抗化学性缺氧损伤中的作用
2010-12-08孟金兰兰爱平杨春涛杨战利王立伟陈丽新朱琳燕陈培熹冯鉴强
孟金兰,兰爱平,杨春涛,杨战利,王立伟,陈丽新,朱琳燕,陈培熹,冯鉴强
近年的研究表明[1],硫化氢(hydrogen sulfide,H2S)作为一种新型的气体信号分子,不仅具有神经调质的作用,而且也被视为一种重要的生理性保护成分,具有广泛的生物学效应。H2S不仅可保护鼠大脑皮层神经元对抗氧化应激的损伤[2];亦具有抗神经元凋亡的作用[3,4]。有趣的是,当小鼠吸入H2S后能降低体内代谢约90%,然后进入“假死”状态[5],由此而保护小鼠对抗随后致命的缺氧损伤[6]。但是H2S能否保护神经细胞对抗化学性缺氧引起的损伤尚未明确。
热休克蛋白(heat shock proteins,Hsp)是细胞受到各种理化因素刺激(包括缺氧)后诱导机体产生的一组保护性蛋白,包括Hsp90、Hsp70和Hsp40等。这些蛋白广泛存在于生物界的原核及真核生物细胞中,参与调节其多种靶蛋白(包括存活和凋亡因子)的折叠和结构稳定[7]。在缺氧条件下,Hsp90的表达上调可对抗心肌缺血/再灌注引起的损伤[8]。应用Hsp90抑制剂抑制其表达可增加心肌的缺血/再灌注损伤[9],然而,H2S抗化学性缺氧的神经细胞保护作用是否与Hsp90信号通路有关,Hsp90在其中起何作用还不清楚。由此,本研究应用CoCl2(一种化学性低氧模拟剂)损伤具有神经元形态和功能特征的来源于大鼠嗜铬细胞瘤的PC12细胞,以建立化学性缺氧诱导的神经细胞损伤模型,拟探讨H2S能否对抗CoCl2引起的PC12细胞损伤及Hsp90在其中的作用。
1 材料与方法
1.1 材料 NaHS、氯化钴、17-丙烯胺基-17-去甲氧基格尔德霉素(17-allylamino-17-demethoxygeldanamycin,17-AAG)、Hoechst 33258 购自美国 Sigma Aldrich公司,CCK-8试剂盒购自日本Dojindo Lab,DMEM培养基购自Gibco公司。PC12细胞由中山大学实验动物中心提供。
1.2 细胞培养 PC12细胞培养于含10%胎牛血清的DMEM培养基中。于37℃、5%CO2条件下培养,选取对数生长期细胞进行实验。
1.3 实验分组 实验分为6组:① 空白对照组(Control);② NaHS预处理组(PC):单独应用400 μmol·L-1NaHS处理PC12细胞3 h;③ CoCl2损伤组(CoCl2):应用600 μmol·L-1CoCl2处理 PC12 细胞48 h;④ PC+CoCl2;⑤ 17-AAG+PC+CoCl2:在应用 NaHS 前30 min,用2 μmol·L-1Hsp90 抑制剂17-AAG处理细胞30 min,其余的实验步骤与④ 组相同;⑥ 单独17-AAG 组(17-AAG):应用2 μmol·L-117-AAG处理PC12细胞30 min。
1.4 细胞存活率的检测 取对数生长期细胞,以1×104/孔接种于96孔板,在37℃、5%CO2条件下培养过夜后,更换为含有不同处理因素的培养基,每组设5个复孔。处理结束后各组细胞分别与CCK-8(每孔 100 μl加 10 μl CCK-8)37℃孵育 4 h,随后在酶联免疫检测仪测定每孔的吸收值(λ=450 nm),按公式:存活率(%)=实验组OD/正常对照组OD×100%,求出实验组的存活率,重复3次。
1.5 Hoechst 33258核染色法检测细胞凋亡 把PC12细胞接种于24孔板内,按实验分组要求给不同的处理因素作用一定时间后,PBS洗两次,加入新鲜配制的4%多聚甲醛,4℃固定10 min,PBS漂洗后,加入5 mg·L-1Hoechst 33258试剂,室温轻摇10 min。在荧光显微镜(TE-2000,Nikon,Japan)下摄片,正常细胞核表现为弥漫均匀的低强度荧光,凋亡细胞核呈浓染致密固缩状态或颗粒状荧光。随机选取视野在荧光显微镜下摄片。
1.6 PI染色流式细胞仪(FCM)检测细胞凋亡细胞按实验要求给以不同的因素处理后,离心收集细胞,PBS洗两次,加入预冷的70%乙醇4℃固定过夜。用PBS洗两遍,PI染色后,用流式细胞仪检测细胞内DNA的含量(激发波长:488 nm;发射波长:610 nm)。每样本计数12 000个细胞,以DNA组方图中低于G1期DNA含量的亚G1峰的大小代表凋亡细胞数的多少。
1.7 Western blot法检测Hsp90的表达 细胞按实验分组给以不同的处理因素,离心收集。预冷的PBS洗涤两次,加入裂解缓冲液,4℃静置30 min。12 000×g离心10 min,取上清,采用BCA法进行蛋白定量。总蛋白经SDS-PAGE分离后,转移至PVDF膜上。用5%脱脂奶粉封闭1.5 h。随后加入Hsp90抗体(1∶1 000),4℃孵育过夜,TBST洗3次,加入相应的二抗,孵育1 h,漂洗3次。将PVDF膜用发光试剂ECL显色后,用Image J 1.41o进行灰度分析,每样本重复3次。
1.8 统计学处理 实验数据经SPSS 11.0统计软件进行统计分析,数据用¯±s表示,统计方法采用单因素方差分析。
2 结果
2.1 H2S减弱CoCl2诱导的细胞毒性作用 本文在预实验时证实600 μmol·L-1CoCl2能明显地损伤 PC12 细胞,因此,本研究中应用 600 μmol·L-1CoCl2作为CoCl2的有效损伤浓度。Fig 1显示,600 μmol·L-1CoCl2作用 PC12 细胞 24 h,对细胞具有明显的细胞毒性作用,使细胞存活率降低至(54.13±4.49)%,与对照组比较,差异具有统计学意义(P<0.01)。400 μmol·L-1NaHS 预处理 3 h 能对抗CoCl2的细胞毒性作用,使细胞存活率从(54.13±4.49)%提高至(79.42±3.29)%(P<0.01)。

Fig 1 Effects of different treatments on viability of PC12 cells(n=5)
2.2 H2S抑制CoCl2诱导的细胞凋亡作用 Fig 2的Hoechst 33258染色荧光显微镜照相术检测的结果显示,正常的PC12细胞呈现为散在的低强度荧光(Fig 2A)。凋亡细胞核则呈浓染致密的固缩状态或颗粒状荧光。600 μmol·L-1CoCl2作用 PC12细胞48 h,使凋亡细胞的数目明显增多(Fig 2C)。400 μmol·L-1NaHS本身不引起细胞凋亡(Fig 2B),但能保护PC12细胞对抗CoCl2的致凋亡作用,使凋亡细胞数量减少(Fig 2D)。与上述实验结果相似,流式细胞检测的结果(Fig 3)显示,正常时,PC12细胞的凋亡数量很低,CoCl2却使细胞凋亡率增加至(38.8 ±1.27)%;400 μmol·L-1NaHS 预处理能使CoCl2诱导的细胞凋亡率降低至(15.1±0.47)%(P<0.01)。

Fig 2 Morphological changes in apoptotic cells of differentgroups assessed by Hoechst 33258 staining
2.3 H2S预处理上调Hsp90的表达 给予PC12细胞 NaHS 预处理,观察预处理后1、3、6、9、12 及 24 h Hsp90的表达情况。Western blot的检测结果显示,400 μmol·L-1NaHS预处理1 h ,可使 PC12 细胞Hsp90表达开始升高;在预处理3 h,Hsp90表达达到高峰,与对照组比较,差异有统计学意义(P<0.01,Fig 4);随后,Hsp90的表达水平下降,作用24 h后,Hsp90表达恢复到对照水平,提示H2S预处理对Hsp90表达具有促进作用。

Fig 3 Effects of different treatments on apoptosis of PC12 cells(n=3)
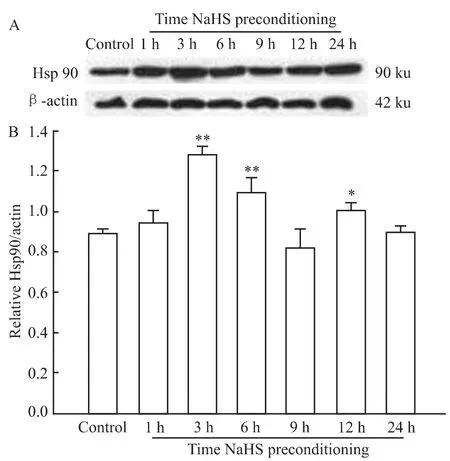
Fig 4 Effects of H2S preconditioning onexpression of Hsp90 in different time(n=3)
值得注意的是 Fig 5显示,CoCl2(600 μmol·L-1)也能上调Hsp90的表达,而且,H2S预处理能进一步增强CoCl2对PC12细胞Hsp90表达的上调作用,提示 H2S的细胞保护作用可能与其上调Hsp90有关。

Fig 5 17-AAG on Hsp90 expression(n=3)
2.4 Hsp90介导H2S抗CoCl2诱导的细胞损伤作用 为了探讨Hsp90在H2S诱导的细胞保护中的作用,本文在NaHS预处理前30 min使用Hsp90抑制剂17-AAG(2 μmol·L-1),观察对 Hsp90 表达及NaHS预处理诱导的细胞保护作用的影响。
Fig 5的Western blot结果显示,17-AAG可明显抑制H2S诱导的Hsp90表达增高。同时,17-AAG可明显拮抗H2S的细胞保护作用:在NaHS预处理前30 min加入2 μmol·L-117-AAG 后可使细胞存活率下降到(55.74±6.47)%(与H2S保护组相比,P<0.01,Fig 1);使细胞凋亡率再次回升到(34.5±0.48)%(与 H2S保护组相比,P<0.01,Fig 3);Hoechst 33258核染色形态学结果亦显示,17-AAG增加了细胞凋亡,减弱了H2S的细胞保护作用(Fig 2)。
上述结果提示Hsp90介导了H2S抗CoCl2诱导的细胞损伤作用。
3 讨论
最近,本实验室证实,H2S预处理能对抗化学性缺氧引起的心肌损伤[10]。本文再次证实,H2S预处理能保护具有神经元的形态和功能特征的PC12细胞对抗CoCl2引起的损伤作用。表明在不同的细胞模型,在体实验或离体实验,H2S均具有抗缺氧/缺血的细胞保护作用,这与曾因明课题组近期的研究结果相一致[11,12]。
新近研究表明,H2S能抑制缺血/再灌注引起的肝损伤,并增加Hsp90和抗凋亡蛋白Bcl-2的表达,提示H2S可通过上调Hsp90表达来保护肝细胞对抗缺血/再灌注损伤[13]。Hsp90是一种重要的细胞保护蛋白,可对抗包括缺氧/缺血等各种致死性的因素引起的细胞损伤[14]。研究表明,在心肌缺血区Hsp90高表达可保护心肌免受缺血/再灌注损伤;同时,过表达Hsp90也可抗心肌缺氧损伤[15]。
然而,Hsp90是否介导H2S抗化学性缺氧损伤的神经保护作用,至今未见报道。为了揭示两者的关系,本实验观察了400 μmol·L-1H2S供体NaHS作用PC12细胞不同时间对Hsp90表达的影响。本文发现,H2S预处理对PC12细胞Hsp90表达有明显的上调作用。表明H2S是一种有效激活保护性蛋白Hsp90的物质,这与 Jha等[13]的研究结果相一致。
为了进一步揭示Hsp90在H2S保护PC12细胞抗化学性缺氧损伤中的作用,本研究在NaHS预处理前30 min使用Hsp90抑制剂17-AAG。实验结果表明,Hsp90抑制剂17-AAG在抑制Hsp90表达的同时,能明显地阻断H2S的细胞保护作用,使PC12细胞存活率降低及凋亡率增加,提示Hsp90介导H2S诱导的神经保护作用,本实验为深入阐明H2S的神经细胞保护作用机制提供了新颖的实验依据。
[1] 蔡文杰,琚立华,朱依纯.硫化氢的治疗性应用研究进展[J].中国药理学通报,2009,25(7):854 -6.
[1] Cai W J,Ju L H,Zhu Y C.Research progress on hydrogen sulfide′s potential therapeutic use[J].Chin Pharmacol Bull,2009,25(7):854-6.
[2] Kimura Y,Kimura H.Hydrogen sulfide protects neurons from oxidative stress[J].Faseb J,2004,18(10):1165 - 7.
[3] Hu L F,Lu M,Wu Z Y,et al.Hydrogen sulfide inhibits rotenoneinduced apoptosis via preservation of mitochondrial function[J].Mol Pharmacol,2009,75(1):27 -34.
[4] Tang X Q,Yang C T,Chen J,et al.Effect of hydrogen sulphide on beta-amyloid-induced damage in PC12 cells[J].Clin Exp Pharmacol Physiol,2008,35(2):180 -6.
[5] Blackstone E,Morrison M,Roth M B.H2S induces a suspended animation-like state in mice[J].Science,2005,308(5721):518.
[6] Blackstone E,Roth M B.Suspended animation like state protects mice from lethal hypoxia[J].Shock,2007,27(4):370 -2.
[7] Terasawa K,Minami M,Minami Y.Constantly updated knowledge of Hsp90[J].J Biochem,2005,137(4):443 -7.
[8] Chen J X,Meyrick B.Hypoxia increases Hsp90 binding to eNOS via PI3K-Akt in porcine coronary artery endothelium[J].Lab Invest,2004,84(2):182 -90.
[9] Jiao J D,Garg V,Yang B,Hu K.Novel functional role of heat shock protein 90 in ATP-sensitive K+channel-mediated hypoxic preconditioning[J].Cardiovasc Res,2008,77(1):126 - 33.
[10]廖新学,杨春涛,杨战利,等.硫化氢对抗化学性缺氧引起的心肌细胞损伤及其机制[J].中国药理学通报,2009,25(8):1012-7.
[10]Liao X X,Yang C T,Yang Z L,et al.Hydrogen sulfide protects H9C2 cells against chemical hypoxia-induced injury and the underlying mechanisms[J].Chin Pharmacol Bull,2009,25(8):1012 -7.
[11]徐 钢,季 永,汪 莉,等.内源性硫化氢参与缺血后处理减轻离体大鼠心脏缺血/再灌注损伤[J].中国药理学通报,2008,24(7):910 -4.
[11]Xu G,Ji Y,Wang L,et al.Endogenous hydrogen sulfide participating in the ischemic postconditioning against cardiac ischemia/reperfusion injury[J].Chin Pharmacol Bull,2008,24(7):910 -4.
[12]汪 莉,徐 钢,季 永,等.硫氢化钠后处理对缺氧/复氧心肌细胞线粒体渗透性转换的影响[J].中国药理学通报,2008,24(12):1610 -4.
[12]Wang L,Xu G,Ji Y,et al.The effect of NaHS postconditioning on mitochondrial permeable transition during hypoxia/reoxygenation in cultured rat myocardial cells[J].Chin Pharmacol Bull,2008,24(12):1610-4.
[13]Jha S,Calvert J W,Duranski M R,et al.Hydrogen sulfide attenuates hepatic ischemia/reperfusion injury:role of antioxidant and antiapoptotic signaling[J].Am J Physiol Heart Circ Physiol,2008,295(2):H801-6.
[14]马 波,张建军,刘耕陶.热休克蛋白与神经保护[J].中国药理学通报,2008,24(8):984 -7.
[14]Ma B,Zhang J J,Liu G T.Hsp70 and neuroprotection[J].Chin Pharmacol Bull,2008,24(8):984 - 7.
[15]Brar B K,Railson J,Stephanou A,et al.Urocortin increases the expression of heat shock protein 90 in rat cardiac myocytes in a MEK1/2-dependent manner[J].J Endocrinol,2002,172(2):283-93.
