帕金森病模型大鼠中脑α-突触核蛋白增加
2010-12-08孙建栋苑玉和王晓锋陈乃宏
孙建栋,苑玉和,刘 岩,王晓锋,陈乃宏
帕金森病(Parkinson's disease,PD)是一种常见的神经退行性疾病,主要临床症状是震颤、运动迟缓和强直,典型的神经病理学特征是中脑黑质多巴胺能神经元进行性变性缺失,残存神经元内出现路易体(lewy bodies,LBs),而 α-突触核蛋白(α-synuclein,α-SYN)是 LBs的主要成分[1]。
PD的发病机制尚不明确。目前普遍认为PD是由于环境因素与遗传因素共同作用所致,而对大多数散在的PD患者来说,环境因素作为其发病的危险因素可能比遗传因素更重要些。流行病学调查显示,长期接触鱼藤酮(rotenone,R)会增加患PD的危险性。长期暴露于小剂量鱼藤酮的Lewis大鼠表现出PD的病理特征,出现类似LBs的包涵体结构[2]。本实验旨在用鱼藤酮制备PD大鼠模型,观察其中脑神经元α-SYN的变化,为探讨PD的发病机制奠定理论基础。
1 材料
成年♂SD大鼠30只,体重300~400 g(北京维通利华实验动物技术有限公司);鱼藤酮、DMSO(Sigma公司);橄榄油(山东鲁花集团有限公司);anti-α-SYN、anti-TH、anti-β-actin(Santa Cruz公司),HRP标记的二抗、FITC标记的二抗(中杉进口试剂分装);免疫组化试剂盒(中杉金桥生物技术有限公司)。
2 方法
2.1 PD模型制备 大鼠随机分为对照组(8只)和鱼藤酮实验组(22只)。两组均采用背部皮下注射的方式。首先将鱼藤酮溶于极低体积的DMSO,然后溶于橄榄油中,实验组大鼠按1.0 mg·kg-1·d-1的剂量持续注射鱼藤酮。对照组注射相同体积的橄榄油(含相应体积的DMSO)。持续注射42 d。
2.2 行为学观察 持续背部皮下注射42 d后,采用旷场实验评价动物行为学改变。将大鼠置于开阔箱的正中格内,观察大鼠5 min的活动情况。测定指标包括:① 正中央格停留时间(latency time);②方格间穿行次数(3只爪以上跨入邻格的次数,crossing);③竖起或修饰次数(两前肢离地1 cm以上的次数,rearing/modification);④竖起或修饰时间(两前肢离地1 cm以上的时间,rearing/modification time)。观察大鼠有无少动、活动迟缓、步态不稳、震颤等异常行为。
2.3 免疫荧光检测鱼藤酮对TH表达的影响 行为检测后,用10%水合氯醛对大鼠进行深度麻醉,直视下将穿刺针经左心室刺入升主动脉,先灌注0.9%生理盐水快速冲洗至肝脏发白,再用4%多聚甲醛固定至大鼠颈硬尾翘、全身强直时,断头取脑,浸泡于4%多聚甲醛,4℃过夜。进一步处理制作石蜡切片,切片厚3 μm。脱蜡、水化、抗原修复、灭活内源过氧化物酶,10%封闭血清室温封闭10~15 min,加入兔抗TH 4℃过夜,PBS-Tween洗3次后加FITC标记的二抗,37℃孵育2 h,PBS-Tween洗4次,封片后在荧光正置显微镜下进行观察。
2.4 免疫组织化学检测鱼藤酮对α-SYN表达的影响 切片同免疫荧光(见上)。脱蜡、水化、抗原修复、灭活内源过氧化物酶,10%血清室温封闭10~15 min,加入单克隆鼠抗α-SYN 4℃过夜,之后按免疫组化试剂盒说明书进行操作。DAB显色5~10 min,最后脱水、透明、封片。
2.5 Western blot检测蛋白表达 行为检测后,直接断头取脑,分区后冻于-70℃冰箱。称取一定量的中脑组织(含黑质),加入10倍体积的组织裂解液(1%NP-40,150 mmol·L-1NaCl,50 mmol·L-1Tris,2 mmon·L-1EDTA ,0.1%SDS,0.5%Sodium deoxycholate,pH 7.4,and with protease inhibitors)匀浆,冰浴 30 min 后,4℃ 12 000 r·min-1离心 30 min。取上清,BCA试剂盒蛋白定量,组织总蛋白加入上样缓冲液煮沸变性。30 μg蛋白经15%SDSPAGE胶分离后转移到 PVDF膜(Millipore),3%BSA室温封闭2 h,加入一抗4℃过夜,TBS-Tween洗膜后加HRP标记的二抗,室温孵育2 h,加入ECL发光液,经ECL检测系统检测。
3 结果
3.1 行为学观察 注射鱼藤酮1 wk之内即有大鼠出现PD的典型表现,如运动障碍、进食困难等症状,并且随着时间的延长,出现此类症状的动物数目增多,症状加重,如部分动物出现震颤、旋转等行为;但也有部分动物PD的行为学特征尚未形成,却已死于鱼藤酮中毒,而对照组大鼠均处于健康状态。
持续背部皮下注射42 d后,与对照组相比,鱼藤酮实验组动物的正中格停留时间明显延长,方格穿行次数、竖起时间和次数明显减少(Tab 1)。
Tab 1 Effects of rotenone on behaviors in the open field test of rats(¯±s,n=6)

Tab 1 Effects of rotenone on behaviors in the open field test of rats(¯±s,n=6)
*P<0.05,**P<0.01 vs control group
Group Latency time/s Crossing/frequency Rearing/frequency Rearing time/s Control 10.3±6.2 36.9±19.5 50.0±29.7 20.1±7.8 Rotenone 18.0±4.8*10.0±5.9* 4.5±3.1** 3.3±2.2**
3.2 大鼠中脑部位TH表达的变化 持续背部皮下注射42 d后,鱼藤酮实验组大鼠免疫荧光染色可见中脑部位TH阳性神经元胞体缩小,神经纤维稀疏。TH阳性神经元数较对照组明显减少,约减少了70%(P<0.05),而且TH阳性神经元荧光强度明显减弱。而对照组中脑部位TH阳性神经元密集,呈带状分布,胞体大,突起明显,荧光强(Fig 1)。

Fig 1 TH-positive neurons in the midbrain measured withimmunofluorescence staining after rotenone treatment(¯±s,n=3)
3.3 大鼠中脑部位α-SYN表达的变化 持续背部皮下注射42 d后,鱼藤酮实验组动物中脑部位α-SYN免疫反应阳性强度增加,表达明显升高,但是没有观察到包涵体样结构的存在,α-SYN阳性细胞数较对照组明显增加(Fig 2B)。而对照组动物的中脑部位α-SYN仅有较弱的免疫阳性反应(Fig 2A)。Western blot实验显示,鱼藤酮实验组动物中脑部位α-SYN的蛋白表达水平明显增加(P<0.05),见Fig 3。
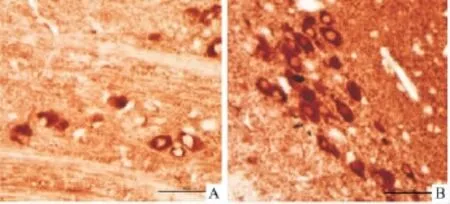
Fig 2 α-SYN protein level in the midbrain demonstratedwith immunohistochemical staining after rotenone treatment

Fig 3 α-SYN protein level in the midbrain determinedusing Western blot after rotenone treatment(¯±s,n=3)
4 讨论
近年来,鱼藤酮大鼠模型受到国内外学者的广泛关注,与6-OHDA和MPTP模型相比,鱼藤酮诱导的模型更接近人类PD症状。鱼藤酮具有极强的亲脂性,在不依赖DA转运体的情况下自由通过血脑屏障和细胞膜并聚集在细胞器如线粒体内,可选择性抑制线粒体复合物Ⅰ的活性[3],产生活性氧和释放凋亡诱导因子,引起氧化应激和细胞凋亡[4]。
关于鱼藤酮的PD动物模型研究,较早的报道是1997年Ferrante等[5]采用静脉灌注鱼藤酮(10~18 mg·kg-1·d-1)的方法持续给药 10 d,发现动物出现明显的运动障碍和僵住症。Betarbet等[2]通过大鼠咽喉静脉插管与皮下微渗透泵连接,静脉灌注鱼藤酮。上述两种给药方法的缺点是手术时间长、风险高、模型成功率低(约48%)、动物死亡率高(约26%)。后来Sherer等[6]将该法改进,采用直接微渗透泵皮下埋植给药,但此实验方法需要昂贵的微渗透泵,限制了该动物模型的推广。结合上述几种给药方法,本文采用背部皮下长期低剂量注射鱼藤酮的方法建立PD大鼠模型。行为学观察显示,鱼藤酮实验组动物表现出运动减少、活动迟缓、步态不稳、震颤等PD经典行为学变化;旷场实验结果显示,动物5 min正中央格停留时间、方格间穿行次数、竖起时间和次数明显改变;免疫荧光染色结果显示,TH阳性神经元明显减少。以上结果表明,该方法是一种有效的大鼠PD模型制作方法,与上述几种方法比较,背部皮下注射方法简便易行、无需特殊器械。本模型的建立为今后研究PD的发病机制和相关药物药效学的评价提供了崭新的平台。
α-SYN是富含于中枢神经系统的蛋白[7],在家族性PD患者中发现该基因A53T和A30P突变,而且由于该蛋白是PD标志性病理改变LBs的主要组成部分,因此提示α-SYN与PD的发生关系密切。
α-SYN在PD的发病机制中起着重要的作用。有人认为α-SYN在细胞内积聚可能是PD发病的重要因素[8,9];过表达的 α-SYN 可能通过细胞内 ROS产生氧化应激损伤多巴胺能神经元[10];α-SYN异常也可引起突触囊泡功能障碍进而参与PD复杂的病理过程[11]。而且体外和体内研究的结果都表明高水平的α-SYN可诱导多巴胺能神经细胞的退变和死亡[12~15]。本实验通过免疫组化和 Western blot的方法,发现实验组动物注射鱼藤酮后,中脑部位α-SYN蛋白水平增加。然而,我们的实验中未发现α-SYN的聚集现象,即未发现路易小体的形成。作者认为这可能与动物种属和模型制备方式的不同有关。有关α-SYN过度表达和聚集引起的病理生理意义目前尚有争议,但无论是否发生α-SYN的聚集现象,α-SYN蛋白水平增加都具有重要意义。
综上所述,鱼藤酮能够使SD大鼠出现运动障碍,中脑部位TH阳性神经元数目减少,即出现PD症状,该现象可能与大鼠中脑部位α-SYN蛋白水平增加有关。
[1] Spillantini M G,Schmidt M L,Lee V M,et al.Alpha-synuclein in Lewy bodies[J].Nature,1997,388(6645):839 -40.
[2] Betarbet R,Sherer T B,MacKenzie G,et al.Chronic systemic pesticide exposure reproduces features of Parkinson′s disease[J].Nat Neurosci,2000,3(12):1301 -6.
[3] Hollingworth R M,Ahammadsahib K I,Gadelhak G,McLaughlin J L.New inhibitors of complex I of the mitochondrial electron transport chain with activity as pesticides[J].Biochem Soc Trans,1994,22(1):230 -3.
[4] Li N,Ragheb K,Lawler G,et al.Mitochondrial complex I inhibitor rotenone induces apoptosis through enhancing mitochondrial reactive oxygen species production[J].J Biol Chem,2003,278(10):8516-25.
[5] Ferrante R J,Schulz J B,Kowall N W,Beal M F.Systemic administration of rotenone produces selective damage in the striatum and globus pallidus,but not in the substantia nigra[J].Brain Res,1997,753(1):157 -62.
[6] Sherer T B,Betarbet R,Testa C M,et al.Mechanism of toxicity in rotenone models of Parkinson′s disease[J].J Neurosci,2003,23(34):10756-64.
[7] Claton D J,George J M.Synucleins in synaptic plasticity and neurodegenerative disorders[J].J Neurosci Res,1999,58:120 - 9.
[8] Xu J,Kao S Y,Lee F J,et al.Dopamine-dependent neurotoxicity of alpha-synuclein:a mechanism for selective neurodegeneration in Parkinson disease[J].Nat Med,2002,8(6):600 -6.
[9] 朱国旗,程月发,王 梅,等.蛋白降解途径在帕金森病发病中的作用[J].中国药理学通报,2008,24(12):1561 -4.
[9] Zhu G Q,Cheng Y F,Wang M,et al.The relation between protein degradation pathways and parkinson′s disease[J].Chin Pharmacol Bull,2008,24(12):1561 -4.
[10]Sayre L M,Smith M A,Perry G.Chemistry and biochemistry of oxidative stress in neurodegenerative disease[J].Curr Med Chem,2001,8(7):721 -38.
[11]Sherer T B,Kim J H,Betarbet R,Greenamyre J T.Subcutaneous rotenone exposure causes highly selective dopaminergic degeneration and alpha-synuclein aggregation[J].Exp Neurol,2003,179(1):9-16.
[12]Junn E,Mouradian M M.Human alpha-synuclein over-expression increases intracellular reactive oxygen species levels and susceptibility to dopamine[J].Neurosci Lett,2002,320(3):146 -50.
[13]Kirik D,Rosenblad C,Burger C,et al.Parkinson-like neurodegeneration induced by targeted overexpression of alpha-synuclein in the nigrostriatal system[J].J Neurosci,2002,22(7):2780 -91.
[14] Masliah E,Rockenstein E,Veinbergs I,et al.Dopaminergic loss and inclusion body formation in alpha-synuclein mice:implications for neurodegenerative disorders[J].Science,2000,287(5456):1265-9.
[15]Theodore S,Cao S,McLean P J,Standaert D G.Targeted overexpression of human alpha-synuclein triggers microglial activation and an adaptive immune response in a mouse model of Parkinson disease[J].J Neuropathol Exp Neurol,2008,67(12):1149 -58.
