黄芪注射液抑制缺氧缺糖/复氧复糖大鼠海马神经元JNK3的表达
2010-12-08叶冬青高维娟闫凤霞张雅丽侯志平
叶冬青,高维娟,钱 涛,闫凤霞,张雅丽,侯志平
随着现代医学的发展,人口老龄化进程加快,缺血性脑血管病的发病率逐年升高,而缺血/再灌注损伤(ischemia-reperfusion injury,IRI)是缺血性脑血管病发病的重要病理生理过程。大脑是对缺血缺氧十分敏感的组织,而海马则是中枢神经系统中对缺氧耐受相对较差的部位,故脑海马神经元常被用来作为缺血缺氧损伤研究的模型[1]。在缺血性脑血管疾病的发生发展过程中,细胞凋亡是神经元损伤的发生机制之一,其中凋亡相关基因c-Jun氨基末端激酶3(c-Jun N terminal kinase 3,JNK3)的表达与神经元凋亡关系十分密切[2]。黄芪注射液为临床治疗缺血性脑血管病的常用药物,可抑制细胞凋亡的发生[3]。本课题组前期实验证实,黄芪注射液可抑制全脑缺血/再灌注大鼠海马神经元凋亡,并且对离体培养的缺氧缺糖/复氧复糖大鼠海马神经元凋亡有抑制作用,但是通过哪条信号传导通路发挥抑制凋亡作用目前尚不清楚。本研究通过观察黄芪注射液对缺氧缺糖/复氧复糖大鼠海马神经元凋亡相关蛋白JNK3及其mRNA表达的影响,探讨黄芪注射液抑制细胞凋亡的分子机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 SD大鼠,新生(1~2)d,♀♂兼有,二级动物,由河北省实验动物中心提供,合格证号:冀医动字第702003号。
1.1.2 试剂和仪器 兔抗磷酸化JNK3多克隆抗体购于美国Ebioscience公司;BCA蛋白定量试剂盒购于上海申能博彩生物公司;JNK3 RT-PCR引物是由上海生物工程有限公司设计,RT-PCR试剂盒购自大连宝生物公司;多聚赖氨酸、阿糖胞苷购自美国Sigma公司;胎牛血清、马血清由Hyclone公司生产;谷氨酰胺、胰蛋白酶购自华美生物工程公司;DMEM/F12培养基、B27由美国Gibco公司生产;NSE免疫组化染色试剂盒购自北京中杉金桥公司;黄芪注射液由成都地奥九泓制药厂生产;其他试剂为国产分析纯。主要仪器:HERA cell 150型CO2培养箱由德国Heraeus公司生产;LEICA DMIL 090-135.001型倒置显微镜由德国Wetzlar GmbH公司生产;TDL-40B离心机由上海安亭科学仪器制造厂生产;DYY-6B型稳压稳流电泳仪购自北京六一仪器厂;MK3型酶标仪购自上海雷勃公司。
1.2 方法
1.2.1 海马神经细胞的分离、培养及鉴定 培养方法参照Brewer的方法并做少许改良[4]。取新生24 h内的SD大鼠海马组织,6.25 mmol·L-1的胰蛋白酶消化,马血清终止消化后将组织块混合液移入离心管,加 D-Hanks液1 000 r·min-1离心 5 min,去上清后加DMEM/F12溶液7 ml,吹打离散组织,制成细胞悬液,以200目滤网过滤。取细胞悬液在100倍倒置显微镜下计数,以5×108·L-1密度接种在含有种植培养液(DMEM/F12培养基添加0.012 mol·L-1胎牛血清,0.014 mol·L-1马血清,0.1 g·L-1谷氨酰胺,0.1 U·L-1青霉素和 0.1 g·L-1链霉素)的培养皿或培养瓶中。d 2用无血清培养液(DMEM/F12添加0.02 mol·L-1B27)代替种植液。d 4换液时添加0.005 g·L-1阿糖胞苷以抑制胶质细胞生长,24 h后替换成新鲜无血清培养液。培养8 d后用NSE免疫组化染色法进行神经元纯度鉴定。
1.2.2 缺氧缺糖/复氧复糖细胞模型的建立与实验分组 把原代培养8 d的大鼠海马神经元随机分为4组:正常对照组、缺氧缺糖/复氧复糖组(模型组)、黄芪注射液组和黄芪溶剂对照组。除正常对照组外均参照 Bossenmeyer等[5]的方法建立缺氧缺糖/复氧复糖细胞模型:取培养8 d的海马神经元用无糖Earle′s代替培养液,随即把培养皿(瓶)置于37℃温箱中的缺氧装置里,快速通入高纯氮气1 min,再使气体匀速缓慢连续排出。缺氧缺糖30 min后,换正常无血清培养液继续在37℃,5%CO2培养箱内培养。正常对照组正常培养,不进行任何处理;黄芪注射液组于缺氧缺糖时加入黄芪注射液[0.5 g(生药)·L-1][6],直至培养结束;黄芪溶剂对照组处理方法与黄芪注射液组相同,只是将黄芪注射液换为pH值7.4的等量黄芪溶剂即无菌去离子水。
各组在复氧复糖后 0、0.5、2、6、24、72 和 120 h观察JNK3蛋白及其mRNA的表达。
1.2.3 蛋白免疫印迹法检测细胞内JNK3的表达收集细胞,提取胞质蛋白,用BCA法进行蛋白定量。取40 μg样品,加入蛋白体积1/4的 loading Buffer缓冲液混匀,在100℃沸水中煮7 min,以12%SDS聚丙烯酰胺凝胶电泳分离,分离的蛋白用半干电转移法转移到PVDF膜上,4℃封闭过夜后加入用封闭液稀释的兔抗磷酸化JNK3多克隆抗体(1∶200稀释)室温放置2 h。洗膜液洗3×10 min,用生物素标记的二抗(1∶14 000稀释)孵育1 h,洗膜液洗后用化学发光法显色,X射线底片曝光。以β-actin为内参照。实验重复6次,目的条带为54 ku。用Quantity one软件对各时间点蛋白条带平均光密度值进行分析。
1.2.4 酶联免疫法检测缺氧缺糖/复氧复糖海马神经元JNK3的活性 收集细胞,用细胞裂解液裂解、震荡,用1 000×g离心20 min后取上清液,用样品稀释液将标准品稀释,各浓度标准品均以100 μl加入孔中。空白孔加入100 μl样品稀释液。将酶标板放入37℃温箱中反应120 min。反应后弃去液体加入检测溶液A 工作液100 μl,37℃,60 min温育后弃去液体,洗板3×2 min,甩干后加入检测溶液B工作液100 μl,37℃,60 min。甩干后洗板5 ×2 min。甩干后依序加入底物溶液90 μl,37℃避光显色25 min,终止显色后用酶联仪在450 nm波长测量各加样孔OD值,实验重复6次。
1.2.5 RT-PCR检测细胞内JNK3 mRNA的表达收集细胞,用TRIzol一步法提取RNA,按ExscriptTMRT reagent kit说明逆转录为cDNA。JNK3 cDNA引物序列上游 5′-CCACGCAGATCAAACAGGA-3′,下游5′-GCCAACCGCTCAGCATAA-3′,扩增片段长度为821 bp;内参照 β-actin引物序列上游 5′-GGACTTCGAGCAAGAGATGG-3′,下 游 5′-ACATCTGCTGGAAGGTGGAC-3′,扩增片段长度为509 bp。按照PCR Amplification kit说明进行反应,扩增条件:95℃预变性3 min;94℃ 40 s;54℃ 40 s;72℃ 40 s,循环30次;最后于72℃延伸3 min。用1.5%琼脂糖凝胶电泳鉴定PCR产物,实验重复6次。用凝胶分析软件Quantity one进行定量分析,目的条带在800 bp。
Tab 1 The effect of astragalus injection on the ratio of mean optic density(MOD)of expression of JNK3 protein and β-actin after hypoxia/hypoglycemia and reoxygenation in hippocampal neurons of rats(±s,n=6)

Tab 1 The effect of astragalus injection on the ratio of mean optic density(MOD)of expression of JNK3 protein and β-actin after hypoxia/hypoglycemia and reoxygenation in hippocampal neurons of rats(±s,n=6)
Normal:Normal control group;Original:Original astragalus injection group;Model:Hypoxia/hypoglycemia and reoxygenation group;Astragalus:Astragalus injection group.*P<0.05 vs normal;#P<0.05 vs model and original
Group The time of hypoxia/hypoglycemia and reoxyge nation 0 h 0.5 h 2 h 6 h 24 h 72 h 120 h Normal 0.448±0.06 0.448±0.06 0.448±0.06 0.448±0.06 0.448±0.06 0.448±0.06 0.448±0.06 Original 0.538±0.07* 0.637±0.05* 0.709±0.05* 0.758±0.09* 0.627±0.09* 0.531±0.06* 0.389±0.11*Model 0.542±0.06* 0.639±0.04* 0.705±0.07* 0.765±0.06* 0.631±0.05* 0.536±0.08* 0.384±0.07*Astragalus 0.442±0.05# 0.526±0.04# 0.59±0.05# 0.658±0.04# 0.561±0.06# 0.478±0.03#0.386±0.03
Tab 2 The effect of astragalus injection on OD value of the activity of JNK3 protein after hypoxia/hypoglycemia and reoxygenation in hippocampal neurons of rats ± s,n=6)
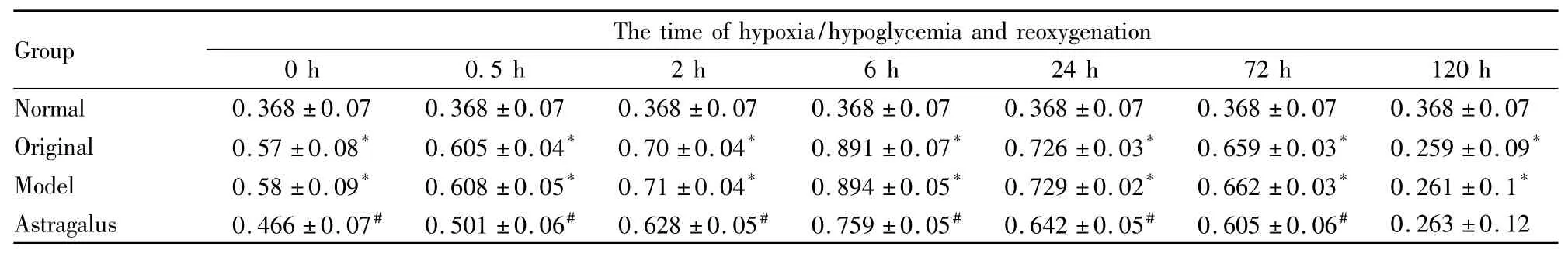
Tab 2 The effect of astragalus injection on OD value of the activity of JNK3 protein after hypoxia/hypoglycemia and reoxygenation in hippocampal neurons of rats ± s,n=6)
Note see Tab 1.*P<0.05 vs normal;#P<0.05 vs model and original
Group The time of hypoxia/hypoglycemia and reoxyge nation 0 h 0.5 h 2 h 6 h 24 h 72 h 120 h Normal 0.368±0.07 0.368±0.07 0.368±0.07 0.368±0.07 0.368±0.07 0.368±0.07 0.368±0.07 Original 0.57±0.08* 0.605±0.04* 0.70±0.04* 0.891±0.07* 0.726±0.03* 0.659±0.03* 0.259±0.09*Model 0.58±0.09* 0.608±0.05* 0.71±0.04* 0.894±0.05* 0.729±0.02* 0.662±0.03* 0.261±0.1*Astragalus 0.466±0.07# 0.501±0.06# 0.628±0.05# 0.759±0.05# 0.642±0.05# 0.605±0.06#0.263±0.12
2 结果
2.1 海马神经元原代培养形态和纯度 NSE免疫组化染色结果显示:无血清培养8 d的海马神经元胞体饱满,突起明显、突起末端分支形成神经网络,相互支持生长,神经胶质细胞少见,3个400倍视野中阳性神经细胞的数目为68个,纯度为(91.48±0.72)%,见 Fig 1。
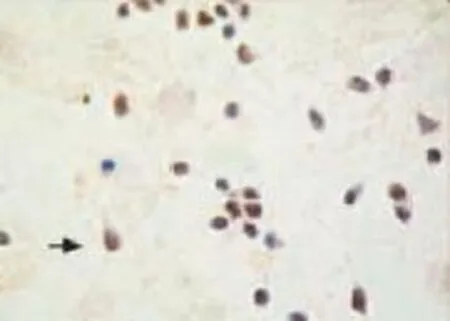
Fig 1 Hippocampal neurons stained with NSE(×400)
2.2 黄芪注射液对缺氧缺糖/复氧复糖大鼠海马神经元JNK3蛋白表达的影响 Western blot实验结果显示:与正常对照组相比,模型组在复氧复糖后0、0.5、2、6、24 和 72 h 海马神经元 JNK3 蛋白条带平均光密度值均增加(P<0.05),复氧复糖120 h JNK3蛋白条带平均光密度值降低(P<0.05)。与模型组相比,黄芪注射液组除复氧复糖120 h外各时间段JNK3蛋白条带平均光密度均降低(P<0.05),而黄芪溶剂对照组则差异无显著性(P>0.05),见 Tab 1,Fig 2。

Fig 2 The effect of astragalus injection on expressionof JNK3 protein after hypoxia/hypoglycemia and
2.3 黄芪注射液对缺糖缺氧/复糖复氧大鼠海马神经元JNK3活性的影响 ELISA实验结果显示:与正常对照组相比,模型组在复氧复糖后0、0.5、2、6、24和72 h海马神经元JNK3蛋白浓度及其活性OD值均增加(P<0.05),复氧复糖120 h JNK3蛋白浓度及其活性OD值降低(P<0.05)。与模型组相比,黄芪注射液组除复氧复糖120 h外各时间段JNK3蛋白浓度及其活性OD值均降低(P<0.05),而黄芪溶剂对照组则差异无显著性(P>0.05)。见Tab 2、3。
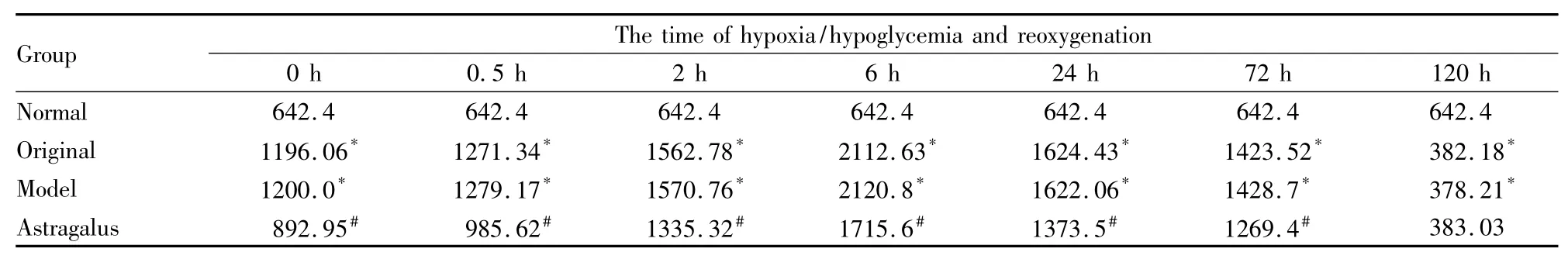
Tab 3 The effect of astragalus injection on the concentration of JNK3 protein after hypoxia/hypoglycemia andreoxygenation in hippocampal neurons of rats(mg·L -1,n=6)
Tab 4 The effect of astragalus injection on the ratio of mean optic density(MOD)of expression of JNK3 mRNA and β-actin after hypoxia/hypoglycemia and reoxygenation in hippocampal neurons of rats(¯±s,n=6)

Tab 4 The effect of astragalus injection on the ratio of mean optic density(MOD)of expression of JNK3 mRNA and β-actin after hypoxia/hypoglycemia and reoxygenation in hippocampal neurons of rats(¯±s,n=6)
Note see Tab 1.*P<0.05 vs normal;#P<0.05 vs model and original
Group The time of hypoxia/hypoglycemia and reoxyge nation 0 h 0.5 h 2 h 6 h 24 h 72 h 120 h Normal 0.468±0.04 0.468±0.04 0.468±0.04 0.468±0.04 0.468±0.04 0.468±0.04 0.468±0.04 Original 0.578±0.07* 0.637±0.06* 0.712±0.05* 0.759±0.07* 0.631±0.08* 0.603±0.12* 0.542±0.11*Model 0.586±0.06* 0.642±0.05* 0.702±0.06* 0.767±0.07* 0.638±0.07* 0.596±0.09* 0.539±0.11*Astragalus 0.452±0.05# 0.534±0.03# 0.62±0.03# 0.662±0.05# 0.567±0.07# 0.554±0.07#0.538±0.09
2.4 黄芪注射液对缺氧缺糖/复氧复糖大鼠海马神经元JNK3 mRNA表达的影响 RT-PCR结果显示:与正常对照组相比,模型组大鼠在复氧复糖后0、0.5、2、6、24、72 和 120 h 海马神经元 JNK3 mRNA条带密度均有所增强,其平均光密度值均明显增加(P<0.05);与模型组相比,黄芪注射液组除复氧复糖120 h外各时间段JNK3 mRNA条带平均光密度均降低(P<0.05),而黄芪溶剂对照组则差异无显著性(P>0.05),见 Tab 4,Fig 3。
3 讨论

Fig 3 The effect of astragalus injection on expression of JNK3mRNA after hypoxia/hypoglycemia and reoxygenation in hippocampal neurons of rats.RT-PCR of JNK3 mRNA
脑血管疾病是临床常见病,其中缺血性脑血管病占绝大部分[7]。脑缺血后的再灌注损伤是缺血性脑血管病发病的重要病理生理环节,主要通过诱导细胞凋亡导致神经元死亡[7]。缺氧缺糖/复氧复糖所致的神经细胞损伤是脑缺血/再灌注损伤主要表现形式之一。研究表明[8],神经细胞缺氧缺糖/复氧复糖后常常发生细胞凋亡。
MAPK信号通路是缺氧缺糖/复氧复糖后神经元凋亡发生的重要环节,JNK3是引发MAPK信号通路下游信号及神经细胞凋亡相关基因表达的关键,抑制JNK的活性可以抑制神经元的凋亡[9]。JNK家族是一类丝氨酸/苏氨酸激酶,是哺乳动物内发现的第三类MAPK(mitogen-activated protein kinases)家族[10]。JNK3是它的一个亚型,主要表达于脑组织[11]。在钙离子超载、氧自由基等应激刺激下,表达于细胞质的JNK3被磷酸化而激活后逐渐转移到细胞核内,调节c-jun等凋亡相关的转录因子。JNK可调控ATF2内在的组蛋白乙酰基转移酶活性和泛素介导的AP-1蛋白降解[12],提高转录因子的稳定性,从而引发JNK下游底物caspase等的凋亡级联反应[13]。
中医认为[14],黄芪具有补气生阳、益气固表、抗毒生肌之功能。药理学研究表明[14,15],黄芪能明显提高脑缺血/再灌注鼠脑组织内超氧化物歧化酶(SOD)、一氧化氮合酶(NOS)和一氧化氮(NO)含量,清除氧自由基,增加微循环灌注,从而有效对抗脑缺血/再灌注损伤[15]。赵燕玲等[16]研究表明黄芪能减少大鼠脑缺血/再灌注后的神经元凋亡。黄芪注射液临床应用广泛,每1 ml相当于生药2 g,姚晨玲等[17]的研究证明黄芪注射液对体外培养的神经细胞去血清损伤有保护作用。本实验前期实验通过MTT法证实加入终浓度为0.5 g(生药)·L-1黄芪注射液对神经元的保护作用最佳[6]。
本实验以大鼠海马神经元原代培养为基础,通过对培养细胞施加缺氧缺糖/复氧复糖因素来模拟脑缺血/再灌注病理生理过程,建立脑缺血/再灌注的细胞模型,从蛋白和基因水平观察黄芪注射液对缺氧缺糖/复氧复糖大鼠海马神经元JNK3表达的影响。实验证实:缺氧缺糖/复氧复糖组JNK3表达明显增强,结合本课题组前期实验观察到缺氧缺糖/复氧复糖可使大鼠海马神经元凋亡现象[6],推测缺氧缺糖/复氧复糖可通过增加JNK3蛋白及其mRNA表达而诱发神经元凋亡。黄芪注射液可明显降低缺氧缺糖/复氧复糖后 0、0.5、2、6、24、72 h 各时间点JNK3蛋白及其mRNA的平均光密度值(P<0.05),同时使其蛋白活性OD值明显降低。表明黄芪注射液可抑制缺氧缺糖/复氧复糖大鼠海马神经元凋亡相关基因JNK3 mRNA表达,从而抑制JNK3蛋白表达,降低了JNK3蛋白活性,从而抑制缺氧缺糖/复氧复糖大鼠海马神经元的凋亡。
本实验观察到缺氧缺糖/复氧复糖后120 h JNK3的表达与正常组相比差异无显著性,推测可能是由于磷酸化的JNK3半衰期为48 h[18],复氧复糖72 h后已表达的JNK3蛋白开始大量降解造成的。
[1] Davis R J.Signal transduction by the JNK group of MAP kinases[J].Cell,2000,103(4):221 -9.
[2] Sun W,Gould T W,Newbern J,et al.Phosphorylation of c-Jun in avian and mammalian motoneurons in vivo during apoptosis:An early reversible event in the apoptotic cascade[J].Neuroscience,2005,25(23):5595 -603.
[3] 刘广义,付志新,郝娟芝,等.大鼠脑缺血再灌流后 Bcl-2、Caspase-3 mRNA水平表达与大脑皮质及纹状体区炎性细胞浸润的影响[J].神经疾病与精神卫生,2004,4(4):252 -5.
[3] Liu G Y,Fu Z X,Hao J Z,et al.Ischemia and reperfusion in rat brain after Bcl-2,Caspase-3 mRNA expression levels in cerebral cortex and striatum of the impact of inflammatory cell infiltration[J].Neurol Dis Psychiatr Sanitat,2004,4(4):252 -5.
[4] Brewer G J,Torricelli J R,Evege E K,et al.Optimized survival of hippocampal neurons in B27-supplemented Neurobasal,a new serum-free medium combination[J].Neurosci Res,1993,35(5):567-76.
[5] Bossenmeyer P C,Koziel V,Daval J L.Hypoxia/reoxygenation induce apoptosis through biphasic induction of protein synthesis in cultured rat brain neurons[J].Neuroscience,2000,95(4):1157 -65.
[6] 张雅丽,高维娟,闫凤霞,等.黄芪注射液抑制缺氧缺糖后复氧复糖大鼠海马神经细胞凋亡的研究[J].中国老年学杂志,2009,29(7):793 -6.
[6] Zhang Y L,Gao W J,Yan F X,et al.Astragalus inhibition after oxygen-glucose deprivation and reoxygenation of rat hippocampus complex sugar apoptosis[J].China Gerontol J,2009,29(7):793-6.
[7] Gross A.BCL2 proteins:regulators of the mitochondrial apoptotic program[J].IUBMB Life,2001,52(3 -5):231 -6.
[8] Raisova M,Hossini A M,Eberle J,et al.The Bax/Bcl-2 ratio determines the susceptibility of human melanoma cells to CD95/Fas2 mediated apoptosis[J].Curr Biol,2000,10(8):290 -2.
[9] 方 芳,陈晓春,朱元贵,等.JNK的激活在MPP诱导SHSY5Y细胞凋亡的信号转导中的作用[J].中国病理生理杂志,2003,19(2):198-202.
[9] Fang F,Chen X C,Zhu Y G,et al.JNK activation in the MPP-induced apoptosis SHSY5Y signal transduction role in the[J].Chin J Pathophysiol,2003,19(2):198 -202.
[10]Weitzman J B.Quick guide.JNK [J].Curr Biol,2000,10(8):R290.
[11]Davis R J.Signal transduction by the JNK group of MAP kinases[J].Cell,2000,103(1):239 -52.
[12]章 茜,程江涛,王书春,等.MAPKs在睡眠剥夺大鼠海马神经元内表达变化的研究[J].中国病理生理杂志,2004,20(10):1874-7.
[12]Zhang Q,Cheng J T,Wang S C,et al.The study about the expressional change of MAPKs in hippocampal neurons after deprivation of sleep in rat[J].Chin J Pathophysiol,2004,20(10):1874 -7.
[13]Bozyczko-Coyne D,O′Kane T M,Wu Z L,et al.CEP-1347/KT-7515,an inhibitor of SAPK/JNK pathway activation,promotes survival and blocks multiple events associated with a beta-induced cortical neuron apoptosis[J].J Neurochem,2001,77(3):845 -63.
[14]柯 庆,邓常青.黄芪对沙土鼠脑缺血/再灌注损伤的影响[J].中国中西医结合急救杂志,2001,3(2):105 -8.
[14]Ke Q,Deng C Q.Astragaloside Gerbils cerebral ischemia-reperfusion injury in rats[J].Chin J Integ Trad West Med Intens Crit Care,2001,3(2):105 -8.
[15]陈晓春,薛 茜.大鼠脑缺血/再灌注损伤及黄芪对脑细胞保护作用的实验研究[J].陕西医学杂志,2004,33(11):974 -6.
[15]Chen X C,Xue Q.Rat cerebral ischemia-reperfusion injury and Astragalus on the protection of brain cells in rats[J].Shanxi Med J,2004,33(11):974 -6.
[16]赵燕玲,王宗仁.黄芪对脑缺血/再灌注后神经细胞凋亡及Bcl-2蛋白表达的影响[J].中国临床康复,2005,9(33):92-4.
[16]Zhao Y L,Wang Z R.Astragaloside cerebral ischemia and reperfusion on apoptosis and Bcl-2 protein expression[J].Chin Clin Rehab,2005,9(33):92 -4.
[17]姚晨玲,黄培志,童朝阳,等.黄芪注射液对培养神经细胞损伤的保护作用[J].中国临床医学,2002,9(2):164 -8.
[17]Yao C L,Huang P Z,Tong C Y,et al.Astragalus on cultured nerve cells injury in rat[J].Chin Clin Med,2002,9(2):164 - 8.
[18]王 宁,薛瑞玲,姚法志,等.JNK3信号转导通路在大鼠脑缺血再灌注损伤中的作用[J].西安交通大学学报,2007,28(6):617-8.
[18]Wang N,Xue R L,Yao F Z,et al.Effects of JNK signal passway on brain ischemia/reperfusion in rats[J].J Xian Commun Univ(Med Sci),2007,28(6):617 -8.
