两种载药高分子复合膜治疗皮肤溃疡的实验研究
2010-12-04孙秀坤董岸杰
孙秀坤,董岸杰
(1.杭州市第三人民医院,杭州310009;2.天津大学化工学院,天津300072)
皮肤科有很多疾病都是以皮肤糜烂和溃疡为主要表现的,如皮肤轻微外伤、糖尿病足溃疡、褥疮、各种病原体所致感染性溃疡、坏疽性脓皮病、放射性皮肤溃疡、遗传性或自身免疫性大疱病,及各种皮肤肿瘤切除术后或激光磨削术后的表浅创面等等。皮肤创面的修复常有赖于良好的敷料。传统敷料如棉纱布等仅具有简单保护功能;组织工程皮肤因需要植入活性细胞,操作复杂,费用较高,暂无法广泛推广。由高分子材料制成的合成敷料克服了上述材料的缺陷,以其为创面所提供的“湿”性环境,良好的促进愈合功能及操作简单等特点,使其在临床的应用也日益增加[1]。将药物与一种性质优良的高分子材料载体支架结合,对于疗效的发挥更是事半功倍,国外已有研究将血小板衍生生长因子结合Omiderm亲水性薄膜治疗放射性皮肤溃疡取得非常好的疗效[2],含银的泡沫型敷料Contreet誖Foam可以显著缩小溃疡面积[3]等,都很好证实了这种载药高分子复合敷料的实用性与有效性。基于上述分析,本研究拟采用聚氨酯等高分子材料作为载体支架,加入药效分子,观察复合药膜对于皮肤溃疡愈合的影响。
1 材料和方法
1.1 材料
1.1.1 药物 康复新液:四川好医生攀西药业有限公司。5%聚维酮碘溶液:杭州民生药业集团有限公司。聚维酮碘医药原料药(粉):博爱新开源制药有限公司。
1.1.2 高分子材料合成所需主要原料 二苯基甲烷二异氰酸酯(MDI):德国拜耳公司;聚乙二醇:上海浦东高南化工厂;二月桂酸锡:成都科龙化学试剂厂;正硅酸乙酯(TEOS):天津市大茂化学试剂厂;聚乙烯醇1788:重庆维尼纶厂。
1.1.3 动物 健康家兔,雌雄不拘,体重2.0~2.5 kg。
1.2 方法
1.2.1 载药高分子材料的制备 ①载康复新聚氨酯水凝胶的制备:将聚乙二醇与MDI进行反应,加入双羟乙基氨基甲酸酯(EC-AE)扩链剂和二月桂酸锡。100℃烘2 h即得到聚氨酯水凝胶板材。将制得的板材溶于冰乙酸溶液,倒入聚四氟乙烯板上,然后置于60℃烘箱内,取出冷却。片材置于康复新药液中浸泡载药。②载聚维酮碘聚乙烯醇(PVA)/有机硅杂化交联膜的制备:向PVA水溶液中加入TEOS与甘油(1/0.5/0.2 W/W/W),50℃搅拌 2 h,所得混合物与药物聚维酮碘粉(10%W/V)混合,脱除气泡,涂膜,干燥,即得药膜。
1.2.2 动物实验 兔背部皮肤溃疡模型的制备按参考文献[4]。家兔25只。每只家兔背部皮肤切割直径为1.8 cm的圆形创面4个,共100个创面,设立空白对照组、聚维酮碘药液组、康复新药液组、聚维酮碘药膜组及康复新药膜组共5组,每组20个创面。实验当日(1d)开始用药。药膜组及药液组每日用药1次,直至第11天;空白对照组不涂药。第4天及12天每组分别随机取6个创面,行组织学检查。每组其余8个创面用于观察创面愈合时间及愈合后瘢痕情况。
1.3 观察指标
(1)大体观察。
(2)不同时段创面愈合率:随机取6只兔于第3天、7天和11天测量创面面积。
创面愈合率=(用药前创面面积-用药后创面面积)/用药前创面面积×100%。
(3)创面愈合时间:记录每个创面肉眼可见完全上皮化的时间。
(4)组织学检查:第4及12天每组分别随取6个创面,福尔马林固定,HE染色,光镜下观察创面:①组织像描述。②炎症细胞数量分级:估计创面组织全层分布的多形核及单一核白细胞数量,分0~3四级,0:无;1:很少;2:中等;3:显著,计数不同时段各组标本每级的个数。③毛细血管数:高倍镜下(×400)计数毛细血管数,取5个视野观察值的平均值作为各例的观察值。④上皮化程度:完全重上皮化比例:在显微镜下观察切片第12天是否出现重上皮化,计算每组6个标本中出现完全重上皮化的比例。新生上皮移行距离:4倍物镜下,根据皮肤组织形态确定新生上皮起始点,用显微测微尺测量起始点至增生前沿距离。
1.4 统计方法 创面愈合率及愈合时间比较,高倍镜下计数毛细血管数比较,新生上皮移行距离比较均采用成组t检验;炎症细胞数量分级采用秩和检验。
2 结果
2.1 大体描述 家兔皮肤溃疡造模后2 d空白对照组创面渗液量较多;两药膜组渗出少。3~4 d空白对照组创面结痂较厚,并可见部分感染迹象;两药液组创面结痂薄,聚维酮碘液组表面较清洁;两药膜组创面无结痂,表面湿润,肉芽生长良好,并见伤口收缩。7 d空白对照组创面结痂明显,部分创面有感染甚至化脓;两药液组创面少见感染,但结痂增厚致使药液难以吸收;康复新药膜组伤口收缩较为明显,肉芽组织生长活跃,聚维酮碘药膜组伤口清洁,有所收缩。12 d药液组及药膜组部分创面肉眼可见几近完全愈合。各组创面完全愈合时间不等;刚刚愈合之后,所形成瘢痕的外观、质地亦有差别,药膜组较空白对照组比,瘢痕外观更接近正常皮肤。
2.2 不同时段创面愈合率及创面愈合时间 见表1。
表1 不同时段创面面积、愈合率及平均愈合时间的比较 (±s)

表1 不同时段创面面积、愈合率及平均愈合时间的比较 (±s)
注:与空白对照组比,*P<0.05,**P<0.01;与相应药液组比,ΔP<0.05。
3d 7d 11d 平均愈合时间(d)用药前创面面积(cm2)组别空白对照组聚维酮碘液组聚维酮碘膜组康复新液组康复新膜组2.733±0.278 2.663±0.431 2.778±0.373 2.762±0.298 2.802±0.371创面面积(cm2)2.637±0.286 2.590±0.368 2.617±0.371 2.555±0.334 2.615±0.371愈合率(%)0.035±0.029 0.035±0.020 0.057±0.052 0.075±0.057 0.063±0.039创面面积(cm2)2.163±0.160 2.123±0.276 1.727±0.257**1.983±0.368 1.618±0.199**愈合率(%)0.205±0.027 0.212±0.055 0.366±0.143*Δ 0.281±0.111 0.428±0.044**Δ创面面积(cm2)0.333±0.046 0.295±0.063 0.258±0.041*0.260±0.443*0.220±0.438**愈合率(%)0.878±0.009 0.890±0.013 0.905±0.023*0.906±0.012**0.920±0.019**16.88±2.532 15.00±2.390 14.50±2.138 14.63±1.506*13.13±1.126**Δ
用药7d两药膜组创面愈合率显著大于空白对照组,且药膜组优于相应药液组,具有统计学差异。用药11d,两药膜组创面愈合率显著大于空白对照组,有统计学差异,但药膜组与药液组比无统计学差异。
从创面愈合时间来看,康复新药液及膜组与空白对照组有统计学差异,且康复新药膜组与康复新药液组比也具有统计学差异。
2.3 组织学检查
2.3.1 组织像描述 4 d:空白对照组溃疡渗出结痂明显,坏死组织多,渗出物中有大量中性粒细胞,溃疡底部肉芽组织少,新生血管形成少。药液组及药膜组溃疡渗出结痂少,无明显坏死组织,渗出物中极少中性粒细胞,溃疡底部肉芽组织较厚,浅层有丰富的毛细血管条索,与创面垂直生长,表皮细胞活跃增殖并向伤口内爬行。12 d:空白对照组创面肉芽组织仍较活跃,其中成纤维细胞和新生毛细血管含量均较用药组多,胶原排列紊乱,新生表皮从溃疡两端向中央生长,但未见完全重上皮化者。部分空白对照创面因感染造成愈合延迟,表现为溃疡中心仍见大量坏死组织,中性粒细胞聚集,纤维组织紊乱,血管充血明显。药液组及药膜组创面鲜见感染。药膜组及部分药液组创面新生纤维组织中毛细血管及成纤维细胞数量减少,胶原排列整齐,新生表皮细胞已覆盖部分创面,接近愈合。
2.3.2 炎症细胞数量分级 4 d:聚维酮碘药膜组炎细胞数量显著低于空白对照组,具有统计学差异。12 d:各组炎细胞数量均减少,之间无统计学差异。见表2。

表2 不同处理对创面组织炎症细胞数量分级的影响
2.3.3 毛细血管数 4 d:各处理组创面毛细血管数较空白对照组为丰富,具有统计学差异,尤以药膜组差异更为明显,见表3,但药膜组与药液组比无统计学差异。
表3 不同处理对创面组织毛细血管数的影响(±s)
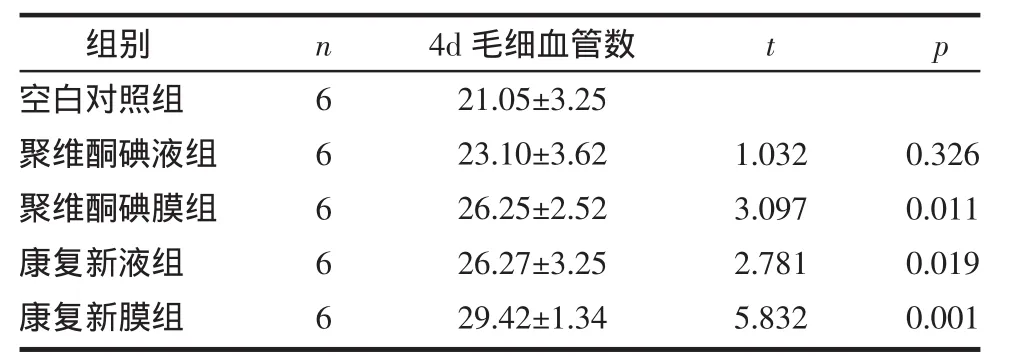
表3 不同处理对创面组织毛细血管数的影响(±s)
组别空白对照组聚维酮碘液组聚维酮碘膜组康复新液组康复新膜组n 6 6 6 6 6 4d毛细血管数21.05±3.25 23.10±3.62 26.25±2.52 26.27±3.25 29.42±1.34 t p 1.032 3.097 2.781 5.832 0.326 0.011 0.019 0.001
2.3.4 上皮化程度 12 d:康复新药膜组完全重上皮化比例50%,康复新药液组及聚维酮碘药膜组各33.3%,聚维酮碘药液组及空白对照组未见完全重上皮化者。聚维酮碘药膜组、康复新药液及康复新药膜组上皮移行距离显著大于空白对照组,有统计学差异,见表4。
表4 不同处理下创面组织新生上皮移行距离比较(±s)

表4 不同处理下创面组织新生上皮移行距离比较(±s)
组别空白对照组聚维酮碘液组聚维酮碘膜组康复新液组康复新膜组n 6 6 6 6 6 12d新生上皮移行距离(mm)7.217±0.387 7.617±0.504 7.983±0.240 7.683±0.331 8.033±0.437 t p 1.543 4.124 2.245 3.429 0.154 0.002 0.049 0.006
3 讨论
为了方便载药,本研究治疗皮肤溃疡的材料基本选用偏亲水性材料,且均具有良好的生物相容性。其中,聚氨酯(PU)是由多元醇小分子扩链剂与异氰酸酯聚合形成的共聚物,其分子链由软段和硬段组成。通过改变分子链中软硬段的组成可以改变聚氨酯的理化性能。PU已经在生物医学领域得到良好的应用[5]。将PU制成水凝胶敷料,是因为水凝胶能与不平整的创面紧密帖合但不粘连,减少细菌滋生的机会[6]。聚乙烯醇也是一种常用的医用生物高分子材料,具有良好的化学稳定性,成膜性及高亲水性。但它在水溶液中易溶胀,引入有机硅组分,可以增强膜的力学性能,提高膜的热稳定性,改善和修饰膜的孔结构及分布,调整亲-疏水平衡,控制膜溶胀[7]。
本研究将聚维酮碘载入聚乙烯醇/有机硅杂化交联膜,将康复新液载入聚氨酯水凝胶膜,来观察其实验性促溃疡愈合作用。结果显示,两种药膜与相应药液比,均有更好促进溃疡愈合作用。尤其是在溃疡愈合早期,7d时两种药膜与相应药液比,具有更高的溃疡愈合率,且具有显著性差异。虽然在溃疡愈合后期,这种差距已经越来越小,但总的愈合时间上,药膜组要快于药液组。组织学观察,无论从4 d时肉芽组织的新生血管数,还是从12 d时新生上皮化程度来看,药膜组促进肉芽生长及表皮再生的作用都优于药液组。康复新药膜组促进愈合作用优于聚维酮碘药膜组,但聚维酮碘药膜可明显减少创面感染的发生,表现在4 d时镜下炎细胞数量分级明显低于空白对照组,具有显著性差异。
从上述结果可看出,高分子材料与药物的结合比单纯用药更有利于皮肤溃疡的愈合。聚维酮碘药膜与康复新药膜在促进皮肤溃疡愈合方面的优势在于:可保持创面清洁,减少感染机会;保持创面湿润,为创面愈合制造良好的微环境;更好的加速溃疡愈合,缩短溃疡愈合时间。
高分子材料也常存在一定缺陷,如与创面贴合的顺应性不好,与创面黏附性过强而不易去除等。聚氨酯水凝胶膜以及聚乙烯醇/有机硅杂化交联膜这两种膜相对来说,可以较好黏附于创面,较易去除,特别是加了背衬材料之后,水分蒸发减少,使得材料保持湿润而不易与创面粘牢。这也证实,实际应用中的合成高分子敷料应尽量在工艺上制作成具有背衬的复合材料。总之,在材料性能方面仍需进一步改进制备方法以最大程度的提高疗效,减少副作用。
[1]孙秀坤,许爱娥.医用高分子材料在皮肤病治疗中的应用 [J].中国麻风皮肤病杂志,2008,24(1):47-50.
[2]Wollina U,Liebold K,Konrad H.Treatment of chronic radiation ulcers with recombinant platelet-derived growth factor and a hydrophilic copolymer membrane[J].J Eur Acad Dermatol Venereol,2001,15:455-457.
[3]Munter KC,Beele H,Russell L,et al.Effect of a sustained silver-releasing dressing on ulcers with delayed healing:the CONTOP study[J].J Wound Care,2006,15:199-206.
[4]孙同柱,付小兵.使用兔进行创面愈合实验研究的体会[J].上海实验动物科学,2001,21(4):246.
[5]牛洪,谢兴益,何成生,等.聚氨酯水凝胶在生物医学中的应用[J].聚氨酯工业,2004,19(5):6-9.
[6]罗建斌,方国芳,谢兴益,等.水凝胶烧伤敷料研究进展[J].生物医学工程学杂志,2004,21(1):156-159.
[7]李传峰,邵怀启,钟顺和.有机无机杂化膜材料的制备技术[J].化学进展,2004,16(1):83-89.
