缺血后适应对大鼠缺血再灌注心肌的保护作用及其与P-Akt的关系
2010-12-03王波阎德民李庆志陶凉朱楠
王波,阎德民,李庆志,陶凉,朱楠
(1.武汉亚洲心脏病医院 心脏外科,武汉 430022;2.中国医科大学 附属第一医院心脏外科,沈阳110001;3.大庆油田总医院 心胸外科,黑龙江 大庆163000;4.中国医科大学 附属第一医院心内科,沈阳110001)
心脏外科手术及急性心肌梗死患者急诊经皮冠状动脉介入治疗(percutaneous transluminal coronary intervention,PCI)中,心肌保护是最关键的部分,而心肌缺血再灌注损伤逐渐成为研究的热点,因为它可以抵消心脏手术、急诊PCI给患者带来的益处。如何预防及治疗心肌再灌注损伤已成为心脏科医师必须面对的问题。最近的研究表明“缺血后适应”可明显减轻心肌再灌注损伤。Zhao等[1]首先提出经典后适应概念,即再灌注后立刻给予1次或多次短暂重复心肌缺血与再灌注,它能提高心肌对之前发生的较长时间缺血的耐受性。缺血后适应与缺血预适应相似,是机体对缺血性损伤的一种自然保护机制,二者有部分效应器及信号转导途径相似,如磷脂酰肌醇3激酶-蛋白激酶B(phosphatidylinositol3 kinase-protein kinase B,PI3k-Akt)途径、细胞外信号转导途径,并且二者均可通过抑制线粒体膜渗透性转换 孔 (mitochondrial permeability transition pore,mPTP)开放而保护心肌。本研究应用离体的大鼠心脏模型来验证缺血后适应对缺血再灌注损伤的保护作用并探讨其机制是否与Akt的激活有关。
1 材料与方法
1.1 实验动物
2周龄健康SD大鼠30只,体质量250~300 g,雌雄不限,由中国医科大学实验动物部提供。
1.2 模型制作
(1)准备 Langendorff心脏灌注装置,Krebs-Henseleit(K-H)液预先加入到Langendorff心脏灌注装置的内管中;(2)所有大鼠均采用水合氯醛腹腔注射麻醉,开胸前5 min腹腔注射肝素500 U/kg,快速正中开胸取出心脏浸于K-H液中,轻轻挤压心脏排出心腔内的积血;(3)迅速悬挂心脏于Langendorff心脏灌注装置上,K-H液以一定的压力持续灌注;(4)由大鼠自身心脏结构决定凡心率<200/min或冠脉流量小于8 ml/min的心脏以及表面出现梗死的心脏弃之不用。
1.3 实验分组及其处理方法
(1)空白对照组(N组,n=10):将小鼠心脏连接在Langendorff系统持续灌流,稳定10 min后不采取任何特殊处理,持续进行灌流,处理的时间与其他组相同;(2)缺血再灌注组(IR 组,n=10):稳定10 min后,关闭灌注开关造成全心缺血,时间为30 min,此后打开灌注开关行再灌注120 min;(3)缺血后适应组(Post组,n=10):在完成120 min再灌注前1 min内,迅速给予短暂停止灌流10 s后再恢复灌流10 s,此为1个循环,重复3个循环,共计60 s。
1.4 标本留取与指标检测
1.4.1 心肌标本的采取及保存方法:各组心肌标本均在平衡灌注结束后,取下心脏于冰台上将心脏剪成黄豆粒大小置于EP管中,于-70℃冰箱中保存Western blot备用,同样方法取心尖部1 mm3组织用戊二醛固定后备电镜用。
1.4.2 离体心脏冠状动脉灌注流量(冠脉流量)的检测:冠脉流量(ml/min)以单位时间内经心脏冠状静脉窦流出的灌注液量计算。心重指数=心脏质量(g)/体质量(g)×1000。
1.4.3 心肌梗死范围的测定:在120 min再灌注结束后,迅速将心脏置于-20℃的冰箱中冷冻30 min后,将冷冻心脏从心尖至心底横向切成薄片(每片厚度约0.8~1.0 mm)。将心脏薄片浸入36℃1%氯化三苯基四氮唑(1%TTC)磷酸盐缓冲液中孵化30 min。存活组织中含有的乳酸脱氢酶可使其显示出红色,坏死心肌中因不含此成分而不显色。染色后将心脏薄片以10%甲醛固定24 h,然后采用V2COM数字化彩色采相机拍照;用形态学分析软件Image tool计测左心室梗死范围。
1.4.4 Western blot检测P-Akt的表达:分别称取心肌组织约100 mg,加入PBS10 ml,匀浆。取上清液提取蛋白并测定蛋白浓度,电泳分离,转印至醋酸纤维素膜,封闭,加入P-Akt一抗、二抗孵育,洗膜,显色,Western blot结果量化。
1.4.5 透射电镜标本的制作及观察:取出已固定好的心肌组织,以蜡块包裹。从蜡块组织周边取小块组织(1 mm×1 mm×1 mm),二甲苯脱蜡,无水乙醇30 min2次,90%乙醇30 min,70%乙醇30 min,0.01 mol/L PBS浸泡30 min,4%戊二醛固定24 h(4℃),0.01 mol/LPBS洗15 min3次,1%锇酸固定1~2 h,0.01 mol/L PBS洗15 min3次,常规脱水,Epon812浸泡,包埋,聚合,超薄切片,铀-铅双染色,JEM-1200EX透射电镜观察。
1.5 统计学分析
2 结果
2.1 各组大鼠基本生理指标
各组大鼠在给予缺血处理以前的各项基本指标(体质量、心重指数、心率、冠脉流量)均未见明显差异(P>0.05)。
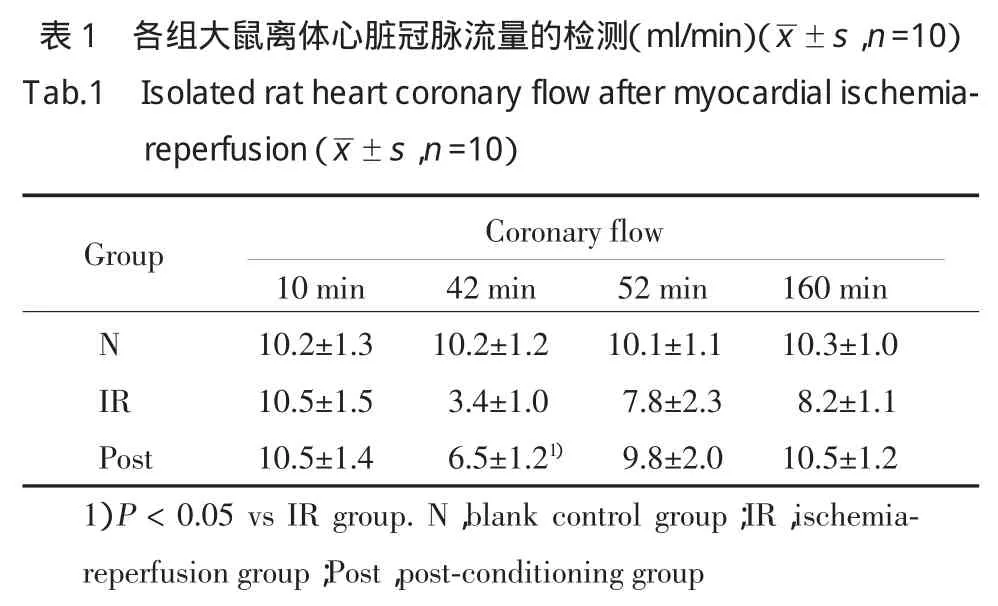
2.2 冠脉流量
各组大鼠缺血前的冠脉流量未见显著差异(P>0.05)。测定实验开始时第 42 min、52 min、160 min 的冠脉流量,在42 min时,Post组与IR组相比,冠脉流量显著增加(P<0.05)。在52 min、160 min时,Post组与IR组无显著差异(P﹥0.05)。见表1。
2.3 心肌梗死范围的测定
N组大鼠未见心肌梗死,Post组心肌梗死范围(25.2±2.1)较 IR 组(47.5±3.5)小,差异有统计学意义(P<0.05)。见图1。
2.4 Western blot检测P-Akt的表达
各组大鼠心肌中均有P-Akt表达,但灰度值测定结果显示 IR 组(45.2±3.4)与 N 组(45.7±3.5)差异无统计学意义(P>0.05),Post组P-Akt表达水平(71.5±4.8)较 IR 组(45.2±3.4)显著升高(P<0.05)。见图2。
2.5 电镜观察结果
N组大鼠心肌未见肌丝断裂与线粒体空泡改变;IR组可见明显的肌丝断裂与广泛的线粒体空泡改变;Post组心肌纤维和线粒体的完整程度较IR组好。见图3。

3 讨论
心肌保护是心脏外科手术及急性心肌梗死患者经皮冠状动脉介入治疗(PCI)最关键的部分,心肌缺血再灌注损伤已逐渐成为近年来研究的热点。缺血预适应已被证实是一种确切的心肌保护措施,但因无法预计缺血发生的时机,该措施无法提前应用于心肌严重缺血甚至心肌急性梗死的患者[2,3]。
近期的研究表明,“缺血后适应”可明显减轻心肌缺血再灌注损伤,能够产生与缺血预适应相当的心肌保护效果。Zhao等[1]首先提出经典后适应概念,即缺血再灌注后立刻给予1次或多次短暂重复心肌缺血与再灌注,能提高心肌对之前发生的较长时间缺血的耐受性。研究已初步证实,后适应在兔、犬、鼠心肌缺血与再灌注中具有改善缺血再灌注心脏的心功能、缩小梗死面积的作用,但其作用机制尚不明确[4~7]。
众多的文献报道[5~8]显示,在经过单纯缺血再灌注与缺血后适应处理后的冠脉流量是没有统计学意义的。但本研究结果显示,经后适应处理后的健康大鼠与未经此处理的缺血再灌注组相比,在再灌注的前几分钟内其冠脉流量的提高是有统计学意义的,说明缺血后适应可以减小再灌注初期的冠状动脉痉挛的程度,使再灌注初期心肌的血液供应不至于太少,以达到保护心肌的效果[9,10]。
心肌梗死范围的大小被认为是影响心功能最大的因素之一。本研究通过TTC染色的方法测定心肌梗死范围,结果提示经过缺血后适应处理的心肌梗死范围明显较少。可见缺血后适应可减小心肌梗死范围,并起到保护心肌的作用。
目前认为PI3K-Akt是缺血后适应的关键酶之一[10~12]。Tsang 等及 Yang 等提出,缺血后适应通过PI3K及Akt的磷酸化发挥其心肌保护作用,进而认为PI3K-Akt-eNOS是介导后适应作用的主要途径。Akt是一种丝/苏氨酸蛋白激酶,是PI3K最主要的靶酶,而eNOS是PI3K-Akt途径的主要下游靶点。激活的Akt主要通过促进下游底物如合成酶激酶-3B等的磷酸化而发挥广泛的生物学效应,包括抗凋亡、促细胞生存等功能。缺血后适应激活了Akt的磷酸化,增加了线粒体通透性转换孔道对Ca2+超载的抵抗从而发挥保护作用。本研究也证实了在经过缺血后适应处理过的组别中,P-Akt有较高表达,从而同样证实了缺血后适应的心肌保护作用是通过激活Akt来实现心肌的保护作用。
本研究中透射电镜下观察到缺血后适应组心肌纤维、线粒体更加完整,而缺血再灌注组心肌纤维则有较大的断裂,线粒体空泡较多。因而从微观方面说明了缺血后适应可以减轻心肌及线粒体的损害,从而达到保护心肌的作用。
本研究结果表明,缺血后适应对离体大鼠心肌也同样有心肌保护作用,这种保护作用的实现有可能是多种机制共同作用的结果,其最终效应子可能是线粒体膜渗透转变孔(mPTP)[6~11],而缺血后适应调控mPTP的具体机制尚不清楚。我们推测,PI3KAkt-eNOS途径可能是其作用机制之一。
在治疗心肌缺血或梗死患者的临床实践中,与缺血预适应相比,缺血后适应更具有可行性。有文献报道,急性心肌梗死患者冠状动脉成形时予以缺血后处理,能够减轻心肌缺血再灌注损伤。所以缺血后处理心肌保护的信号途径将是未来研究的方向,可能为心肌缺血再灌注损伤的临床防治开辟新的途径。
[1]Zhao ZQ,Corvera JS,Halkos ME,et a1.Inhibition of myocardial injury by ischemic postconditioning during reperfusion:comparison with ischemic preconditioning[J].Am J Physiol Heart Circ PhysioI,2003,285(2):579-588.
[2]阎德民,王伟,王波.温度对PGC-1在心肌细胞中的表达的影响[J].中国医科大学学报,2008,37(1):38-40.
[3]彭龙云,马虹,何建桂,等.缺血后处理减轻大鼠肥厚心肌缺血再灌注损伤的观察[J].中华心血管病杂志,2006,34(8):685-689.
[4]Bopassa JC,Ferrera R,Gateau-Roesch O,et a1.PI3-kinase regulates the mitochondrial transition pore in controlled reperfusion and postconditionig[J].Cardiovas Res,2006,69(8):178-185.
[5]Darling CE,Jiang R,Maynard M,et a1.Postconditioning via stuttering reperfusion1imits myocardial infarct size in rabbit hearts:role of ERK1/2[J].Am J Physiol Heart Circ Physiol,2005,289(4):1618-1626.
[6]Kerendi F,Kim H,Halkos ME,et a1.Remote postconditioning.Brief renal ischemia and reperfusion applied before coronary artery reperfusion reduces myocardial infarct size via endogenous activation of adenosine receptors[J].Basic Res Cardiol,2005,100(5):404-412.
[7]Kim H,Zatta AJ,Lofye MT,et a1.Postconditioning reduces infarct size via adenosine receptor activation by endogenous adenosine[J].Cardiovasc Res,2005,67(1):124-133.
[8]Yang XM,Proctor JB,Cui L,et a1.Multiple,brief coronary occlusions during early reperfusion protect rabbit hearts by targeting cell signaling pathways[J].J Am Coll Cardiol,2004,44(7):1103-1110.
[9]Yang XM,Philipp S,Downey JM,et a1.Postconditioning’s protection is not dependent on circulating blood factors or cells but involves adenosine receptors and requires PI3-kinase and guanylyl cyclase activation[J].Basic Res Cardio1,2005,100(1):57-63.
[10]Zatta AJ,Kim H,Lee G,et a1.Infarct-sparing effect of myocardial postconditioning is dependent on protein kinase C signaling[J].Cardiovasc Res,2006,70(2):315-324.
[11]Argaud L,Gateau-Roesch O,Raisky O,et a1.Postconditioning inhibits mitechondrial permeability transition [J].Circulation,2005,111(2):194-197.
[12]Feng J,Lucchinetti E,Ahuja P,et a1.Isoflurane postcontioning prevents opening of the mitochondrial permeability transition pore through inhibition of glycogen synthase kinase3 beta[J].Anesthesiology,2005,103(5):987-995.
