细胞周期相关蛋白DCT1染色体及细胞定位与其组织表达的研究
2010-12-03刘琦王述森高锦兰曹丽华罗阳
刘琦,王述森,高锦兰,曹丽华,罗阳
(中国医科大学 基础医学院医学基因组学教研室,卫生部细胞生物学重点实验室,沈阳110001)
DCT1(DOC-1R terminal1,DCT1)基因是我们在研究候选抑癌基因DOC-1R(Deleted in Oral Cancer-1 Related,CDK2AP2)过程中发现的相关基因。在前期工作中,我们采用cDNA末端快速扩增技术(rapid amplification of cDNA ends,RACE)完成了该基因全长cDNA克隆,并对DCT1序列进行分析。结果提示DCT1与Y43F4B.7蛋白N端同源,并可能与DOC-1R功能上相关,可能为细胞周期调节因子。
本研究中,我们通过辐射杂交技术(radiation hybrid,RH)将DCT1定位于5q31。此外我们进行了DCT1功能上的初步研究。我们构建了真核表达载体pEGFP-DCT1,转染HeLa细胞后观察其细胞内定位,应用实时荧光定量PCR技术,检测DCT1在包括小肠、皮肤等在正常人类组织中的表达水平。我们的研究为进一步深入研究该基因在细胞内的作用奠定基础。
1 材料与方法
1.1 主要试剂
PyrobestTMDNA聚合酶、限制性内切酶、T4 DNA聚合酶、DNA片段回收纯化试剂盒及SYBR Premix EX TaqTM定量PCR试剂购自宝生物工程(大连)有限公司;Standford G3 RH panel购自 Research Genetics公司;质粒提取及纯化试剂盒购自QIAGEN公司;真核细胞表达载体pEGFP-C3为Clontech产品;细胞转染试剂LipofectamineTM2000为Invitrogen公司产品。PCR扩增引物自行设计,由宝生物工程(大连)有限公司商业合成并纯化。
1.2 细胞系及细胞培养
人类宫颈癌细胞系HeLa细胞在含10%灭活小牛血清的DMEM培养液中常规培养。
1.3 染色体定位分析
遵照Standford G3 RH panel,以DCT1上下游引物(上游5′-AGCAATAGCACAACCATGGTTC-3′,下游5′-GACCCATCACGATGCCTGC-3′) 进行 PCR 扩增,扩增产物行琼脂糖凝胶电泳,每个克隆PCR扩增结果分为阴性、阳性和可疑,进行2次独立反应,并进行数据分析。
1.4 pEGFP-DCT1载体构建
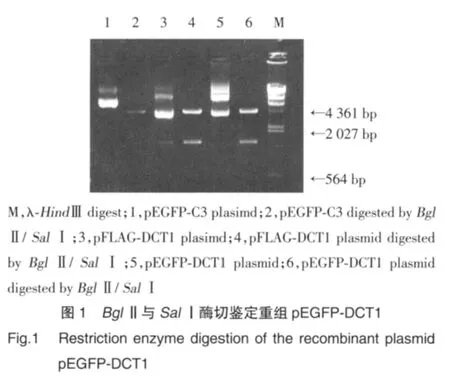
以BglⅡ/SalⅠ消化包含DCT1全部编码序列的pFLAG-DCT1载体得到长度为1.5 kb的片段,以1%琼脂糖凝胶电泳分离、回收DCT1片段并将其常规克隆到载体pEGFP-C3BglⅡ/SalⅠ的限制性内切酶酶切位点[1]。挑选克隆进行菌落PCR,将候选阳性克隆小量快速提取质粒并以BglⅡ/SalⅠ限制性内切酶消化质粒DNA,经测序分析得到重组载体并-20℃保存备用。
1.5 细胞转染及荧光显微镜观察
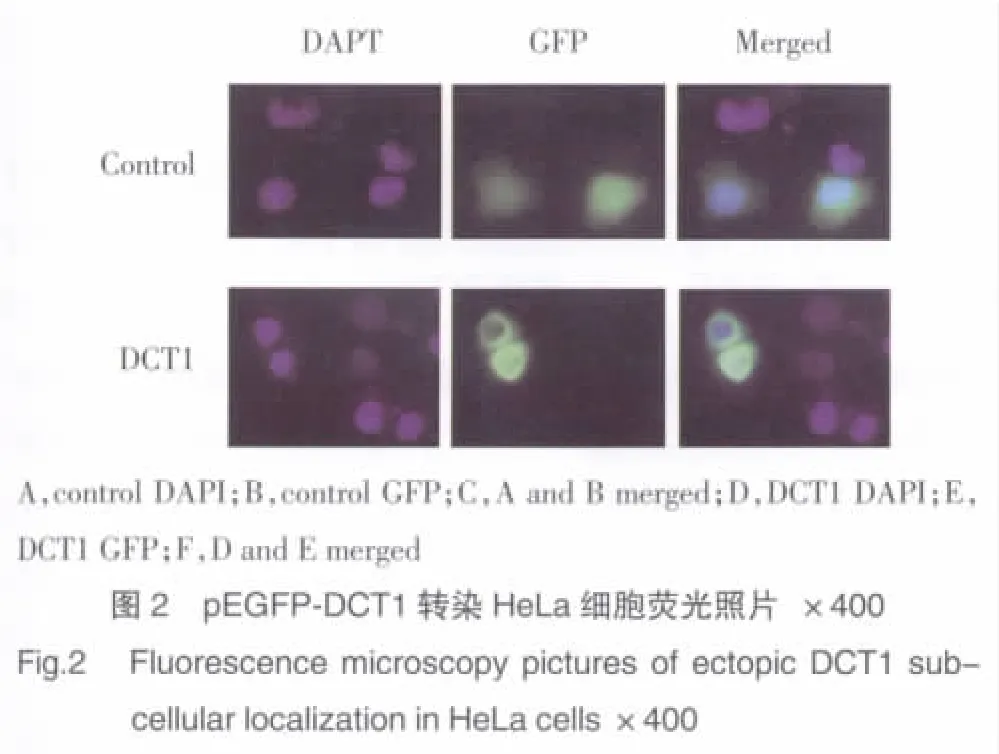
选择对数生长期的HeLa细胞,胰酶消化传至6孔培养板中,加入无抗生素含10%小牛血清的DMEM培养液中常规培养24 h。待细胞生长至60%~80%汇合时进行转染。以pEGFP-DCT1为实验组,pEGFP-C3 为对照组,取 4 μg质粒 DNA,按 LipofectamineTM2000试剂操作说明进行转染。转染后继续培养过夜,通过Leica DMIRE2荧光显微镜观察比较实验组与对照组细胞内荧光分布情况并照相保存。
1.6 实时荧光定量PCR检测DCT1表达
取本实验室保存的16个正常人类组织(小肠、肝、皮肤、心、胃、食管、大脑、大肠、肾、胰腺、脾、子宫、肺、膀胱、卵巢以及肌肉)cDNA,建立应用SYBR greenⅠ荧光定量PCR反应体系25 μl,上述DCT1上下游引物(10 mmol/L)各1μl,cDNA0.3 μl。PCR反应条件:预变性 95 ℃10 s,95 ℃5 s,60 ℃20 s,循环40次,Roter Gene2000检测收集信号并进行数据分析。
2 结果
2.1 DCT1染色体定位于5q31
将PCR扩增结果阳性记为1,阴性记为0,两次不相同视为2,得到DCT1基因RH定位扩增结果为:00000102000000000000000000000000010000000010100000000000001110000100100000001000000。将该结果输入斯坦福人类基因组中心(Stanford Human Genome Center,SHGC)主页分析,DCT1 定位于5q31。以DCT1基因cDNA序列为探针,在NCBI数据库中进行分析,确定出DCT1精细遗传学定位。本实验采用RH定位结果与数据库分析一致。
2.2 pEGFP-DCT1载体构建
将pFLAG-DCT1和pEGFP-C3质粒分别以BglⅡ/SalⅠ双酶切消化,分离纯化线性化的pEGFPC3质粒和DCT1片段。将二者以适当比例连接,转化大肠杆菌感受态细胞筛选阳性菌落、提取回收质粒,用BglⅡ/SalⅠ双酶切鉴定阳性重组子。当有DCT1片段插入时,分别可以得到约1.5 kb和4.7 kb两条带;否则只有4.7 kb一条带。图1第6泳道显示,重组载体在经过BglⅡ/SalⅠ酶切消化后,出现长度约1.5 kb的片段,此片段的长度与第4泳道用同样的酶消化的pFLAG-DCT1得到的DCT1片段长度一致,表明DCT1片段已经插入到pEGFP-C3载体中,经测序确认重组载体构建成功。
2.3 pEGFP-DCT1后细胞定位分析
pEGFP-DCT1重组载体和pEGFP-C3对照载体分别转染HeLa细胞,过夜培养后在荧光显微镜下观察绿色荧光在细胞内的分布。转染实验组细胞的核膜和集聚体(aggresome)处均匀发出绿色荧光,而对照组绿色荧光则弥散于全细胞,荧光强度均匀一致(图2),表明DCT1蛋白定位于细胞核膜。
2.4 荧光定量PCR方法对DCT1在正常人类组织中表达进行定量分析
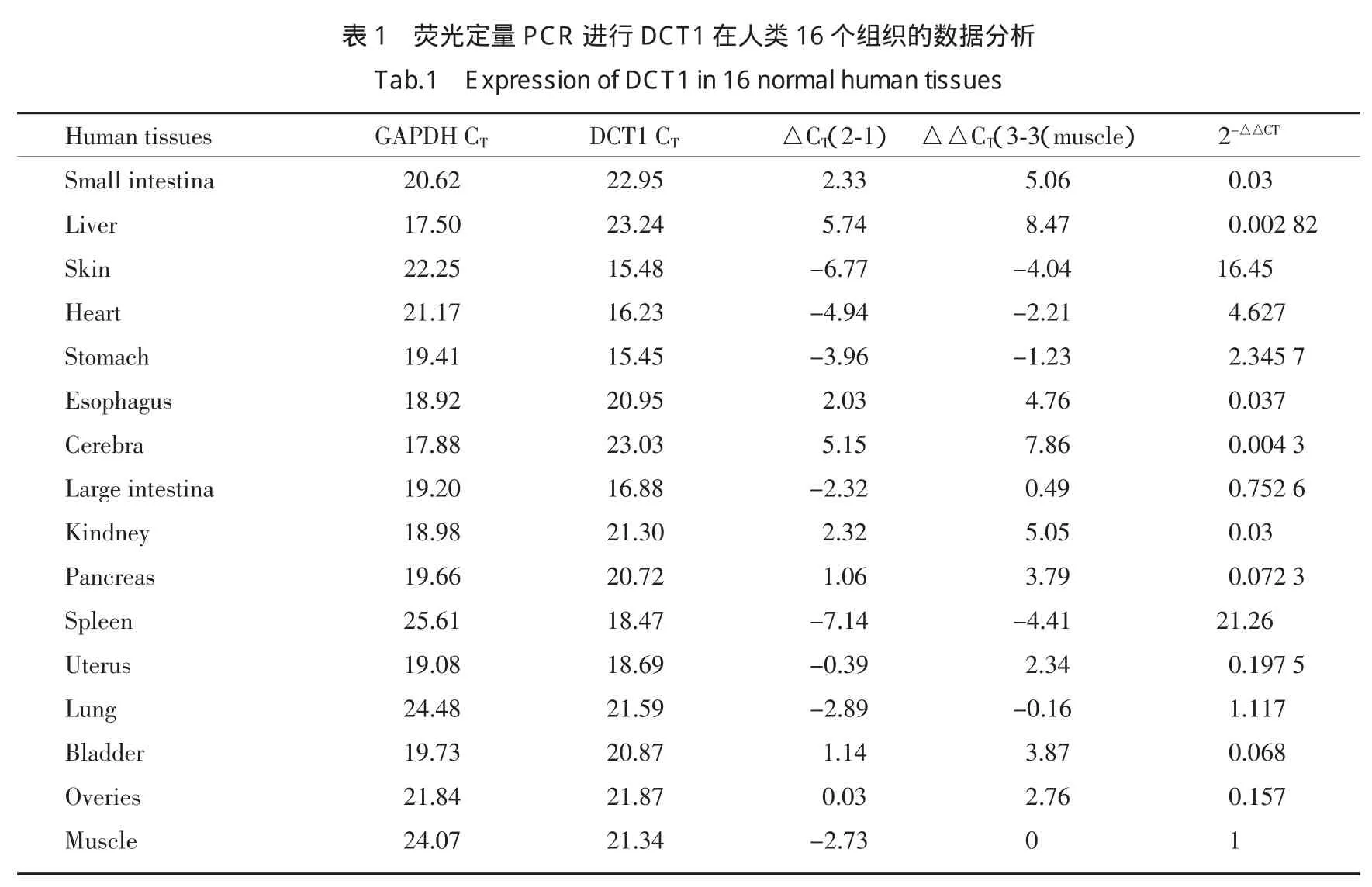
通过实时荧光定量PCR技术,以2-△△CT方法计算DCT1在各组织内相对表达量,分别收集GAPDH CT与DCT1 CT,取平均值后得到均值,根据文献报道方法进行半定量数据分析[2],得到相对于肌肉组织的各组织DCT1的表达情况。其中,小肠中DCT1表达量为肌肉组织中DCT1表达量的0.03倍,肝脏表达量为0.002 82倍,皮肤表达量为16.45倍,心脏为4.627倍,胃为2.345 7倍,食管0.037倍,大脑0.0043倍,大肠为0.752 6倍,肾为0.03倍,胰腺0.0723倍,脾为21.26倍,子宫为0.1975倍,肺为1.117倍,膀胱0.068倍,卵巢为0.157倍(表1)。
3 讨论
细胞周期调控是目前细胞生物学研究的前沿和热点领域。细胞周期调控异常是细胞癌变的关键环节。现已知细胞周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)-细胞周期蛋白(cyclin)复合物的形成、激活与失活是细胞周期调控的分子基础。癌基因与抑癌基因可作为CDK-周期蛋白活性的正负性调节因子,参与细胞增殖、分化、发育和凋亡等的调控过程。
DCT1是我们在研究候选抑癌基因DOC-1R过程中发现的其相关基因。我们采用RACE方法完成了新基因全长cDNA克隆,并得到其编码蛋白的氨基酸序列。DCT1 cDNA全长为1 431 bp,编码476个氨基酸,其编码产物与线虫的Y43F4B.7蛋白N端同源。序列分析表明,DCT1可能与DOC-1R功能相关,可能也是一种细胞周期调节因子。
DOC-1R(GenBank,AF089814)基因是1999 年张学等发现的一个候选抑癌基因。人的DOC-1R基因由4个外显子和3个内含子组成,定位于11q13,编码蛋白含有126个氨基酸,57%与DOC-1基因编码蛋白相同,其C端氨基酸74~126区域和DOC-1蛋白高度同源,86%氨基酸相同,并与线虫蛋白Y43F4B.7局部有一定同源性[3~5]。Northern blot和RT-PCR显示,DOC-1R基因在多种组织中均有表达,表明该基因可能是对维持脊椎动物器官的功能具有重要作用的管家基因[6]。转染试验表明,DOC-1R基因表达明显抑制肿瘤细胞的体外集落形成能力[7]。应用GST-DOC-1R重组蛋白和人胚肾293细胞抽提物进行的体外pull-down试验表明,DOC-1R能够与CDK2结合(未发表)。以上结果均提示,DOC-1R可能在细胞周期调控过程中,对于通过G1/S限制点及S期生物学事件的调节具有重要的意义[8~10]。
本研究中,我们通过RH技术完成了基因染色体定位,将DCT1定位于5q31,并通过NCBI数据库验证了我们的结果。生物信息学提示,DCT1可能为跨膜蛋白,且进行了11次跨膜。为了验证以上预测结果,我们构建了EGFP-DCT1融合表达的真核表达载体pEGFP-DCT1,转染HeLa细胞后通过荧光显微镜观察DCT1的细胞内定位。结果表明,DCT1定位于核膜。此外,我们应用实时荧光定量PCR技术,检测DCT1在人类16个组织中的表达,我们的结果表明DCT1普遍表达,其表达水平在脾较高,在肾、大脑、食管及肝和小肠组织中表达水平较低,上述结果提示DCT1可能作为管家蛋白,对于维持细胞功能具有一定作用。
DCT1与DOC-1R分别与线虫蛋白Y43F4B.7蛋白N端及C端同源,提示二者可能结合,且在功能上可能相关。DCT1对于细胞生命活动调节的具体功能,其是否如DOC-1R一样具有抑癌蛋白的作用及其在各个物种中的保守性,需要进一步实验证实。
[1]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the2-△△CTmethod [J].Methods,2001,25(4):402-408.
[2]Zhang X,Tsao H,Tsuji T,et al.Identification and mutation analysis of DOC-1R,a DOC-1 growth suppressor-related gene[J].Biochem Biophys Res Commun,1999,225(1):59-63.
[3]Terret EM,Lefebvre C,Djiane A,et al.DOC1R:a MAP kinase substrate that control microtubule organization of metaphase II mouse oocytes[J].Development,2003,130(21):5169-5177.
[4]生秀杰,姜莉,周伟强,等.应用基因组步移克隆小鼠Doc-1R基因序列[J].中华医学遗传学杂志,2001,18(4):225-227.
[5]生秀杰,周伟强,姜莉,等.小鼠Doc-1R基因的克隆及其表达[J].癌症,2002,21(2):122-126.
[6]周伟强,姜莉,生秀杰,等.小鼠DOC-1R反义重组载体的构建及表达的研究[J].癌症,2002,21(3):240-244.
[7]Dominique AB,Shahul M,Marie-Therese A,et al.Cdk2 associates with MAP kinase in vivo and its nuclear translocation is dependent on MAP kinase activation in IL-2-dependent Kit225 T lymphocytes[J].Oncogene,2000;19(36):4184-4189.
[8]Matsuo K,Shintani S,Tsui T,et al.p12DOC-1,a growth suppressor,associates with DNA polymerase α/primase[J].FASEB J,2000,14(10):1318-1324.
[9]Shintani S,Ohyama H,Zhang X,et al.p12DOC-1 is a novel cyclindependent kinase2-associated protein[J].Mol Cell Biol,2000,20(17):6300-6307.
[10]Marcotte EM,Pellegrini M,Ng HL,et al.Detecting protein function and protein-protein interaction from genome sequences [J].Science,1999,285(5428):751-753.
