对氧磷酶长循环脂质体的制备及评价
2010-12-03韩振坤孙建波刘丹胡海洋陈大为顾鹏毅赵敏
韩振坤,孙建波,刘丹,胡海洋,陈大为,顾鹏毅,赵敏
(1.中国医科大学 附属盛京医院急诊科,沈阳110004;2.沈阳药科大学 药学院,沈阳110016;3.中国医科大学 实验技术中心,沈阳110001)
对氧磷酶(paraoxonase,PON)是1953年被发现的一种能够水解磷酸酯键的A2酯酶,其家族至少有3个成员PON1、PON2和PON3。PON1是其中发现最早,研究最多的一个成员。我们对兔血清PON1进行了提取和纯化[1],目前,PON1活性改变与有机磷中毒[2]、心脑血管疾病[3,4]、妊娠期高血压疾病、细菌扩散能力及耐药性均有关。
PON1在有机磷酸代谢中具有重要作用,它不但能催化磷酸酯键的水解,降解有机磷酸、芳香羟基酸酯和氨基甲酸酯,还能够水解包括有机磷杀虫剂制品对氧磷、二秦哝(DZO)和毒死蜱等宽范围的底物。除此之外也水解神经毒剂沙林、梭曼和VX[5]。Furlong实验室做了大量的研究,并且在有机磷暴露前后通过给大鼠和小鼠注射从兔血清纯化的PON1,证明了PON1治疗的潜在可能性[6],被认为是一个开发治疗有机磷暴露和中毒有前途的方法。蛋白类药物与传统药物相比,有半衰期短、清除率高、分子量大、易受体内酶和细菌以及体液破坏等特点。聚乙二醇修饰的长循环脂质体作为蛋白质药物载体,能避开网状内皮系统的吞噬,增加脂质体的血液循环时间,从而达到持续、缓慢释放药物的目的。本实验采用薄膜分散法制备了聚乙二醇修饰的对氧磷酶长循环脂质体(PEG-modified PON1 long circulating liposome,PEG-PON1-LCL),在酶活性稳定的前提下,以包封率为指标,对各处方因素进行了考察,并应用正交设计进行处方优化,确定了对氧磷酶聚乙二醇化长循环脂质体的最优处方,测定了其粒度分布并对其稳定性进行了初步考察。
1 材料与方法
1.1 材料
大豆卵磷脂(soybean phosphatidyl choline,SPC,上海泰伟药业有限公司);胆固醇(天津市博迪化工有限公司);Sepharose CL-6B(瑞典Pharmacia公司);乙酸苯脂(分析纯,美国Sigma公司);牛血清白蛋白(美国Amresco公司);考马斯亮蓝G-250(Coomassie Brilliant Blue,CBB,美国 Amresco公司);其余试剂均为分析纯。
FA1104电子天平(上海民桥精密仪器科技有限公司);DF-101S集热式恒温加热磁力搅拌器(巩义市英峪华仪器厂);RE-53A型旋转蒸发仪(上海亚荣生化仪器厂);SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司);UV-9100型紫外分光光度计(北京瑞利分析仪器厂);LS230激光粒度仪(美国Coulter公司);Nicomp TM380动态光散射粒度-zeta电位测定仪(美国PSS公司);JY92-ⅡDN超声波细胞粉碎机(宁波新芝生物科技股份有限公司);JEM-1200EX透射电镜(日本电子公司);UV-1601分光光度计(日本岛津公司)。
1.2 方法
1.2.1 兔血清中对氧磷酶的提取和纯化:根据文献[7],首先使用Cibacron Blue3GA琼脂糖为介质的亲和层析,之后以Sepharose Fast Flow为介质进行两次阴离子交换层析。收集蛋白后Centrplus YM-10离心超滤(美国Millipore)使蛋白浓缩、除盐,4℃保存。
1.2.2 血清对氧磷酶活性检测:参考文献[8]采用乙酸苯酯法测定PON1活性。PON1活性单位用U/ml表示,1U为对氧磷酶每分钟水解1 μmol的乙酸苯酯。
PON(U/ml)=△A/min×TV×106/(SV×L×ε)
其中△A/min为每分钟吸光度变化值;TV为反应总体积(ml);SV 为样本体积(ml);L 为比色杯光径(cm);ε为对硝基酚的摩尔消光系数(1.31×106cm/mol)。
1.2.3 脂质体制备对对氧磷酶活性的影响:为了考察脂质体制备过程是否影响对氧磷酶的活性,分别对胆固醇、磷脂、空白脂质体、载酶脂质体、二氯甲烷、37℃水浴(30 min)、冰浴超声(200 w,3 min)、胆固醇+酶、磷脂+酶、酶+10%Triton等制备因素对酶活性的影响进行了考察,酶活性测定方法同1.2.2。
1.2.4 PEG-PON1-LCL的制备:应用薄膜分散法制备聚乙二醇化脂质体,按处方量精密称取磷脂、胆固醇及聚乙二醇-胆固醇于西林瓶中,用二氯甲烷完全溶解后,置于磨口茄形瓶中,于37℃水浴、100 r/min条件下,减压蒸发除去有机溶剂,磷脂等成膜材料于瓶底形成均一薄膜,加入PON1 HEPES缓冲液,充分水化后冰浴超声(200 w)3 min,过0.22 μm微孔滤膜,即得聚乙二醇化脂质体。
1.2.5 考马斯亮蓝标准曲线的制作:按标准配置不同浓度的牛血清白蛋白溶液,以牛血清白蛋白含量为横坐标(μ g),吸光值(A)为纵坐标绘制标准曲线。
1.2.6 凝胶柱法测定PEG-PON1-LCL的包封率
1.2.6.1 洗脱曲线的考察:精密吸取聚乙二醇化脂质体混悬液5.0 ml,缓缓加入柱长为20 cm的Sepharose CL-6B凝胶柱顶部(r=1.25 cm),洗脱液为pH 8.0 的 HEPES 缓冲液,流速0.5 ml·min-1,分管收集滤过液,各管号收集体积:1、2、3、4为4 ml,第5管为1.5 ml,6、7、8、9 各为 4 ml,1~4 管滤过液破乳(甲醇)后定容至10 ml,用考马斯亮蓝G-250染料法测定对氧磷酶量(图1)。
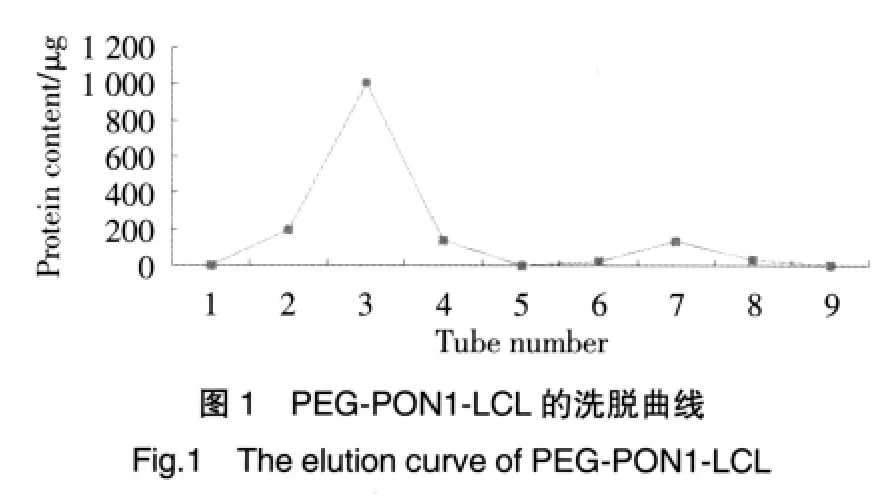
结果表明,脂质体与游离的对氧磷酶组分之间分离度较好,重复测定的结果偏差较小。
1.2.6.2 包封率(encapsulation efficiency,EE)的测定:取制备聚乙二醇化脂质体在Sepharose CL-6B凝胶柱上样,对脂质体和未包封的游离对氧磷酶进行分离,用考马斯亮蓝G-250染料法测定游离对氧磷酶量,按以下公式计算包封率:
包封率 EE=(A总-A游离)/A总×100%
其中,A游离游离对氧磷酶的量;A总为脂质体混悬液中所含对氧磷酶的总量。
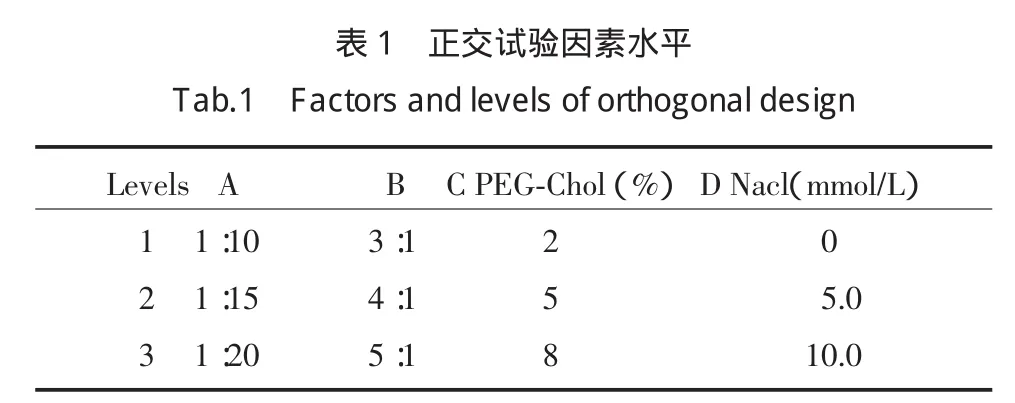
1.2.7 PEG-PON1-LCL的处方优化:分别选用不同的药脂比、磷脂与胆固醇的比例、不同相对分子质量的PEG-Chol、不同NaCl浓度按1.2.4方法制备对氧磷酶聚乙二醇化长循环脂质体,以包封率为指标考察各处方因素对脂质体的影响。选用药脂比(A)、磷脂与胆固醇的比例(B)、聚乙二醇-胆固醇的用量(C)、不同NaCl浓度(D)为因素,采用正交设计L9(34)对处方进行优化(表1)。
1.2.8 PEG-PON1-LCL的粒度分布:将制备的聚乙二醇化脂质体溶液5 ml过0.22 μm的滤膜,取少量溶液滴入激光粒度仪样品池中,测定聚乙二醇化脂质体的粒度分布。
1.2.9 PEG-PON1-LCL初步稳定性的考察:按最优处方制备6批聚乙二醇化脂质体,4℃下放置15 d,测定其包封率及酶活性变化。
2 结果
2.1 影响对氧磷酶活性测定及活性的因素
考察结果表明,胆固醇、磷脂、空白脂质体、10%Triton对对氧磷酶的活性测定基本没有影响,二氯甲烷、37℃水浴(30 min)、冰浴超声等条件对酶活性影响较小,载药脂质体破乳后活性测定是原酶活性的75.08%左右。
2.2 考马斯亮蓝标准曲线
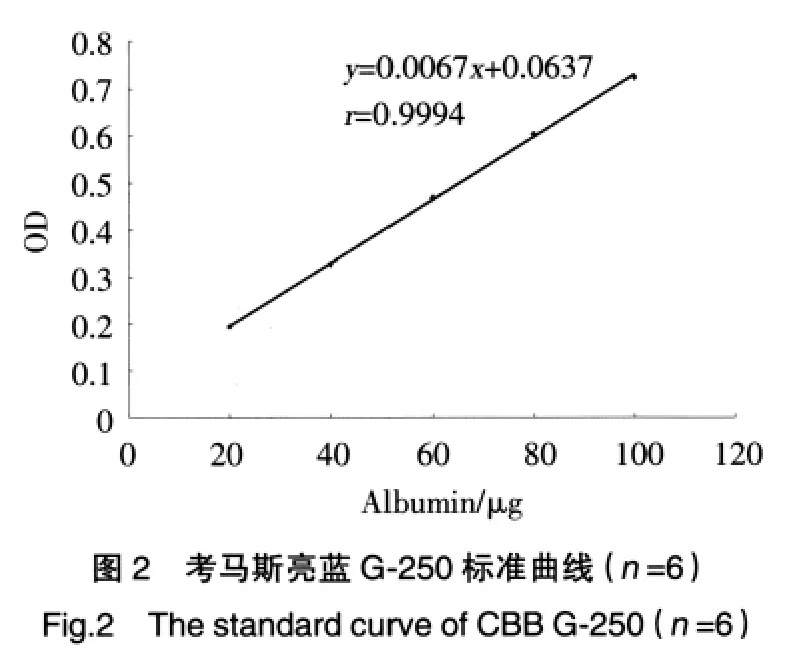
以牛血清白蛋白含量为横坐标(μg),吸光值(A)为纵坐标绘制标准曲线,用最小二乘法进行回归计算,求得直线方程为y=0.0067x+0.0637,r=0.9994(图2)。
2.3 处方考察结果
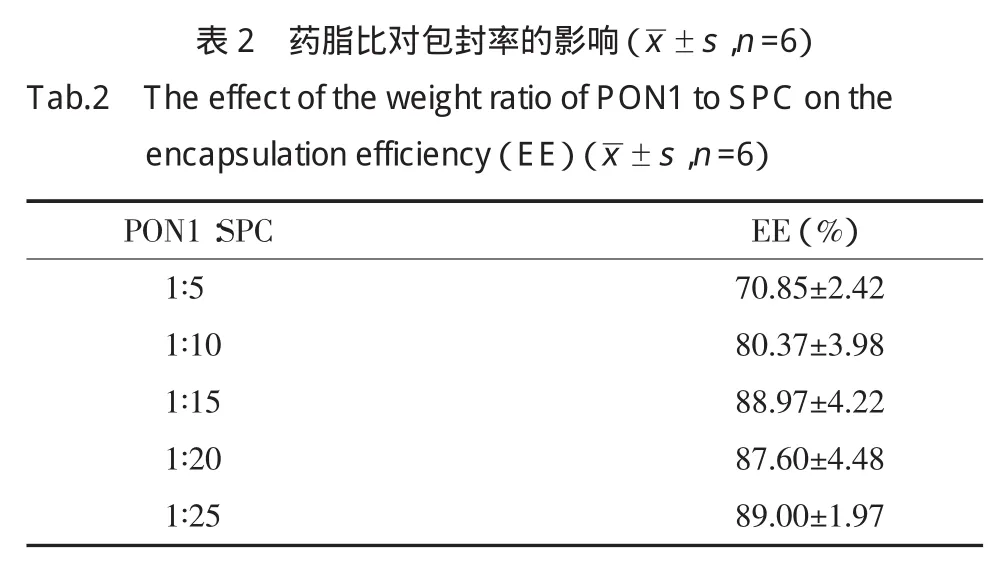
2.3.1 不同药脂比对包封率的影响:分别以药脂比1∶5,1∶10,1∶15,1∶20,1∶25,磷脂:胆固醇为4∶1,PEG-Chol为磷脂的5%,薄膜分散法制备脂质体。结果表明,在实验条件范围内,磷脂的量增加包封率随之增加(表2)。
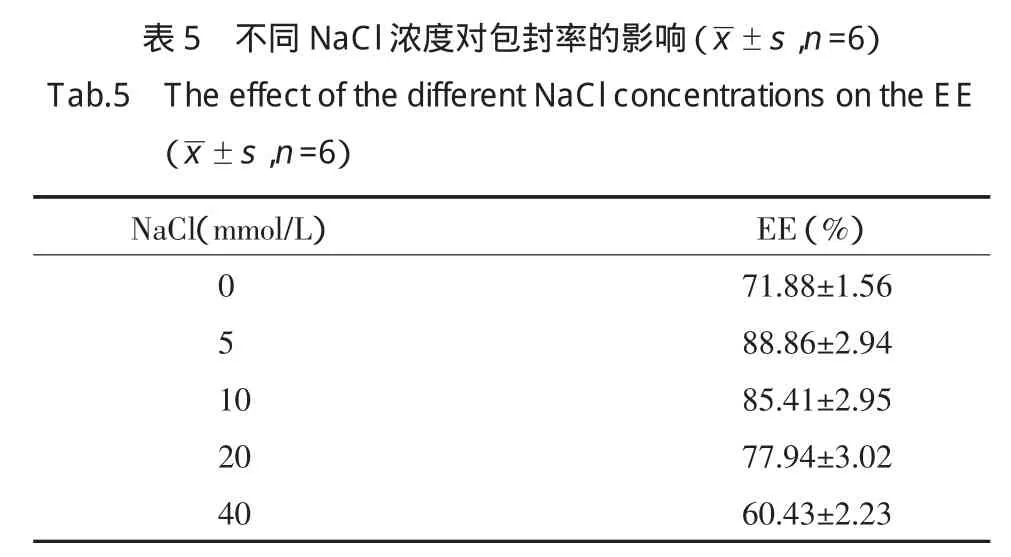
2.3.2 磷脂与胆固醇的比例对包封率的影响:固定处方中磷脂的用量,药脂比,PEG-Chol为磷脂的5%,改变胆固醇的用量,分别以大豆磷脂:胆固醇为2∶1,3∶1,4∶1,5∶1,无胆固醇,薄膜分散法制备脂质体。结果表明,在实验条件范围内,随着胆固醇比例的减少,包封率先增大后减少,有最大值(表3)。
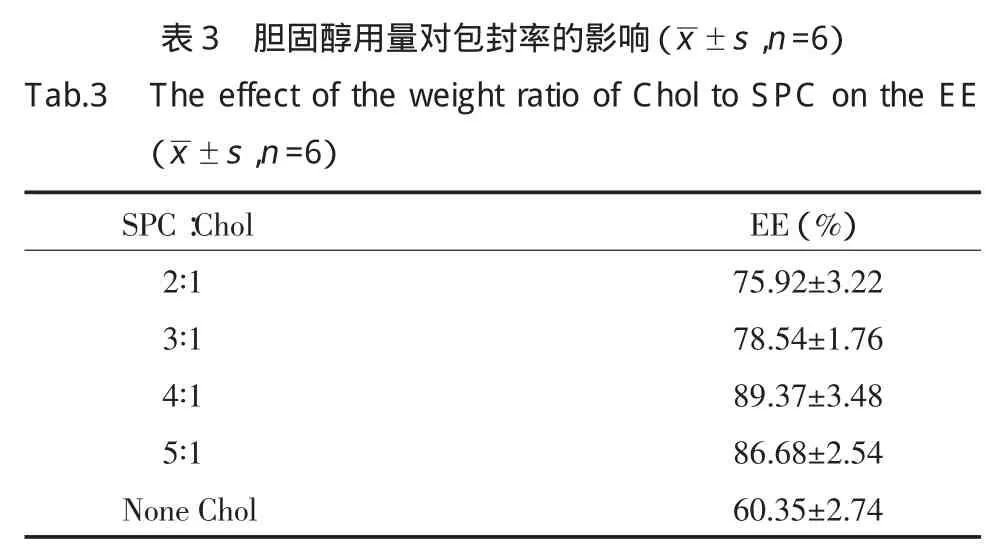
2.3.3 PEG2000-Chol用量对包封率的影响:考察PEG2000-Chol用量对包封率的影响。实验结果表明,在实验范围内,PEG2000-Chol用量为磷脂的5%时,脂质体的包封率最大(表4)。
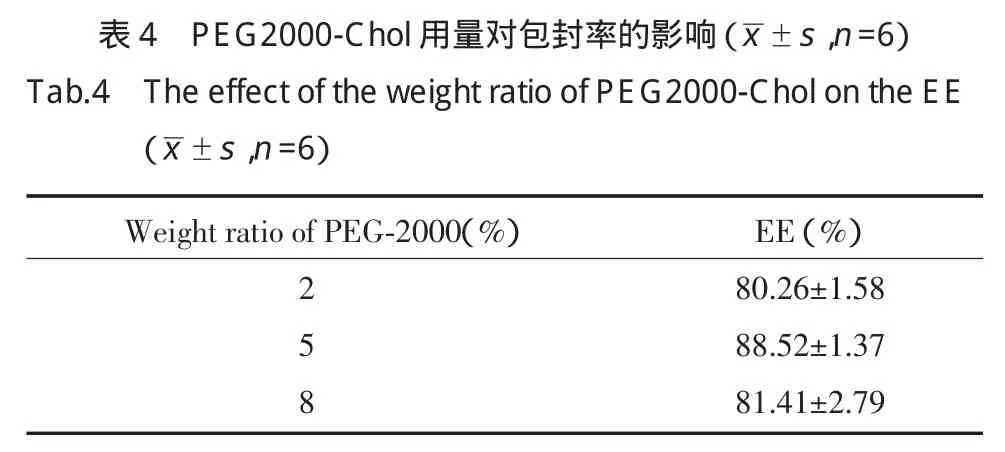
2.3.4 不同NaCl浓度对包封率的影响:固定处方中磷脂的用量,药脂比,磷脂∶胆固醇为4∶1,PEGChol为磷脂的5%,NaCl的浓度分别为0,5,10,20,40 mmol/L,薄膜分散法制备脂质体。结果表明,在试验范围内,当NaCl的浓度>20 mmol/L时,脂质体的包封率降低(见表5)。
2.3.5 不同缓冲液种类对包封率的影响:固定处方中的磷脂与胆固醇的比例,药脂比,PEG-Chol用量为磷脂的5%,分别依药典配制pH 8.0的磷酸盐缓冲液(PBS)、HEPES缓冲液薄膜分散法制备脂质体。结果表明,在实验条件范围内,缓冲液的种类对包封率的影响很明显(表6)。
2.4 正交试验优化处方
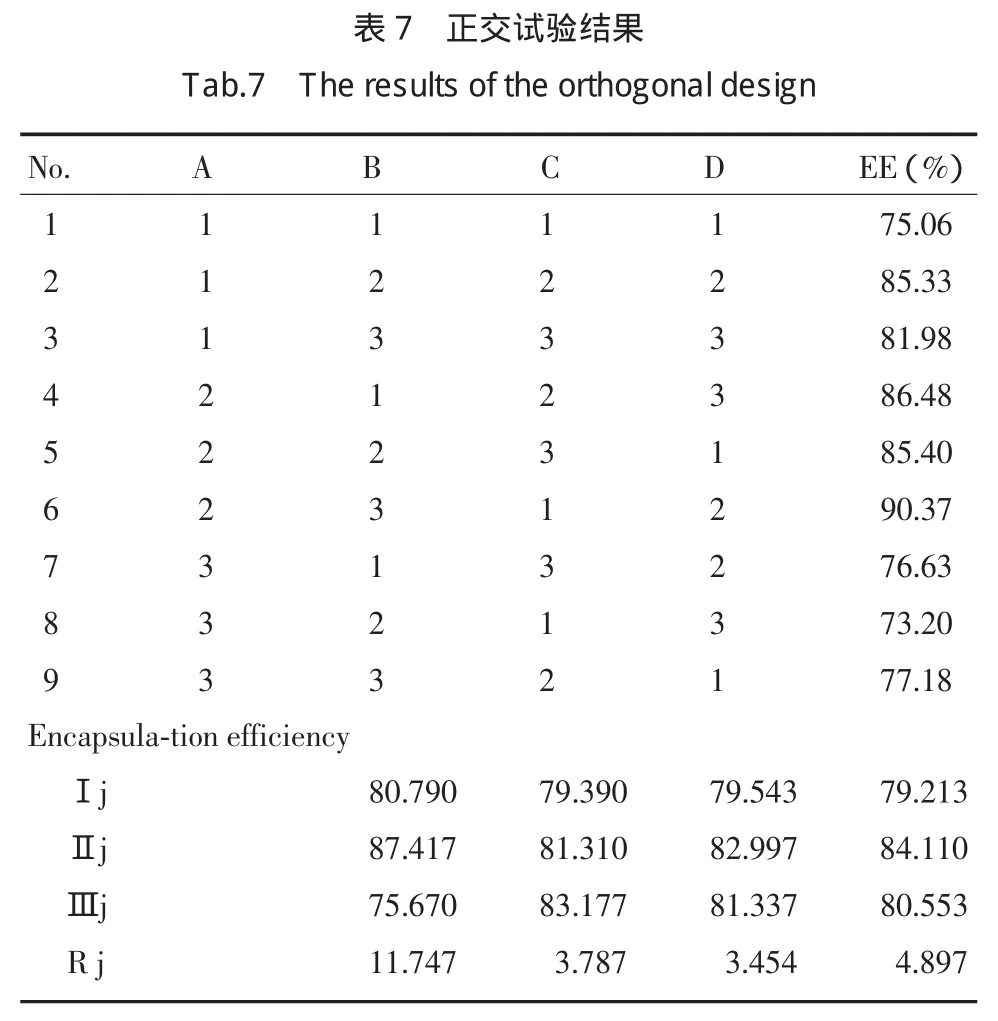
结果表明,各因素对包封率的影响大小次序为A>D>B>C,由此可知,在实验所选范围内,药物与脂质质量比是包封率的主要影响因素,且药物与磷脂的质量比为1∶15(A2)时包封率最高,其次为盐离子浓度和磷脂与胆固醇的比例,而PEG-Chol用量的影响最小(表7)。
综合以上实验结果,可以确定薄膜分散法制备的聚乙二醇化脂质体的最优处方为:磷脂的量为25 mg。磷脂与胆固醇的比例为5∶1。药脂比为1∶15。选用相对分子量为2000的PEG-Chol,用量为磷脂的5%,pH 8.0酶溶液含NaCl为5.0 mmol/L。用以上处方制备聚乙二醇化脂质体,所得脂质体的包封率为(87.66±3.46)%。
2.5 PEG-PON1-LCL的粒度分布及Zeta电位
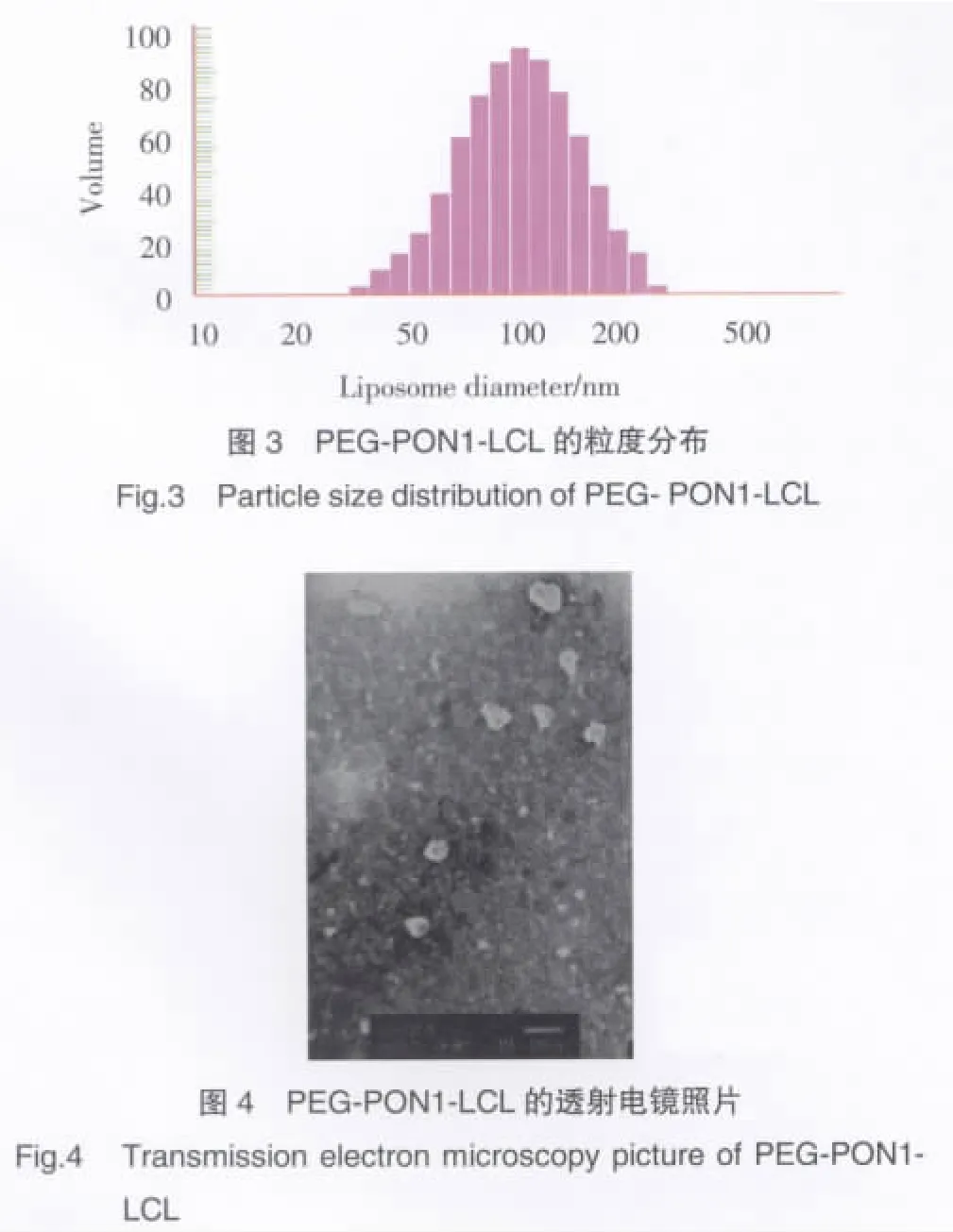
聚乙二醇化脂质体的粒度测定结果(见图3),其粒度分布呈单峰,粒度分布较窄,平均粒径为126 nm左右,Zeta电位为-19.35。透射电镜观察显示呈类球形(图4)。
2.6 PEG-PON1-LCL的初步稳定性研究
将聚乙二醇化脂质体溶液密封,4℃放置15 d后,聚乙二醇化脂质体未出现分层、沉淀现象。药物包封率和酶活性没有显著变化(见表8)。
3 讨论
PON1广泛存在于多种动物体内,主要由肝脏生成和分泌,在脑、肾、心、肝和肺脏等多种组织和器官中都有存在,但不同种属间血清PON1的活性差别很大,在哺乳动物中马和人血清中PON1的活性低,而以兔血清的PON1活性最高[7],这也是我们选择提纯兔血清PON1作为研究对象的主要原因。PON1是多任务蛋白的优秀代表[9],具有水解抑制胆碱脂酶的有机磷和预防低密度脂蛋白和高密度脂蛋白的氧化的功能。Furlong实验室的研究表明大肠杆菌重组人PON1比人天然的PON1对多种底物有更高的催化活性,这种高效的酶水解活性为救治生命和保护健康的催化剂治疗提供了希望[10]。
PON1是中分子量的酶蛋白,在体内外环境受多种复杂的化学或物理条件影响而易失活,因而有效保持酶的活性十分重要。本实验对对氧磷酶脂质体包裹时,充分考虑了温度和有机溶剂对酶活性的影响,一是整个实验条件选择在37℃以下,且选择了对酶活性影响不是很大的二氯甲烷作为有机溶剂,同时延长减压蒸发时间,减少了痕量有机溶剂的残留;二是因对氧磷酶是水溶性蛋白,对水溶性药物而言,药物的包封率取决于内水体积占总体积的比率,本实验应用了较高的磷脂浓度,有助于增加内水相体积所占的比例,从而提高了包封率。水溶性蛋白类药物包封率很低,但是本实验对氧磷酶长循环脂质体的包封率较高,接近90%,可能与对氧磷酶的分子结构有关,其机制有待进一步研究。
本实验采用琼脂糖凝胶柱层析方法测定对氧磷酶脂质体的包封率,主要根据含药脂质体和游离对氧磷酶分子大小的不同,渗入凝胶颗粒内部的程度亦不同,按照分子由大到小顺序流出,该方法操作简便,测定准确。
蛋白类药物与传统药物相比,不仅具有用药剂量小、疗效好、毒副作用低等突出优点,还具有药物半衰期短、清除率高、蛋白质药物体内外不稳定、易受体内酶和细菌以及体液的破坏等不同于传统药物的一些特性。本实验进行了脂质体的初步稳定性考察,以外观形状、包封率、酶活性等因素作为考察指标,4℃条件下密封放置15 d,以上指标均无显著性改变。PEG修饰长循环脂质体中的组成中,含有亲水性聚合物如聚乙二醇的二硬脂酸磷脂酰胺的衍生物等,能够逃避网状内皮系统的捕获,特别是在体内能阻止吞噬细胞对脂质体的识别和摄取,而极大延长脂质体在血液中循环时间,从而提高疗效,减轻不良反应。聚乙二醇化对氧磷酶长循环脂质体的体内药代动力学有待进一步研究。
本实验应用薄膜分散法制备了对氧磷酶长循环脂质体,其制备工艺简单,在酶活性稳定的前提下,以包封率为指标,对各处方因素进行了考察,并应用正交设计进行包封率优化,得到了较高的包封率,对氧磷酶长循环脂质体初步稳定性良好,酶活性基本稳定。
[1]赵敏,崔玥,袁丽.兔血清中对氧磷酶的提取和纯化[J].中国医科大学学报,2009,38(7):490-492.
[2]Rochu D,Chabrière E,Masson P.Human paraoxonase:A promising approach for pre-treatment and therapy of organophosphorus poisoning[J].Toxicology,2007,233(1-3):47-59.
[3]Rosenblat M,Karry R,Aviram M.Paraoxonase1(PON1)is a more potent antioxidant and stimulant of macrophage cholesterol efflux,when present in HDL than in lipoprotein-deficient serum:relevance to diabetes[J].Atherosclerosis,2006,187(1):74-81.
[4]CostaLG,ColeTB,JarvikGP,etal.Functionalgenomicsofthe paraoxonase (PON1)polymorphisms:Effects on pesticide sensitivity,cardiovasculardisease,anddrugmetabolism[J].AnnuRevMed,2003,54:371-392.
[5]Costa LG,McDonald BE,Murphy SD,et al.Serum paraoxonase and its influence on paraoxon and chlorpyrifos-oxon toxicity in rats[J].Toxicol Appl Pharmacol,1990,103(1):66-76.
[6]Li WF,Furlong CE,Costa LG.Paraoxonase protects against chlorpyrifos toxicity in mice[J].Toxicol Lett,1995,76(3):219-226.
[7]Kuo CL,La Du BN.Comparison of purified human and rabbit serum paraoxonases[J].Drug Metab Dispos,1995,23(9):935-944.
[8]EckersonHW,RomsonJ,WyteC,etal.Thehuman serum paraoxonase polymorphism:identification of phenotypes by their response to salts[J].Am J Hum Genet,1983,35(2):214-227.
[9]Chambers JE.PON1 multitasks to protect health[J].Proc Natl Acad Sci USA,2008,105(35):12639-12640.
[10]Stevens RC,Suzuki SM,Cole TB,et al.Engineered recombinant human paraoxonase1(rHuPON1)purified from Escherichia coli protects against organophosphate poisoning [J].Proc Natl Acad Sci USA,2008,105(35):12780-12784.
