丝胶预处理对DN大鼠肾脏细胞外基质相关蛋白表达的影响
2010-12-03陈志宏宋成军付秀美付文亮薛景凤
陈志宏,宋成军,付秀美,付文亮,薛景凤
(承德医学院 基础医学部解剖学教研室,河北 承德06 7000)
近年来糖尿病的发病率逐年上升,其中糖尿病肾病(diabetic nephropathy,DN)是导致慢性肾功能不全和终末期肾功能衰竭的主要原因[1,2]。DN的典型病理改变为肾小球毛细血管基底膜增厚、系膜细胞增生和系膜基质增多,导致结节性或弥漫性肾小球硬化,这些改变的组织学基础是细胞外基质(extracellular matrix,ECM)的进行性积聚。ECM积聚由ECM合成和降解两个方面决定,正常生理状态下,ECM产生和降解的动态平衡受到精细调控,糖尿病时由于糖代谢异常和多种细胞因子的参与,导致ECM产生增多、降解减少,引起ECM积聚[3]。本文采用链脲佐菌素(streptozotocin,STZ)致DN大鼠模型,观察彩色蚕茧提取物——丝胶预处理对DN大鼠肾脏ECM相关蛋白表达的影响,为DN的防治提供理论依据和实验基础。
1 材料与方法
1.1 实验动物分组及处理
清洁级雄性SD大鼠36只,由河北医科大学实验动物中心提供,合格证号:712024。将大鼠随机分为3组:正常对照组、DN模型组和丝胶预防组,每组12只。模型组和丝胶预防组大鼠均采用2%STZ(25 mg/kg,3 d)连续腹腔注射建立动物模型,以血糖≥16.7 mmol/L作为成模标准;丝胶预防组大鼠于注射 STZ 前给与丝胶(2.4 g·kg-1·d-1)灌胃35 d。
1.2 药物与试剂
丝胶由彩色蚕茧(承德医学院蚕业研究所提供)经浸泡、水煎、过滤、浓缩而成。STZ购于美国Sigma公司,临用时用pH 4.4的枸橼酸钠-枸橼酸缓冲液配成2%的溶液;血糖检测试剂盒,保定长城临床试剂有限公司;兔抗转化生长因子-β1(transforming growth factor-β1,TGF-β1)抗体、兔抗 Smad3 抗体、兔抗基质金属蛋白酶组织抑制因子-1(tissue inhibitors of maprix metalloproteinases-1,TIMP-1) 抗体,美国Santa公司(购自北京中杉金桥生物技术有限公司);Ⅳ型胶原 (typeⅣ collagen,cⅣ) 和层黏蛋白(laminin,LN)酶免疫试剂盒,上海森雄科技实业有限公司;BCA蛋白定量试剂盒,北京泰格美科技有限公司。
1.3 检测血液指标
各组大鼠禁食12 h以上,4%水合氯醛腹腔注射麻醉大鼠,经内眦于眶后静脉丛采血,3000 r/min离心20 min,收集血清。应用日本日立公司的Boehr inger Mannhe in/Hitachi 717全自动临床生化分析仪采用葡萄糖氧化酶法检测血糖,ELISA法检测cⅣ和LN。
1.4 测定肾质量/体质量
各组大鼠取血前称体质量,取血后断头处死,取双侧肾去掉包膜后称质量,计算肾质量/体质量。然后,一侧肾脏投入液氮中速冻,后移入-80℃冰箱保存,用于Western blot检测;另一侧肾脏入Bounin液固定,用于免疫组化染色。
1.5 肾脏相关蛋白表达的检测
1.5.1 免疫组化染色及定量分析:入Bounin液固定肾脏,常规石蜡包埋,连续切片,片厚5 μm。采用免疫组织化学染色方法检测肾脏TGF-β1和TIMP-1蛋白的表达。一抗为兔抗,稀释浓度为1∶100,DAB显色,苏木素复染细胞核。以PBS代替一抗作为阴性对照,以胞质中出现棕黄色颗粒为阳性反应。采用MiVnt图像分析系统对免疫组化阳性结果进行定量分析:切片在×400显微镜下选取肾小球,计算阳性产物面积占肾小球面积的百分比。每只动物任选3张切片,每张切片选取3个肾小球,取平均值。
1.5.2 肾脏Smad3蛋白表达的检测:取200 mg肾脏组织,提取蛋白,以BCA蛋白试剂盒定量蛋白浓度。采用Western blot方法检测大鼠肾脏Smad3蛋白的表达,蛋白上样量为60 μg。12%SDS-PAGE凝胶电泳、转膜;一抗稀释浓度为1∶200,4℃过夜;Super ECL Plus超敏发光液显影。采用Quantiy One软件对显影条带进行分析,以Smad3条带与βactin条带的灰度比值作为Smad3蛋白的相对表达水平。
1.6 统计学分析
2 结果
2.1 各组大鼠的肾质量/体质量
与正常对照组大鼠相比,模型组大鼠的肾质量/体质量明显升高(P<0.01);丝胶预防组大鼠的肾质量/体质量明显低于模型组(P<0.01)。见表1。

2.2 各组大鼠血液指标检测结果
与正常对照组大鼠相比,模型组大鼠的血糖、cⅣ和LN均明显升高(P<0.01);丝胶预防组大鼠的血糖、cⅣ和LN明显低于模型组(P<0.01)。见表1。
2.3 各组大鼠肾脏Smad3蛋白的表达
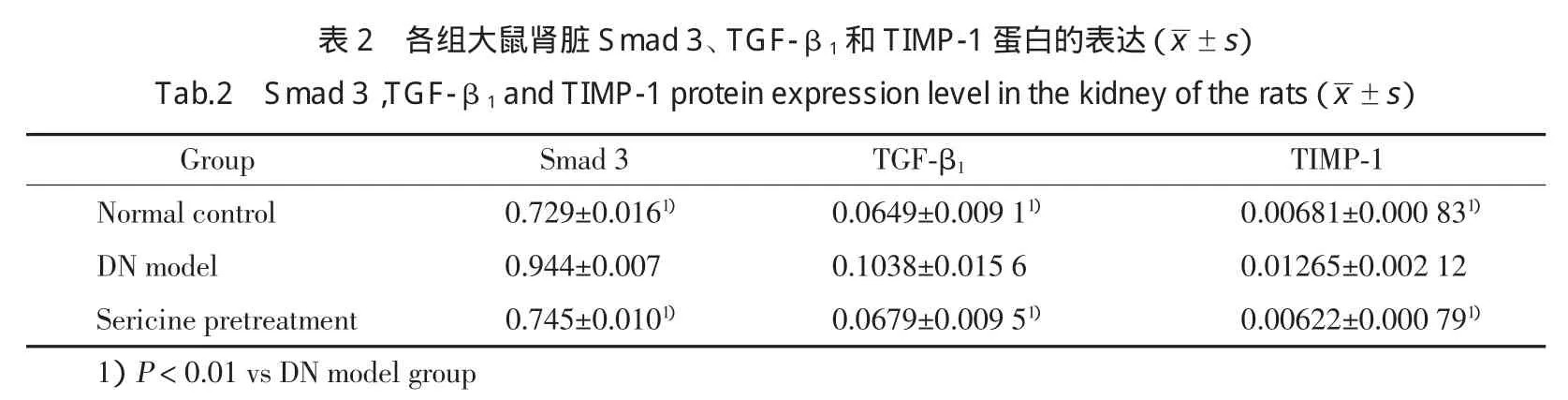
在蛋白Marker的55 kDa水平处,可见Smad3蛋白条带;在蛋白Marker的43 kDa水平处,可见βactin条带(图1)。模型大鼠肾脏Smad3蛋白的表达明显高于正常对照组大鼠(P<0.01),丝胶预防组大鼠肾脏Smad3蛋白的表达明显低于模型组大鼠(P<0.01)。见表2。
2.4 各组大鼠肾脏TGF-β1蛋白的表达
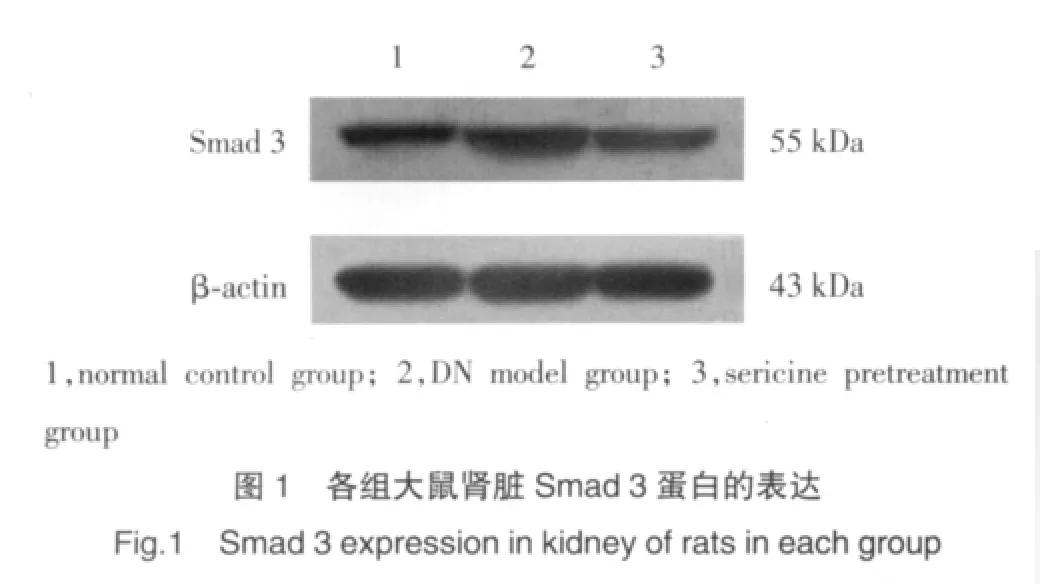
TGF-β1免疫阳性产物呈棕黄色细腻颗粒状,位于细胞质;TGF-β1免疫阳性细胞包括肾小球囊壁层上皮细胞、足细胞和球内系膜细胞。与正常对照组大鼠相比,模型大鼠肾脏(图2)TGF-β1蛋白的表达明显增高(P<0.01);丝胶预防组(图3)大鼠肾脏TGF-β1蛋白的表达明显低于模型大鼠(P<0.01),见表2。

2.5 各组大鼠肾脏TIMP-1蛋白的表达
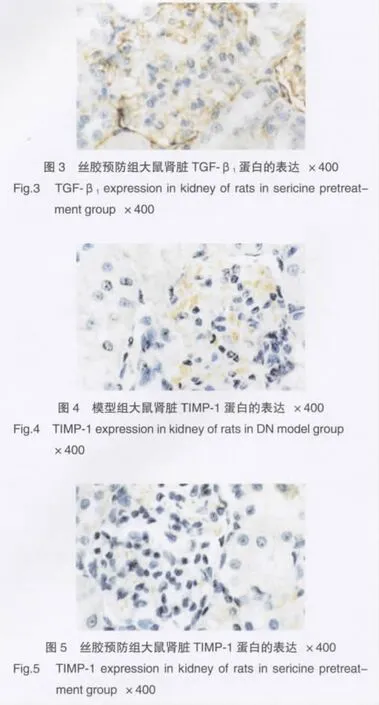
TIMP-1免疫阳性产物呈棕黄色细腻颗粒状,位于细胞质,免疫阳性细胞为肾小球球内系膜细胞。与正常对照组大鼠相比,模型大鼠(图4)肾脏TIMP-1蛋白的表达明显增高(P<0.01);丝胶预防组(图5)大鼠肾脏TIMP-1蛋白的表达明显低于模型大鼠(P<0.01)。见表2。
3 讨论
ECM家族有四大成员:胶原蛋白、弹性蛋白质、蛋白多糖和结构糖蛋白。他们不仅是细胞外的惰性充填物,还具有活跃的生物活性,参与细胞的运动、增殖、分化等,并可介导细胞与细胞、细胞与生物分子之间的相互作用,在胚胎发育和各种生理及病理过程中发挥重要作用[4]。机体内有多种细胞因子和酶参与ECM的合成与降解,从而维持正常生理条件下ECM的动态平衡,TGF-β1/Smad3信号通路和MMPs/TIMPs就是其中的重要成员。
TGF-β的胞内信号转导有Ⅰ型和Ⅱ型受体(TGF-βRⅠ和 TGF-βRⅡ)参与;Smad家族蛋白是新近发现的参与TGF-β家族在细胞内信号转导的蛋白质,在将TGF-β信号从细胞表面受体转导至细胞核的过程中起关键作用[5]。TGF-β可通过与自身受体结合,进而磷酸化Smad蛋白并与之形成复合物,激活合成ECM等成分的活性[6]。研究证明,糖尿病大鼠肾脏中TGF-β1/Smda3信号通路处于激活状态,激活的TGF-β1/Smad3信号通路可增加ECM各成分的表达,加速ECM进行性积聚,从而导致肾小球硬化,最终导致终末期肾病的发生[7]。
基质金属蛋白酶(matrix matalloproteinases,MMPs)几乎可以降解除多糖以外的全部ECM成分,其表达下调或者酶活性过度受抑,可引起ECM积聚,导致肾小球硬化[4]。TIMPs是肾内调节MMPs活性的主要物质,它可与MMPs形成MMP-TIMP复合体,阻断MMPs与底物的结合和活化,参与调节ECM的代谢过程。在肾脏对MMPs发挥抑制作用的主要是TIMP-1。DN时,肾脏Ⅳ型胶原和TIMP-1 mRNA的表达明显增强,通过直接抑制ECM降解和降低MMPs的活性,引起ECM降解减少、积聚增加,久之发生肾小球硬化和肾功能衰竭[8,9]。
蚕丝是人类最早利用的天然蛋白质之一,主要由两条丝素和周转覆盖的丝胶两部分组成。以往的研究主要集中在丝素方面,约占茧丝30%的丝胶作为废料丢弃,浪费了大量的生物资源。丝胶的主要成分丝胶蛋白(通称丝胶)为高分子水溶性蛋白,由18种氨基酸组成。目前对丝胶的研究主要集中在美容、护肤、营养与保健等方面;在治疗糖尿病方面的作用,仅有国内学者进行了初步探讨,发现丝胶可有效降低血糖[10,11]。本研究发现,丝胶预防组大鼠血清ECM成分cⅣ和LN的含量、肾脏Smad3、TGF-β1和TIMP-1蛋白的表达明显低于DN大鼠(P<0.01)。这表明,丝胶预处理可抑制DN肾脏中TGF-β1/Smad3信号通路的激活,防止TIMP-1蛋白高表达导致的MMPs活性的降低,从而预防DN时ECM的积聚和肾小球硬化,对DN的发生发展具有良好的预防作用。由于丝胶是天然的蛋白质,具有生物相容性,可生物降解,对人体无毒性,避免了化学合成药物带给人体的不良反应,因此具有良好的应用推广前景。
[1]Futrakul N,Butthep P,Futrakul P,et al.Improvement of renal function in type2diabetic nephropathy[J].Ren Fail,2007,29(2):155-158.
[2]Rossert J,Froissart M,Jacquot C.Anemia management and chronic renal failure progression [J].Kidney Int Suppl,2005,(99):S76-S81.
[3]魏聪,吴以岭,冯书文,等.系膜细胞外基质与糖尿病肾病[J].辽宁中医药大学学报,2008,10(1):8-10.
[4]Catania JM,Chen G,Parrish AR.Role of matrix metalloproteinases in renal pathophysiologies [J].Am J Physiol Renal Physiol,2007,292(3):F905-F911.
[5]Wang A,Ziyadeh FN,Lee EY,et al.Interference with TGF-beta signaling by Smad3-knockout in mice limits diabetic glomerulosclerosis without affecting albuminuria [J].Am J Physiol Renal Physiol,2007,293(5):F1657-F1665.
[6]Runyan CE,Schnaper HW,Poncelet AC.Smad3 and PKC delta mediate TGF-beta1-induced collagenⅠexpression in human mesangial cells[J].Am J Physiol Renal Physiol,2003,285(3):413-422.
[7]Isono M,Chen S,Hong SW,et al.Smad pathway is activated in the diabetic mouse kidney and Smad3 mediates TGF-beta-induced fibronectin in mesangial cells[J].Biochem Biophys Res Commun,2002,296(5):1356-1365.
[8]Ji L,Yin XX,Wu ZM,et al.Ginkgo biloba extract prevents glucoseinduced accumulation of ECM in rat mesangial cells [J].Phytother Res,2009,23(4):477-485.
[9]Rysz J,Banach M,Stolarek RA,et al.Serum matrix metalloproteinases MMP-2 and MMP-9 and metalloproteinase tissue inhibitors TIMP-1 and TIMP-2 in diabetic nephropathy [J].J Nephrol,2007,20(4):444-452.
[10]朱良均,姚菊明,李幼禄.蚕丝蛋白的氨基酸组成及其对人体的生理功能[J].中国蚕业,1997,69(1):42-44.
[11]张雨青.丝胶蛋白的药理及其在医用材料上的应用[J].纺织学报,2003,24(3):278-280.
