荧光探针技术在水溶液两亲分子有序组合体研究中的应用
2010-11-30黄建滨
赵 莉 阎 云 黄建滨
(北京大学化学与分子工程学院,分子动态与稳态结构国家重点实验室,北京 100871)
荧光探针技术在水溶液两亲分子有序组合体研究中的应用
赵 莉 阎 云*黄建滨*
(北京大学化学与分子工程学院,分子动态与稳态结构国家重点实验室,北京 100871)
总结了荧光探针技术在两亲分子有序组合体研究中的应用.在两亲分子有序组合体研究中,荧光技术的应用非常广泛.尤其是荧光探针技术的应用,为两亲分子有序组合体微观信息的获取提供了一个简单便利的渠道.根据荧光探针分子的荧光光谱,如最大发射波长、荧光强度及荧光寿命等参数,可以得到临界聚集浓度、微粘度、微极性等信息;根据探针的荧光猝灭,尤其是时间分辨荧光猝灭技术,可探测有序组合体的聚集数、聚集数变化相应的聚集体转化及表面电荷等信息.近年来发展起来的含荧光基团的两亲分子因其可以对聚集体微环境进行原位检测而引起了了广泛的关注.本文对上述几个方面的相关工作分别作了介绍.
荧光探针;猝灭;有序组合体;两亲分子;聚集体转变;表面活性剂
近年来,溶液中两亲分子有序组合体的研究正成为物理、化学、生物三大基础学科共同瞩目的领域.由于两亲分子具有既亲水又亲油的特点,在水溶液中可以通过疏水相互作用自组装形成胶束、囊泡、液晶、微乳等多种有序结构[1].在这些有序组合结构中,两亲分子的疏水基团聚集形成疏水微区,而其亲水基团则与周围水环境直接接触.由于体系中存在亲水、疏水两种环境,在合适的条件下,亲水、疏水物质可以增溶在分子有序组合体的不同位置,而溶解在两亲分子有序组合体中的物质往往表现出与其在宏观体系中迥异的性质.因此系统研究两亲分子有序组合体微环境的性质对于更好地了解及利用两亲分子有序组合体非常重要.然而,由于两亲分子有序组合体的尺寸通常在几到几十纳米之间,且与大量的溶剂共存,常规手段对这些纳米尺度的粒子的环境特性研究显得无能为力.荧光探针方法就是在这种背景下出现的.经过近30年的发展,荧光探针技术的理论与技术的不断进步,在分子有序组合体的微观环境研究方面得到了广泛的应用.本文结合本课题组的一些工作简要回顾这一领域的研究进展.
1 荧光探针技术概述
荧光探针分子是一类含有平面共轭结构的有机分子,在紫外或可见光激发下能够发射荧光.图1给出了几种常见的荧光探针分子的结构简式.这些分子的荧光性质对其所处环境非常敏感,因此可以根据荧光参数的变化探测两亲分子有序组合体微观环境的变化.
运用荧光探针技术,一般是向待测两亲分子体系中加入极少量的探针分子,使探针的含量远远低于两亲分子,保证探针的加入不显著影响聚集体的性质.根据探针分子在分子有序组合体中表现出的稳态和瞬态发光性质及猝灭情况,可以分别得到分子有序组合体中分子排列的紧密程度、相转变以及分子有序组合体大小、形貌转变等信息.近年来发展起来的原位荧光探针技术通过把荧光基团引入两亲分子结构的不同位置中,则能够更加准确地获得分子有序组合体不同区域的环境信息.
此外,荧光猝灭(fluorescence quenching)技术在荧光探针方法的发展和应用中有着举足轻重的作用.基态荧光分子与猝灭剂通过弱的结合生成复合物,从而使荧光强度降低的现象称为静态猝灭(static quenching).激发态荧光分子与猝灭剂碰撞使其荧光猝灭则称为动态猝灭(dynamic quenching).通过分析探针分子的荧光衰减曲线,可以得到分子有序组合体大小及类别等结构信息[2].
总之,荧光探针技术因具有灵敏度高、扰动小、无破坏性、可测量参数丰富等优点[2-4],在各种分子有序组合体研究方面有着广泛的应用.下面结合荧光探针技术的服务目的介绍几种主要的荧光技术在两亲分子有序组合体研究中的应用.
2 分子有序组合体临界聚集浓度、微极性及微粘度的测定
2.1 临界聚集浓度及微极性的测定
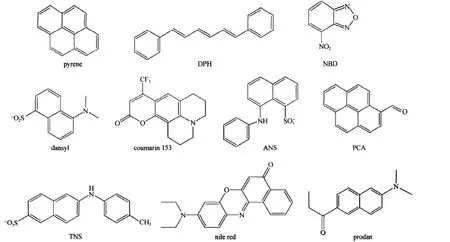
图1 几种常见的荧光分子结构简式Fig.1 Molecular structures of several fluorescence probes

图2 Prodan的未发生电荷分离激发态(LE state)和发生电荷分离激发态(ICT state)的结构简式[25]Fig.2 Local excited(LE)and intra-molecular charge transfer(ICT)structures of prodan[25]
许多荧光探针分子的荧光发射光谱对所处环境的极性非常敏感,检测探针分子的最大发射波长(λmax)、荧光寿命、荧光强度等的变化,可以得到聚集体内探针加溶位置的微极性(micropolarity)[5-7].常用的探针有pyrene(芘)、PCA、ANS(图1)等,其中pyrene的第一和第三振动带峰强度比值(I1/I3)是最常用的一个参量[8-16].Pyrene的荧光光谱具有特征的五峰结构,在不同极性的微环境中各荧光发射峰的相对强弱不同[17].其中,第一振动带I(373 nm)和第三振动带III(384 nm)峰强度的比值I1/I3对环境变化最为敏感[18](随极性降低而减小).将pyrene在分子有序组合体中的I1/I3值与其在不同极性有机溶剂中的数值进行比较,就可以估计出其加溶位置处的极性与哪种有机溶剂类似[19].此外,测定I1/I3值随两亲分子浓度的变化,突变点即可认为是该两亲分子的临界聚集浓度(critical aggregate concentration,cac)[9-16,19].具体工作中可以通过选择不同的探针,使其加溶在聚集体的不同位置,得到相应位置微极性的信息[19].另外,荧光寿命也可以进行微极性测定[19].
分子内电荷转移(intra-molecular charge transfer, ICT)化合物的溶致变色效应也可以用来测定微极性[20].探针分子本身带有一强吸电子基团和给电子基团[21-24].在不同极性的溶剂中,由于溶剂分子的偶极作用,处于激发态的ICT化合物分子内发生不同程度的电荷分离.因此,ICT分子被激发后,荧光发射光谱表现为未发生电荷分离的激发态(local excited state,LE state)和发生电荷分离的激发态(ICT state)的共同发射,表现出其发射最大波长随溶剂极性发生改变(图2)[25].一般来讲,极化程度越高,ICT态的荧光发射越红移.因此,ICT化合物的最大发射波长对其所在环境的极性极为敏感,荧光寿命和量子产率也可用于探测所在环境的极性[26].常用ICT荧光探针有prodan[25,27]、nile red[28-29]、coumarin153[30]、dansyl[31]、TNS[32]及ANS[33]等.
2.2 微粘度测定
对于给定的荧光分子,其“吸收跃迁矩(absorption transition moment,MA)”和“发射跃迁矩(emission transition moment,ME)”具有固定的取向并取决于电子跃迁的本质,即取决于分子的结构.均相溶液中,所有荧光分子的基态都是随机取向的.若用偏振光照射荧光物种,具有平行于入射光电子矢量的MA会被优先激发.因此,激发态荧光物种的取向不再具有随机性,其发射光也具有偏振性.偏振的程度取决于分子的扩散运动,即分子在溶液中的旋转难易程度,这与荧光分子所在环境的粘度、荧光分子自身的尺寸和形状有关[34].因此,对于给定的荧光物种,其偏振的程度主要取决于所在环境的粘度.因此利用荧光探针可以来测定介质的微粘度.选用合适的荧光探针,测定其荧光各向异性值(r)和荧光寿命(τ),通过公式(1)

就可以计算出探针分子所在环境的微粘度(microviscosity,ηm).其中,r0为探针分子的固有各向异性(intrinsic anisotropy),kB是Boltzmann常数,T是绝对温度,V表示探针的有效分子体积.多数情况下,可以直接应用各向异性值来表示环境的微粘度[20].一般来讲,荧光各向异性值越大,其微环境的粘度越大.DPH(见图1)是最常用的探针[35-36].
早期的工作中[37-38],我们发现SDe/DeTAB(十酸钠/十烷基三甲基溴化铵)等量混合体系自发形成胶束,超声处理后转变为囊泡.Pyrene的I1/I3测定发现超声前后微极性相同.这是因为探针都处在由碳氢链组成的非极性环境中,无法通过测定微极性来区别胶束和囊泡.但是,囊泡中表面活性剂分子排列更加紧密,探针分子的自由转动受限,表现出更大的微粘度,因而借助微粘度的测量对二者加以区分.对多个体系进行测定,结果如表1所示[37].对于超声后胶束转变为囊泡的SDe/DeTAB体系,微粘度发生了显著的变化;而超声前后均形成囊泡的SL/ OTAB(月桂酸钠/八烷基三甲基溴化铵)体系的微粘度没有变化;超声前后均形成胶束的SDS(十二烷基硫酸钠)体系的微粘度也没有发生显著的变化.

表1 20℃时几种表面活性剂溶液的微粘度(ηm)[37]Table 1 Microviscosity(ηm)of surfactant solutions at 20℃[37]
我们还设计合成了荧光探针2-[2-(4-二甲氨苯基)乙烯基]-2-苯基丙二腈(结构简式如图3所示),该探针的荧光最大发射波长、荧光强度与环境的粘度存在定量关系[38],可以用来研究SDe/DeTAB等表面活性剂混合体系中不同有序组合体的转变.
微粘度的测定也可以通过激基缔合物(excimer)的形成来完成.激基缔合物是指一个处于激发态的荧光分子和另外一个基态分子相互作用,形成所谓“三明治”结构的复合物,在荧光光谱上表现为一个无精细结构的“馒头峰”.激基缔合物的形成需要合适的分子构象,荧光发射强度依赖于构象改变的速率,即探针分子所处微环境对其分子运动的阻力.因此,激基缔合物与单体(monomer)发射强度的比值(IE/IM)对其所处微环境的粘度敏感(值越大,微粘度越小)[39].
利用IE/IM值也可以监测表面活性剂溶液中预胶束及胶束的形成[38,40-41].我们分别测定了 SDe/ DeTAB以及SL/OTAB等量混合体系的IE/IM随浓度的变化(图4),检测表面活性剂溶液中预胶束及胶束的形成[38].从图4中可以看出存在一个极大值,这是因为浓度增大至预胶束形成时,由于pyrene的疏水性,出现多个探针增溶于一个预胶束的情况,激发态缔合物的发射最强.随着胶束数目的增加,多个探针加溶于同一胶束内的几率下降,所以激发态缔合物的发射强度减弱.因此出现了先增大后减小,存在极大值(对应于临界胶束浓度(cmc))的情况.
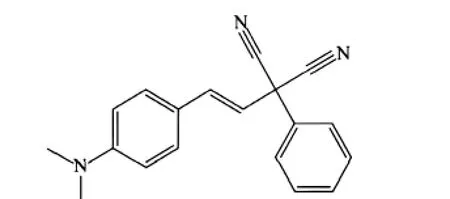
图3 2-[2-(4-二甲氨苯基)乙烯基]-2-苯基丙二腈的结构简式[38]Fig.3 Molecular structure of p-N,N-dimethylaminostyrylphenylmalononitrile[38]

图4 三种体系的IE/IM值随浓度的变化[38]Fig.4 Variation of IE/IMvalues with concentration in three systems[38](a)SDe/DeTAB system;(b)SL/OTAB system;(c)octanol solution
在激发光谱的吸收范围内,逐渐红移激发波长,荧光物种的最大发射波长也随之红移的现象称为红移激发漂移(red edge excitation shift,REES).具有REES现象的典型荧光物种是NBD(见图1)及其衍生物[42].当极性荧光物种处于限域(介质),如粘度很高的体系中时,荧光分子的重取向很慢,使得溶剂的偶极驰豫时间相当于或大于荧光物种本身的荧光寿命,因此此类荧光物种的REES程度(改变激发波长,观察到的最大发射波长的改变量)可以反映其所处微环境的粘度[43].
3 分子有序组合体聚集数的测量
利用荧光探针猝灭技术可以测定表面活性剂的聚集数.当表面活性剂溶液中某一种特定分子有序组合体,如胶束的数目符合泊松分布(Poisson distribution)时,猝灭只发生在同时含有探针和猝灭剂的胶束中.这样,每个胶束中含有的平均猝灭剂分子数n(平均占有数)可表示为胶束中猝灭剂的浓度与总胶束浓度的比值.
3.1 静态荧光猝灭技术
运用静态荧光猝灭(static fluorescence quenching)技术,荧光强度的降低反映了同时含有探针和猝灭剂分子的胶束的数目.在一定表面活性剂浓度[S]及较小探针浓度下,逐步增加猝灭剂的浓度[Q],运用公式

其中I0是无猝灭剂时的荧光强度,I是加入猝灭剂后的荧光强度,cmc为临界胶束浓度.利用ln(I0/I)对 [Q]作图,由斜率即可确定聚集数(Nagg).
静态荧光猝灭法具有简单快捷的优点,而且测定的数据与聚集体之间的相互作用无关,因此可以测定不同浓度聚集体的聚集数[44-49].运用静态荧光猝灭应满足以下前提条件:探针和猝灭剂在水中的溶解度可以忽略不计;胶束的聚集数不大(一般小于100).
近年来,随着对表面活性剂混合体系了解的深入,人们发现这类体系中经常存在尺寸和聚集数较大的聚集体[50-60].例如,阴阳离子表面活性剂混合体系中的胶束基本都是较大的棒状或蠕虫状胶束,同时还有尺寸更大的囊泡等高级有序组合体[51-55,57-58,61].参照运用光散射技术测定高分子质均分子量的方法,将两亲分子聚集体看作一个“高分子”,求出其“分子量”.再除以单体分子的分子量,即可得到聚集体的聚集数.该方法用于混合表面活性剂体系时会引入较大误差,一般认为光散射不能用来测定混合体系的聚集数.因此,要准确地深入了解这些有序组合体的性质,就需要采用动态的时间分辨荧光技术进行研究.
3.2 时间分辨荧光猝灭技术
时间分辨荧光猝灭(time-resolved fluorescence quenching,TRFQ)技术是通过测定探针的荧光衰减曲线,选用合适的动力学模型进行数据分析,可得到较为准确的胶束聚集数和尺寸的信息.时间分辨荧光猝灭是唯一能够直接对聚集数进行测量的方法[62],已广泛应用于测定水溶液、油/水及微乳液中表面活性剂聚集体的聚集数和尺寸[19,63-64].
在胶束等小聚集体的单分散体系中,荧光衰减来自同时含有一个探针分子和猝灭剂分子的胶束,用Infelta-Tachiya方程[65-67]来表示荧光的衰减:

其中A2和A4是与猝灭剂浓度无关的常数,A3表示为下式:

其中cm代表胶束化的表面活性剂浓度,由总浓度(ctotal)减去临界聚集浓度(cac)值得到.A3由荧光衰减曲线拟合得到,利用式(4)计算出聚集数Nagg.
利用时间分辨荧光技术可以测量具有丰富有序组合体结构的阴阳离子表面活性剂混合体系的聚集数,对于了解有序组合体的性质具有十分重要的意义.在我们早期的工作中,利用TRFQ测得SDe/ DeTAB等摩尔混合形成的胶束聚集数约为798[37].显然,这个数字对于球型胶束而言是过大的,结合光散射的测量结果(体系中质点的水合半径为20 nm),可以推测体系中形成的是棒状胶束.后来,我们在SDS/DEAB(十二烷基硫酸钠/十二烷基三乙基溴化铵)(73∶27)混合体系中采用类似的方法对体系中不对称胶束进行了研究[68].利用TRFQ测量了该体系总浓度120 mmol·L-1时的胶束聚集数Nagg=400±10,并结合流变和动态光散射的结果推测出胶束的形状是不对称的短棒状[69].
囊泡或其它较大的单分散聚集体内,每个探针分子在其激发态寿命内遭遇到的猝灭剂的平均数目是等同的,这种情况用Stern-Volmer公式[66,70-73]来表示:

其中A5、A6都依赖于猝灭剂的浓度,A5为Stern-Volmer相关参数,A6被定义为“扩散损耗项”.对于单一较大聚集体,荧光强度对猝灭剂浓度呈现单指数衰减.
在两亲分子有序组合体的单分散体系中,可以直接利用公式(3)和(5)进行聚集数的测定.然而,很多情况下,尤其是在阴阳离子表面活性剂混合体系,往往同时存在多种有序结构,如聚集数较小的胶束和聚集数较大的囊泡,并且在某些外界条件如温度、添加剂等改变时会发生聚集体的相互转变[56-61,74-75].不同有序组合体之间的转化具有重要的意义,由于透射电镜对于了解囊泡的数密度定量准确度较差,因此相关表征较为困难.巧妙利用时间分辨荧光猝灭技术可以为我们解决这个难题.
在多分散体系中,如囊泡和胶束共存的情况,荧光衰减为不同尺寸聚集体的贡献之和.此时荧光猝灭情况由Infelta-Tachiya方程和Stern-Volmer方程的线性组合来表示.但是由于参数较多,很难用来进行定量分析.如果强行用方程(3)来拟合荧光衰减曲线, A4值就表现出对猝灭剂浓度和囊泡占聚集体总数的比例的依赖[76].A4对猝灭剂浓度作图,斜率越正,囊泡所占比例就越大[77].所以,据此可以定性和半定量地确定囊泡在体系中所有聚集体的比例,深入了解多种有序组合共存体系中聚集体形态的变化[70-71,76].
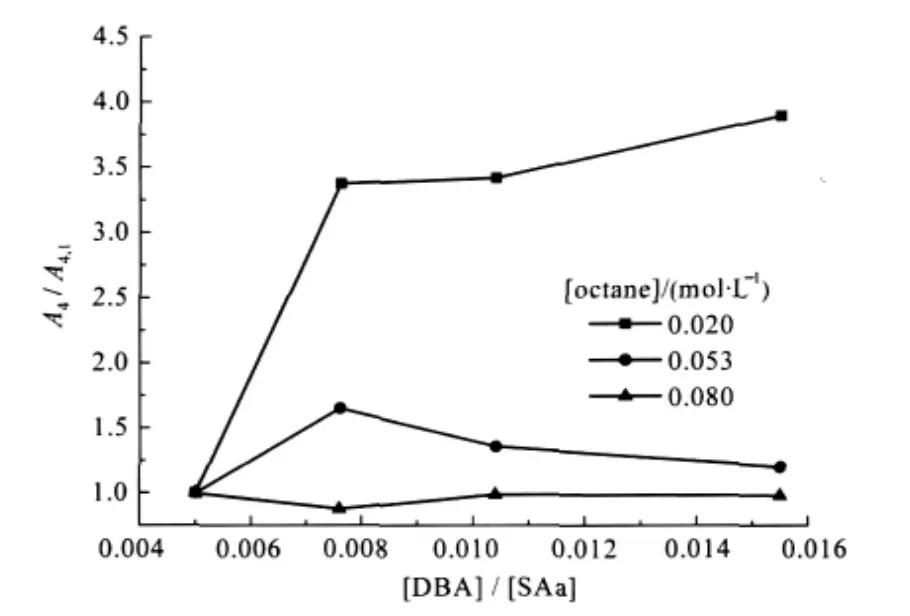
图5 不同辛烷浓度时A4/A4,1随猝灭剂浓度与表面活性剂浓度比值[DBA]/[SAa]的变化曲线[70]Fig.5 Variation of A4/A4,1as a function of quencher concentration for different octane concentrations[70] [DBA]:concentration of the quencher dibutylaniline; [SAa]:total concentration of SL/DTAB system; A4,1is the value of A4when[DBA]/[SAa]=0.005.

图6 不同辛醇含量时A4/A4,1随猝灭剂与总浓度比值η(η=[Q]/ctotal)变化的归一化曲线[71]Fig.6 Normalized value of the parameter A4/A4,1as a function of η(η=[Q]/ctotal)with various concentrations of the added octanol[71]A4,1is the value of A4when η=0.002 for the system SDS/DEAB (ctotal=10 mmol·L-1,xDEAB=0.25).
我们在SL/DTAB(月桂酸钠/十二烷基三甲基溴化铵)和SL/DPCl(月桂酸钠/十二烷基氯化吡啶)双水相体系中加入辛烷,发现随着加入量的增加,A4随猝灭剂浓度的增加的变化幅度变小(图5),表明辛烷的介入使得体系中囊泡/胶束的比例降低,说明体系中发生了囊泡向胶束的转变[70].结合流变的结果最终确定体系中发生了由囊泡经不对称胶束(棒状)到对称胶束(球形)的转变过程.采用类似的组合表征手段,还证明了辛醇的加入可以在SDS/DEAB体系中实现胶束向囊泡的转化(图6)[71].上述工作是时间分辨荧光技术在表面活性剂混合体系研究中的一个重要应用,也是对阴阳离子混合体系有序组合体研究的一个突破.
4 聚集体表面电荷密度的测定
在胶体化学领域,通常用zeta电势来表征胶体粒子表面带电的电性和电量.对满足一定条件的两亲分子有序组合体也同样适用,定性和半定量地确定聚集体表面的电性和电量.样品浓度较大、聚集体间相互作用不可忽略的体系不适合用zeta电位仪进行测定.
目前常用的另一种测定聚集体表面电荷的方法是通过荧光猝灭效率的高低来反映聚集体表面电荷性质.向含探针分子的有序组合体体系中,加入亲水性带电猝灭剂分子.通过测定荧光强度的变化,可以定性考察聚集体表面带电荷的情况(电荷密度和电性)[78-80].这种方法受反离子浓度、聚集体大小和形状影响较小,适用范围更广.我们用pyrene为探针, S2O2-3作为带负电的水溶性猝灭剂,通过荧光猝灭法研究阴离子对囊泡聚集的影响[78].当聚集体表面带正电时,S2O2-
3可以有效地对pyrene进行猝灭.然而当聚集体带负电时,pyrene的荧光不被猝灭. n(SMA,苯乙烯-马来酸酐共聚物)∶n(DEAB)=4∶6, ctotal=2.5 mmol·L-1体系中的猝灭情况如图7b中曲线所示,带负电的猝灭剂不能有效地接近囊泡表面,因而阴离子不能诱导囊泡聚集.
另外,我们向正负混合表面活性剂SDS/DEAB体系中加入β-环糊精(β-CD),实现了聚集体由球状胶束向蠕虫状胶束再到囊泡的转变[79].选择pyrene作为探针,分别向SDS过剩、DEAB过剩的体系中加入Cs+和S2O2-3作为猝灭剂,发现猝灭效率随着β-CD的加入都明显降低(图8),说明两种猝灭剂都不能有效地接近聚集体表面.这证明β-CD可以选择性地结合过剩的表面活性剂,使聚集体的组成趋向于等比例、电中性.由临界排列参数(p=V/a0lc,其中V为疏水基体积;a0为分子平均头基面积;lc为疏水基碳氢链长度)可知,当正负混合表面活性剂体系趋于电中性时,由于静电相互作用,a0减小,p参数变大,倾向于形成较大的聚集体.同样,我们选择SL/ C12C6C12(Et)(月桂酸钠/六亚甲基-1,2-二(十二烷基二乙基溴化铵))(3∶7)复配体系,加入10 mmol·L-1硼砂恒定pH为9.2.当加入1%甘油时,甘油和硼砂发生反应,生成了大量H+,使聚集体表面正电荷密度增高.于是,就出现了随甘油含量的增加,Cs+的猝灭效率基本不变、的效率明显提高的现象(表2)[80].
5 原位荧光表面活性剂探针

图7 S2O2-3对不同表面电荷聚集体中pyrene的荧光猝灭作用[78]Fig.7 Fluorescence quenching of pyrene located in different charged aggregates by S2O2-3[78](a)in DEAB and in SL systems;(b)in SMA/DEAB system
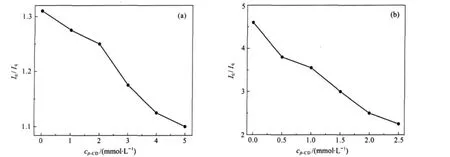
图8 SDS/DEAB体系β-CD含量与猝灭效率的关系曲线[79]Fig.8 Variations of quenching efficiency(I0/Iq)with the addition of β-CD to SDS/DEAB system[79] (a)xSDS=0.8,ctotal=10 mmol·L-1,(b)xSDS=0.1,ctotal=10 mmol·L-1
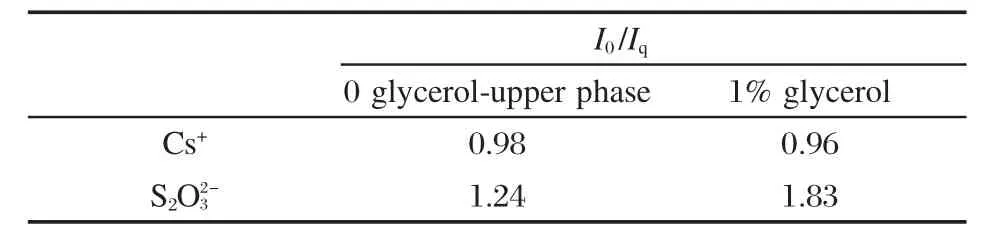
表2 SL/C12C6C12(Et)体系加入1%甘油荧光猝灭效率(I0/Iq)的变化[80]Table 2 Variation of quenching efficiency(I0/Iq)with addition of 1%glycerol to the SL/C12C6C12(Et)system[80]
传统荧光探针,如pyrene和DPH等,在探测两亲分子有序组合体微观信息方面扮演着十分重要的角色.但是,它们在提供许多重要荧光信息的同时,仍存在很多的局限.例如,经验表明,这些荧光探针经常加溶在两亲分子的极性头基附近的栅栏层,因此,不能够准确反映分子有序组合体深处疏水区域的环境变化.因此,如果在两亲分子结构中特别是靠近疏水链尾部引入一个合适的荧光基团,使其能够参与聚集体的形成,这样就能够固定荧光基团在聚集体中的位置,从而更为准确地反映聚集体内部的微环境信息.我们针对这种情况设计合成了尾端含有丹磺酰基团的阴离子表面活性剂12-DAN-ADA (图9)[81].

图9 含丹磺酰基团的阴离子表面活性剂12-DAN-ADA结构简式Fig.9 Molecular structure of anionic surfactant 12-DAN-ADA containing dansyl
丹磺酰是一种典型的ICT化合物,其发射光谱的形貌和最大发射波长与所处环境的极性关系极其密切.极性增加,最大发射波长红移.另外,其各向异性值也对环境的粘度较为敏感.将少量这样的分子加入到不同链长的表面活性剂体系中,探针所处位置可由探针分子与表面活性剂分子的相对长度确定,即可以固定探针在聚集体中的位置,从而保证荧光信号的变化来自于聚集体的变化.如图10所示,当发生胶束/囊泡转变时,12-DAN-ADA探针的荧光各向异性r、最大发射波长λmax均发生显著突变,而传统探针DPH和pyrene则不能提供具有显著差别的荧光结果.所以与传统探针DPH和pyrene相比,12-DANADA作为荧光探针对微环境的变化更为灵敏.

图10 SDS/DEAB体系中,DPH和12-DAN-ADA的r(a)和12-DAN-ADA的λmax和pyrene的I1/I3值(b)[81]Fig.10 Fluorescence anisotropy of DPH and 12-DAN-ADA(a)and emission maxima of 12-DAN-ADA and I1/I3of pyrene(b)in the SDS/DEAB system[81]
6 其它荧光探针技术
6.1 荧光共振能量转移
荧光共振能量转移(fluorescence resonance energy transfer,FRET)是一种非辐射能量转移,来源于处于激发态的能量给体(donor)和处于基态的能量受体(accepter)之间发生的偶极-偶极相互作用[82],使能量从激发态的给体转移给基态受体.FRET的发生要求能量给体的发射光谱同能量受体的吸收光谱有部分重叠.重叠程度越大,FRET发生的效率越高.当给体被激发时,通过分子偶极间的相互作用,将能量传递给受体,在光谱上表现为受体的发射光谱.
我们利用疏水修饰的NBD和罗丹明B作为D-A对,利用FRET研究了囊泡的聚集和分散过程(图11)[83].图11a中I589/I535=0.84,该荧光能量转移来自于加溶于同一囊泡内的给体和受体分子之间.加入Ca2+后(图11b),荧光能量转移的增加来自于给体和受体的距离的减小,说明聚集体之间的距离减小,发生了囊泡的聚集.而加入EDTA后(图11c),由于EDTA与Ca2+的配位,聚集的囊泡又回到分散状态.

图11 HSMA/C12Et3(1∶1)体系的荧光共振能量转移结果[83]Fig.11 Fluorescence resonance energy transfer results of the system of HSMA/C12Et3(1∶1)system[83]ctatal=3 mmol·L-1,pH=9.2,T=25℃;(a)without additive;(b)after adding 0.4 mmol·L-1Ca2+;(c)after adding 0.4 mmol·L-1Ca2+and 0.8 mmol·L-1EDTA;HSMA:hydrolyzed styrene-maleic anhydride copolymer;C12Et3:dodecyltriethylammonium bromide
6.2 激发态质子转移
激发态质子转移(excited-state proton transfer, ESPT)指处于激发态的荧光物种自身或者同溶剂之间发生质子转移的过程.一般来讲,有激发态分子内质子转移(ESIPT)和溶剂介入激发态质子转移(SMESPT)两种.探针代表有2PBI、萘醇、芘醇及其衍生物[84-86].
ESIPT指荧光物种自身具有质子给体和质子受体,探针分子受光激发后,激发态分子内部紧邻的质子给体和质子受体之间发生质子转移反应[87-89].探针代表有羟基黄酮(HF)及其衍生物等.SMESPT是指探针分子一般有质子给体,探针分子受光激发后,激发态分子和溶剂分子发生质子转移.表现在探针分子的光谱上,一般为未发生ESPT的正常态发射和ESPT态的发射.ESPT类的探针分子发射光谱的形貌与其所处的环境的微极性息息相关.因此,该类探针在各种表面活性剂自组装体系中均有应用,例如反胶束、表面活性剂与聚合物、蛋白质等混合体系[85,90-97].
7 结 语
经过30多年的发展,荧光探针技术已经发展为一种在两亲分子有序组合体领域广泛适用的研究手段.荧光探针技术具有方法简单、可测参数多、应用广泛等众多优点.尽管荧光方法的应用具有一些前提条件,在一些体系中会影响到结果的准确度,综合来说,荧光探针技术还是一类很好的方法,在许多有序组合体微观信息测量方面是目前唯一的或最好的方法.相信荧光探针技术在两亲分子有序组合体调控研究领域会得到越来越多的应用,并能够不断改进现有的实验方法,得到更准确、更接近真实情况的结果,为水溶液中两亲分子有序组合体,尤其是表面活性剂有序组合体在科研、生产等领域的应用起到积极的推动作用.
1 Zhao,G.X.;Zhu,B.Y.Principles of surfactant action.Beijing: Chinese Light Industry Press,2003:226 [赵国玺,朱瑶.表面活性剂作用原理.北京:中国轻工业出版社,2003:226]
2 Behera,G.B.;Mishra,B.K.;Behera,P.K.;Panda,M.Adv.Colloid Interface Sci.,1999,82:1
3 Amitabha,C.;Soumi,M.;Raghuraman,H.J.Phys.Chem.B, 2002,106:13002
4 Raghuraman,H.;Chattopadhyay,A.Langmuir,2003,19:10332
5 Kalyanasundaram,K.;Thomas,J.K.J.Am.Chem.Soc.,1977,99: 2039
6 Khatua,D.;Dey,J.J.Phys.Chem.B,2007,111:124
7 Rosen,M.J.;Mathias,J.H.;Davenport,L.Langmuir,1999,15: 7340
8 Schorre,N.E.;Turro,N.J.J.Am.Chem.Soc.,1974,96:306
9 De,S.;Aswal,V.K.;Goyal,P.S.;Bhattacharya,S.J.Phys.Chem. B,1998,102:6152
10 Mathias,J.H.;Rosen,M.J.;Davenport,L.Langmuir,2001,17: 6148
11 Seredyuk,V.;Alami,E.;Nyden,M.;Holmberg,K.;Peresypkin,A. V.;Menger,F.M.Langmuir,2001,17:5160
12 Haldar,J.;Aswal,V.K.;Goyal,P.S.;Bhattacharya,S.J.Phys. Chem.B,2001,105:12803
13 Benrraou,M.;Bales,B.L.;Zana,R.J.Phys.Chem.B,2003,107: 13432
14 Pinazo,A.;Wen,X.;Perez,L.;Infante,M.R.;Franses,E.I. Langmuir,1999,15:3134
15 Zana,R.;Levy,H.;Danino,D.;Talmon,Y.;Kwetkat,K. Langmuir,1997,13:402
16 Guan,J.Q.;Tung,C.H.Langmuir,1999,15:1011
17 Winnik,M.A.;Dong,D.C.Can.J.Chem.,1984,62:2560
18 Ray,G.B.;Chakraborty,I.;Moulik,S.P.J.Colloid Interface Sci., 2006,294:248
19 Zana,R.Surfactants in solutions:new methods of investigation. Beijing:Petroleum Industry Press,1992:242-243 [Zana,R.表面活性剂溶液研究新方法.北京:石油工业出版社,1992:242-243]
20 Gao,L.N.Synthesis of fluorophore-labeled surfactants and their application in organized molecular assemblies[D].Beijing:Peking University,2008 [高莉宁.荧光标记表面活性剂的合成及其在分子有序组合体中的应用研究[D].北京:北京大学,2008]
21 Hazra,P.;Chakrabarty,D.;Chakraborty,A.;Sarkar,N. J.Photochem.Photobiol.A,2004,167:23
22 Grabowski,Z.R.;Rotkiewicz,K.;Rettig,W.Chem.Rev.,2003, 103:3899
23 Zachariasse,K.A.Chem.Phys.Lett.,2000,320:8
24 Shannigrahi,M.;Bagchi,S.J.Phys.Chem.B,2004,108:17703
25 Novaira,M.;Biasutti,M.A.;Silber,J.J.;Correa,N.M.J.Phys. Chem.B,2007,111:748
26 Balter,A.;Nowak,W.;Pawełkiewicz,W.;Kowalczyk,A.Chem. Phys.Lett.,1988,143:565
27 Karukstis,K.K.;McCormack,S.A.;McQueen,T.M.;Goto,K.F. Langmuir,2004,20:64
28 Feitosa,E.;Alves,F.R.;Niemiec,A.;Oliveira,M.E.C.D.R.; Castanheira,E.M.S.;Baptista,A.L.F.Langmuir,2006,22:3579 29 Cser,A.;Nagy,K.;Biczok,L.Chem.Phys.Lett.,2002,360:473
30 Hara,K.;Kuwabara,H.;Kajimoto,O.J.Phys.Chem.A,2001, 105:7174
31 Lin,L.R.;Yang,W.L.;Zheng,G.L.;Jiang,Y.B.Spectrochim. Acta A,2004,60:2209
32 del Burgo,P.;Aicart,E.;Llorca,O.;Junquera,E.J.Phys.Chem.B, 2006,110:23524
33 Krishnan,R.S.G.;Thennarasu,S.;Mandal,A.B.J.Phys.Chem. B,2004,108:8806
34 Xu,J.G.;Wang,Z.B.Fluorescence analysis.3rd ed.Beijing: Science Press,2006:192 [徐金钩,王尊本.荧光分析法.第三版.北京:科学出版社,2006:192]
35 Sabín,J.;Ruso,J.M.;González-Pérez,A.;Prieto,G.;Sarmiento,F. Colloids Surf.B,2006,47:64
36 Gehlen,M.H.;De Schryver,F.C.Chem.Rev.,1993,93:199
37 Huang,J.B.;Zhao,G.X.;Jiang,Y.C.;Wu,S.K.Acta Phys.-Chim.Sin.,1993,9:577 [黄建滨,赵国玺,江永才,吴世康.物理化学学报,1993,9:577]
38 Huang,J.B.;Zhao,G.X.Colloid Polymer Sci.,1996,274:747
39 Winnik,F.M.;Ringsdorf,H.;Venzmer,J.Langmuir,1991,7:905
40 Neumann,M.G.;Schmitt,C.C.;Iamazaki,E.T.Carbohydr.Res., 2003,338:1109
41 Wolszczak,M.;Miller,J.J.Photochem.Photobiol.A,2002,147: 45
42 Raghuraman,H.;Pradhan,S.K.;Chattopadhyay,A.J.Phys.Chem. B,2004,108:2489
43 Mukherjee,S.;Chattopadhyay,A.Langmuir,2005,21:287
44 Magny,B.;Iliopoulos,I.;Zana,R.;Audebert,R.Langmuir,1994, 10:3180
45 Turro,N.J.;Yekta,A.J.Am.Chem.Soc.,1978,100:5951
46 Malliaris,A.Int.Rev.Phys.Chem.,1988,7:95
47 Baden,N.;Kajimoto,O.;Hara,K.J.Phys.Chem.B,2002,106: 8621
48 Sulthana,S.B.;Rao,P.V.C.;Bhat,S.G.T.;Rakshit,A.K.J. Phys.Chem.B,1998,102:9653
49 Petit-Agnely,F.;Iliopoulos,I.;Zana,R.Langmuir,2000,16:9921
50 Huang,J.B.;Zhao,G.X.;Zhu,B.Y.Acta Scientiarum Naturalium Universitatis Pekinensis,1999,3:144 [黄建滨,赵国玺,朱瑶.北京大学学报:自然科学版,1999,3:144]
51 Kaler,E.W.;Murthy,A.K.;Rodriguez,B.E.;Zasadzinski,J.A. Science,1989,245:1371
52 Huang,J.B.;Zhu,B.Y.;Mao,M.Colloid Polymer Sci.,1999, 277:354
53 Huang,J.B.;Yang,R.;He,X.;Zhu,B.Y.Colloids Surf.A,2000, 174:403
54 Yin,H.Q.;Huang,J.B.;Mao,M.;Fu,H.L.Langmuir,2002,18: 9198
55 Yan,Y.;Huang,J.B.;Li,Z.C.;Han,F.;Ma,J.M.Langmuir, 2003,19:972
56 Yin,H.Q.;Zhou,Z.;Huang,J.B.;Zheng,R.;Zhang,Y.Angew. Chem.Int.Edit.,2003,42:2188
57 Lu,T.;Han,F.;Li,Z.C.;Huang,J.B.;Fu,H.L.Langmuir,2006, 22:2045
58 Wang,K.;Yin,H.Q.;Sha,W.;Huang,J.B.;Fu,H.L.J.Phys. Chem.B,2007,111:12997
59 Yan,Y.;Lu,T.;Huang,J.B.J.ColloidInterfaceSci.,2009,337:1
60 Lin,Y.Y.;Han,X.;Cheng,X.H.;Huang,J.B.;Liang,D.H.;Yu, C.L.Langmuir,2008,24:13918
61 Yin,H.Q.;Huang,J.B.;Gao,Y.Q.;Fu,H.L.Langmuir,2005, 21:2656
62 Dutt,G.B.;van Stam,J.;De Schryver,F.C.Langmuir,1997,13: 1957
63 Grieser,F.;Drummond,C.J.J.Phys.Chem.,1988,92:5580
64 Alargova,R.G.;Kochijashky,I.I.;Sierra,M.L.;Zana,R. Langmuir,1998,14:5412
65 Infelta,P.P.;Gratzel,M.;Thomas,J.K.J.Phys.Chem.,1974,78: 190
66 Tachiya,M.Chem.Phys.Lett.,1975,33:289
67 Gehlen,M.H.;De Schryver,F.C.Chem.Rev.,1993,93:199
68 Yin,H.Q.;Lin,Y.Y.;Huang,J.B.J.Colloid Interface Sci.,2009, 338:177
69 Yin,H.Q.Controlling of self-assemblies in catanionic surfactant sysytems[D].Beijing:Peking University,2006 [尹海清.阴阳表面活性剂混合体系中有序组合体的调控[D].北京:北京大学, 2006]
70 Almgren,M.;Lofroth,J.E.J.Colloid Interface Sci.,1981,81:486
71 Almgren,M.Adv.Colloid Interface Sci.,1992,41:9
72 Caruso,F.;Grieser,F.;Murphy,A.;Thistlethwaite,P.;Urquhart, R.;Almgren,M.;Wistus,E.J.Am.Chem.Soc.,1991,113:4838
73 Medhage,B.;Almgren,M.J.Fluoresc.,1992,2:7
74 Mao,M.;Huang,J.B.;Zhu,B.Y.;Ye,J.P.J.Phys.Chem.B, 2002,106:219
75 Yin,H.Q.;Lei,S.;Zhu,S.B.;Huang,J.B.;Ye,J.P.Chem.Eur.J., 2006,12:2825
76 Söderman,O.;Herrington,K.L.;Kaler,E.W.;Miller,D.D. Langmuir,1997,13:5531
77 Miller,D.D.;Magid,L.J.;Evans D.F.J.Phys.Chem.,1990,94: 5921
78 Yao,J.X.;Zhao,Y.;Huang,J.B.Acta Phys.-Chim.Sin.,2006,22 (8):913 [么敬霞,赵 颖,黄建滨.物理化学学报,2006,22(8): 913]
79 Jiang,L.X.;Deng,M.L.;Wang,Y.L.;Liang,D.H.;Yan,Y.; Huang,J.B.J.Phys.Chem.B,2009,113:7498
80 Zhao,Y.;Yan,Y.;Jiang,L.X.;Huang,J.B.;Hoffmann,H.Soft Matter,2009,5:4250
81 Gao,L.N.;Song,Q.;Huang,X.;Huang,J.B.J.Colloid Interface Sci.,2008,323:420
82 Forster,T.Discuss.Faraday Soc.,1959,7:27
83 Yao,J.X.;Feng,Y.;Zhao,Y.;Li,Z.C.;Huang,J.B.;Fu,H.L. J.Colloid Interface Sci.,2007,314:52
84 Mukherjee,T.K.;Lahiri,P.;Datta,A.Chem.Phys.Lett.,2007, 438:218
85 Kombarova,S.V.;Il′ichev,Y.V.Langmuir,2004,20:6158
86 Solntsev,K.M.;Il′ichev,Y.V.;Demyashkevich,A.B.;Kuzmin, M.G.J.Photochem.Photobiol.A,1994,78:39
87 Kasha,M.J.Chem.Soc.Faraday Trans.2,1986,82:2379
88 Barbara,P.F.;Walsh,P.K.;Brus,L.E.J.Phys.Chem.,1989,93: 29
89 Formosinho,S.J.;Arnaut,L.G.J.Photochem.Photobiol.A,1993, 75:21
90 Il′ichev,Y.V.;Demyashkevich,A.B.;Kuzmin,M.G.J.Phys. Chem.,1991,95:3438
91 Il′ichev,Y.V.;Demyashkevich,A.B.;Kuzmin,M.G.; Lemmetyinen,H.J.Photochem.Photobiol.A,1993,74:51
92 Il′ichev,Y.V.;Shapovalov,V.L.Bull.Russ.Acad.Sci.-Div. Chem.Sci.,1992,41:1762
93 Cohen,B.;Huppert,D.;Solntsev,K.M.;Tsfadia,Y.;Nachliel,E.; Gutman,M.J.Am.Chem.Soc.,2002,124:7539
94 Sukul,D.;Pal,S.K.;Mandal,D.;Sen,S.;Bhattacharyya,K. J.Phys.Chem.B,2000,104:6128
95 Dutta,P.;Halder,A.;Mukherjee,S.;Sen,P.;Sen,S.; Bhattacharyya,K.Langmuir,2002,18:7867
96 Dennison,S.M.;Guharay,J.;Sengupta,P.K.Spectrochim.Acta A, 1999,55:903
97 Angulo,G.;Organero,J.A.;Carranza,M.A.;Douhal,A.J.Phys. Chem.B,2006,110:24231
November 17,2009;Revised:January 4,2010;Published on Web:March 5,2010.
Application of Fluorescent Probe Technology in Self-Assembly Systems of Amphiphile Aqueous Solutions
ZHAO Li YAN Yun*HUANG Jian-Bin*
(State Key Laboratory for Structural Chemistry of Unstable and Stable Species,College of Chemistry and Molecular Engineering, Peking University,Beijing 100871,P.R.China)
In this paper,we review the application of fluorescent probe technology in self-assembly systems of amphiphile aqueous solutions.Fluorescence technology,especially fluorescence probe technology has been extensively employed to explore local information about various molecular assemblies.The following contents are covered:(1)The critical aggregate concentration,microviscosity,and micropolarity may be obtained from fluorescence parameters such as emission maxima,fluorescence intensity,and lifetime etc.(2)Probe quenching,especially,timeresolved fluorescence quenching(TRFQ)can give information about aggregation number and surface charge density which can be used as the indication on aggregate transition.(3)Fluorophore-labeled amphiphiles which can take part in the formation of aggregates reveal more precise information,so that an in situ investigation of local environments is possible.Moreover,fluorescence resonance energy transfer(FRET)and excited state proton transfer(ESPT)are also useful in this field.Therefore,fluorescence probe technology provides us with a simple and effective method to study organized amphiphiles systems.
Fluorescent probe; Quenching; Organized assembly;Amphiphile;Aggregate transition; Surfactant
O648
*Corresponding authors.Email:jbhuang@pku.edu.cn;Tel:+86-10-62753557.
The project was supported by the National Natural Science Foundation of China(20873001,20633010,50821061).
国家自然科学基金(20873001,20633010,50821061)资助项目
