拟南芥叶卷曲突变体lcd 的遗传分析及基因定位
2010-11-27周继业袁玉菊顾佳宁田连福朱俊林李东屏
周继业,袁玉菊,顾佳宁,于 峰,田连福,朱俊林,李东屏*
(1.湖南师范大学生命科学学院,中国 长沙 410081;2.湖南师范大学公共管理学院, 中国 长沙 410081)
植物体叶片的发育受基因[1-2]、环境[3]和激素[4]等因素共同调节.叶极性的建立直接决定叶的平展性发育,极性改变会破坏大多数植物叶的平展性,影响植物体的光合作用、蒸腾作用、呼吸作用[5]等生理功能.因此,参与叶极性建成的属性基因或作用于激素信号途径的基因发生突变,都会导致叶形态异常[6-7].目前,国内外科学家已从拟南芥等植物中分离出了一些发生叶卷曲的突变体,卷曲类型可分为,叶上卷(即偏下性生长),如hasty-5[8];叶下卷(即偏上性生长),如Icu[9]和叶片卷皱等.植物叶发育研究在最近几年取得了较大进展,许多叶发育相关的基因已经被揭示出来[10-11], microRNA (miRNA)也参与了调控植物器官极性分化[12-13],但有关叶发育分子调控的信号途径仍不明了.lcd突变体是一个利用T-DNA插入诱发叶片发育异常的突变体,对其进行遗传分析和基因定位,为了解叶片极性或叶卷曲发生的遗传规律,研究叶发育的调控机理都具有一定的理论意义.
1 材料与方法
1.1 材料与试剂
拟南芥 (Arabidopsisthaliana) 野生型为 Columbia (Co1) 生态型与Lansberg erecta (Ler)生态型,突变体为lcd突变体,突变体亲本是Col生态型;rTaq DNA 聚合酶为 Ambiogen 公司产品;标准DNA分子量Marker(DNA MarkerⅠ)为TIANGEN公司产品;寡核苷酸引物合成( PAGE 纯化)及 DNA序列测定由上海生工公司完成.
1.2 实验方法
1.2.1 拟南芥突变体lcd的表型观察 用数码相机(SONY,DSC-S85)近距离拍摄植株整体形态或新鲜的离体器官;测量叶片长度和面积.
1.2.2 突变体的遗传分析 将突变体种子播种于基质为蛭石的营养土中,培养条件为温度22 ℃,光照强度为120~150 umol/(m2.s)光培养16 h,暗培养8 h,湿度保持在60%~70%.培养至开花,以野生型Col为父本,lcd突变体为母本,进行杂交,得F1种子.然后将F1种子种下,进行自交,得F2种子.再将F2种子种于MS培养基上,生长一段时间以后检测其性状分离情况,统计结果用于遗传分析.
1.2.3 突变基因的初定位
(1)图位克隆群体的构建:把纯合突变体与野生型Ler杂交,得到 F1代杂合体种子,将其种下观察表型;然后,将F1代杂合体自交,得到F2种子;再F2种子播于培养土中,出现性状分离,分单株提取DNA.
(2)初定位分子标记的选择:参照拟南芥信息资源网站 (TAIR) 上的相关信息,选用拟南芥中常用的简单序列长度多态性 ( simple sequence length polymorphisms,SSLP ) 的分子标记[14],每条染色体上选择分布较均匀的3~5个标记,设计成引物,产物长度控制在100~200 bp左右,并且在拟南芥两个野生型品种Ler与Col中呈共显性.本文共选用22个分子标记,设计成22 对引物进行初定位(见表1).

表1 粗略定位分子标记
(3)DNA池的制备:分别取DNA 2 μL,每20株DNA混在一起制备成5个突变体DNA池,并以野生型Ler与Col为对照,用设计好的初定位分子标记为引物进行PCR扩增.扩增条件为95 ℃变性3 min;94 ℃变性30 s,54 ℃退火20 s,72 ℃延伸20 s,循环45次,72 ℃ 10 min,22 ℃ 保存.

A, C, E为野生型,B, D, F为突变体图1 lcd突变体的表型观察
1.2.4 突变基因的精细定位 根据初定位的结果,在初定位染色体分子标记区间内逐步设计新的分子标记,利用设计分子标记的原则设计出精细定位的分子标记,同时扩大突变体的群体数量以单株突变体的总DNA为模板进行PCR,缩小基因区间从而确定出突变基因的定位区间.
2 结果与分析
2.1 突变体表型观察与分析
突变体lcd与野生型表型有明显的区别(图1).在幼苗期,从第一片真叶开始叶片向下卷曲(图1B),叶张角变大(图1D).在莲座叶成熟后,突变体与野生型莲座叶相比较,叶片尖端较钝,基部较宽,叶柄较短,但叶片中部无明显区别(图1F).
2.2 突变体的遗传分析
F1代表现型与野生型Col完全一致,说明此卷曲突变为隐性突变.而F2群体产生分离(见表2),经检验,野生型(Col)与突变体lcd的分离比符合3∶1分离规律.同时将F1突变体lcd与野生型进行回交,结果子代性状分离比符合1∶1.因此,说明该突变体是隐性单基因突变体.
表2 突变体lcd的遗传分析
2.3 突变基因的初定位
2.3.1 突变体的遗传背景的纯合检测 用所设22对引物对突变体植株DNA进行PCR扩增,结果所有分子标记都只扩出一条Col的带,说明此突变体的遗传背景是纯合的Col生态型(图2).
图2 以突变体DNA为模板的22对分子标记引物的PCR产物电泳分析
2.3.2 突变基因在染色体上的初步定位 F1代性状都为野生型,但PCR结果均有两条带,故F1为杂合体.F2代出现性状分离,分离出100株突变体植株,单株提取DNA,每20株DNA混在一起制备成5个DNA池,用于图位克隆.
以前面制备的5个DNA池、野生型Ler与Col作模板,进行基因初定位,结果如图3所示.
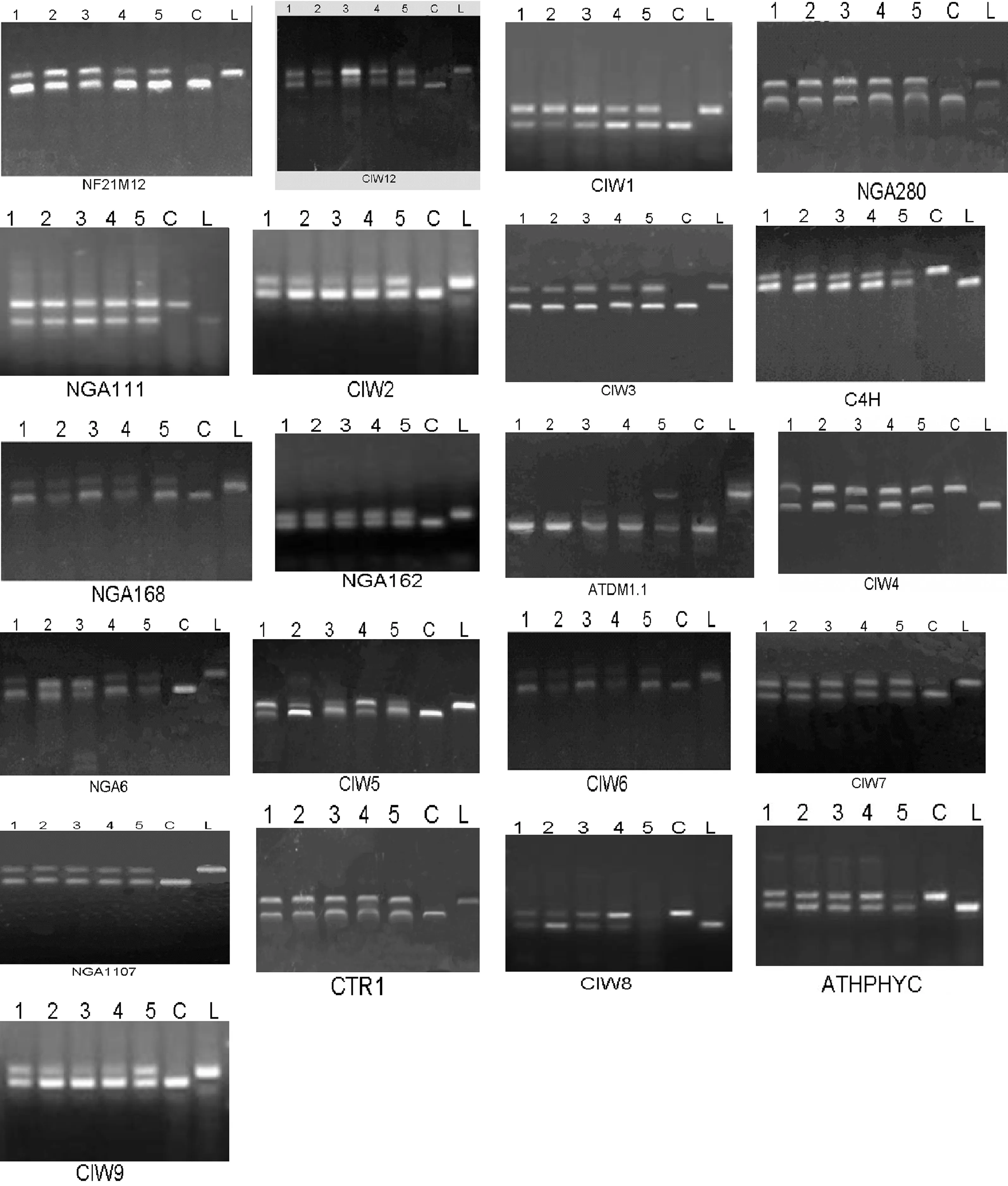
1~5:突变体的5个DNA池 C:野生型Col L:野生型Ler图3 lcd突变体初定位电泳图
在第3条染色体上的4个分子标记位点中,分子标记ATDMC1.1处,5个DNA池中有4个都只扩增出Col型特有条带,只有5号DNA池扩增出了Col和Ler的两条带.因此,可以推测突变基因位于第3条染色体上,与分子标记ATDMC1.1紧密连锁,但具体的方向还不清楚.
2.4 突变基因的精细定位
为了明确突变基因的方向,作者分别用分子标记NGA162、ATDMC1.1和CIW4等3对单株突变体DNA进行PCR,作图群体数量为65个样品,根据基因间的连锁关系确定目的基因的方向.结果显示在65个样品中分子标记NGA162只有3个样品出现Col型特有的一条带,其他都有Col和Ler的两条带.分子标记ATDMC1.1在65个突变体植株中,共有59株只出现Col信息,有6个样品既有Col信息,也有Ler的信息.分子标记CIW4有35个样品只出现Col信息,30个样品既有Col信息,也有Ler的信息.根据结果可以确定lcd突变基因定位在ATDMC1.1和CIW4两个分子标记位点之间,且靠近ATDMC1.1这一侧.
ATDMC1.1和CIW4之间相隔3 250 kb,作者在这两个位点之间设计新的分子标记CIW11(9 775 kb)、GAPAB(9 796 kb)和T27C7-SP6(13 047 kb).然后分别用这3对分子标记为引物以单株突变体的DNA为模板进行PCR,作图群体增加到了145个突变体植株,来确定该基因的大致位置.在这145个单株中,T27C7-SP6的重组子比较多,有59个重组子.CIW11和GAPAB的重组子很少,分别是5个和1个.再次扩大作图群体到500个突变体植株,对CIW11和GAPAB标记进一步鉴定.结果在这500个样品中,CIW11的重组子有20个,而GAPAB的重组子只有5个(图4).因此,可初步推定该突变基因定位于拟南芥的第3条染色体上,且与分子标记GAPAB紧密连锁.
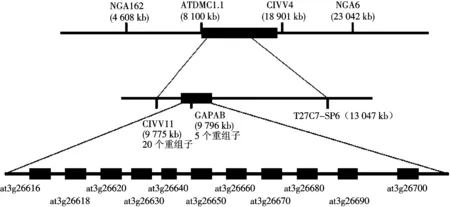
图4 lcd 的精细定位图
3 讨论
lcd突变体的莲座叶在横向和纵向都出现不同程度的卷曲, 而且越在早期卷曲程度越大,到了叶发育的后期卷曲程度明显变小,同时叶张角变大.向下卷曲是突变体lcd最明显的特征.遗传分析表明该突变为隐性单基因突变.叶片在不同发育阶段卷曲程度不同,这是lcd突变体最突出的特征;现在已报道的叶卷曲突变体[8-11]与lcd在表型上都存在差异.LCD基因突变不仅影响到叶型和叶片的极性生长,而且影响植物的株型(叶柄的张角),暗示该基因在植物叶发育的两类不同的信号通路中起作用.
目前,利用图位克隆技术,已将突变基因初步定位于拟南芥的第3条染色体上,与分子标记GAPAB紧密连锁.根据http://www.arabidopsis.org网站上的基因信息对GAPAB标记附近的一些基因进行了仔细的分析.在GAPAB标记附近作者查找到了11个基因,其中有两个基因at3g26620、at3g26660都含有植物所特有的LATERAL ORGAN BOUNDARIES(LOB)Domain.已有研究表明,在双子叶植物中,许多具有LOB-Domain的基因决定叶等侧生器官的极性建立,并对侧生器官的发育起重要的调控作用.根据突变体的表型特征,作者选定这两个基因为第一候选基因,正在对这两个基因做进一步的功能分析,更进一步的精细定位与基因克隆正在进行中.
参考文献:
[1] WAITES R, SELVADURAI HRN, OLIVER IR,etal. ThePHANTASTICAgene encodes a MYB transcription factor involved in growth and dorsoventrality of lateral organs in Antirrhinum [J]. Cell, 1998, 93: 779-789.
[2] KOYAMA T, FURUTANI M, TASAKA M,etal. TCP transcription factors control the morphology of shoot lateral organs via negative regulation of the expression of boundary-specific genes inArabidopsis[J]. Plant Cell, 2007, 19: 473-484.
[3] QI Y, SUN Y, XU L,etal. ERECTA is required for protection against heat-stress in the AS1/AS2 pathway to regulate adaxial-abaxial leaf polarity in Arabidopsis [J]. Planta, 2004, 219: 270-276.
[4] HAY A, BARKOULAS M, TSIANTIS M. ASYMMETRIC LEAVES1 and auxin activities converge to repressBREVIPEDICELLUSexpression and promote leaf development in Arabidopsis[J]. Development, 2006, 133(20):3 955-3 961.
[5] BOWMAN J L, ESHED Y, BAUMA S F. Establishment of polarity in angiosperm lateral organs [J]. Trends in Genetics, 2002, 18: 134-141.
[6] DENGLER N, KANG J. Vascular patterning and leaf shape [J]. Current Opinion in Plant Biology, 2001, 4:50-56.
[7] BERLETH T, SACHS T. Plant morphogenesis: long-distance coordination and local patterning [J]. Current Opinion in Plant Biology, 2001, 4: 57-62.
[8] TELFER A, POETHIG R S.HASTY: a gene that regulates the timing of shoot maturation inArabidopsisthaliana[J]. Development, 1998, 125: 1 889-1 898.
[9] WU H, YU L, TANG XR,etal. Leaf downward curvature and delayed flowering caused by AtLH overexpression inArabidopsisthaliana[J]. Acta Botanica Sinica, 2004, 46(9):1 106-1 113.
[10]IDAN E, EYAL B, ALEXANDER G,etal. A Protracted and dynamic maturation schedule underlies arabidopsis leaf development[J]. Plant Cell, 2008, 20: 2 293-2 306.
[11] GOLDSHMIDT A, ALVAREZ J P, BOWMAN J L,etal. Signals derived from YABBY gene activities in organ primordiaregulate growth and partitioning of Arabidopsis shoot apical meristems[J].Plant Cell, 2008, 20: 1 217-1 230.
[12] ESHED Y. Endogenous and synthetic microRNAs stimulate simultaneous, efficient, and localized regulation of multiple targets in diverse species[J]. Plant Cell, 2006, 18: 1 134-1 151.
[13] KRISZTINA N, THOMAS B, ALEXIS P,etal. The balance between the MIR164A and CUC2 genes controls leaf margin serration inArabidopsis[J]. Plant Cell, 2006, 18: 2 929-2 945.
[14]韦里俊,周继业,陈 松,等.拟南芥锚蛋白ANK20基因表达模式[J].湖南师范大学自然科学学报,2009,32(2):89-92.
