尿素、氯化铵、碳酸铵对牛奶样品微量凯氏定氮法的干扰
2010-11-27袁炳秋戴玉明刘彩云易银沙
袁炳秋,吕 媛,马 钰,戴玉明,刘彩云,曾 林,易银沙*
(1. 湖南师范大学医学院,中国 长沙 410081; 2. 长沙赢润生物技术有限公司,中国 长沙 410013)
凯氏定氮法的普遍适用性、精确性和可重复性已经得到了国际的广泛认可[1].它已经被确定为检测食品中蛋白质含量的标准方法[2].目前,牛奶中蛋白含量的测定主要采用国标法凯氏定氮法[3],该方法基于测定含氮量来间接测定蛋白质含量,它与所测样品的蛋白质组成无关,不受样品颜色的影响,是美国食品药品监督局(FDA)推荐的测定蛋白的方法[4].但是,这种方法并不能给出真实的蛋白质含量,因为凯氏定氮法所测定的氮可能不仅仅是由蛋白质转化来的,它也可以是其他非蛋白质物质所转化的[5],因此有些人便利用凯氏定氮法这一缺陷往牛奶中加入各种非蛋白氮来干扰凯氏定氮法测定牛奶蛋白含量,达到以假乱真以次充好的目的.近年来,国内外多次发生牛奶掺假事件.特别是2008年我国发生了国产奶粉中大规模地检测出三聚氰铵的毒奶粉事件,这一以非蛋白(三聚氰铵)充当蛋白的掺假行为使人们的健康受到严重影响,也显现出了传统的牛奶蛋白定量检测方法(凯氏定氮法)的种种缺陷和不足.为了进一步探索非蛋白氮对凯氏定氮法的影响程度,本实验特意对尿素、氯化铵、碳酸铵3种含氮物质对凯氏定氮法测定牛奶蛋白含量的干扰进行专门的研究和探讨.
目前,国内外对凯氏定氮法的研究比较多,对凯氏定氮法测定食物蛋白时的干扰因素也比较关注[6-10],但大多集中在通过改良凯氏定氮法[11-13]和用其他蛋白质测定方法代替凯氏定氮法从而避免干扰物质对凯氏定氮法的影响这两方面.例如主张用红外技术[14]代替凯氏定氮法或用三氯乙酸[15]处理样品,让真正的蛋白质形成沉淀,过滤后,分别测定沉淀和滤液中的氮含量,从而测定蛋白质的真正含量和冒充蛋白质的氮含量.而事实上对凯氏定氮法测定食物蛋白时的干扰因素的深入研究很少,目前尚未见到针对尿素、氯化铵、碳酸铵等含氮物质在凯氏定氮法测定牛奶蛋白含量时的干扰程度,在本实验之前,非蛋白质含氮物质已被确认为凯氏定氮法测定食物蛋白含量的干扰因素,因此本文的研究着重探讨尿素、氯化铵、碳酸铵含氮物质对凯氏定氮法测定牛奶蛋白含量具有明显的干扰作用及干扰作用的强度.
1 材料与方法
1.1 仪器与试剂
紫外分光光度计:2 100 pro 型(北京瑞利分析仪器公司)、微量凯氏定氮仪.
所有试剂均用不含氨的蒸馏水配制. 硫酸铜、硫酸钾、硫酸、40 g/L硼酸吸收液(20 g硼酸溶解于500 mL热蒸馏水中)、过氧化氢溶液(体积分数为30% ),氢氧化钠溶液(质量比为400/1 000;称取400 g氢氧化钠,用1 000 mL水溶解,待冷却后移入试剂瓶中)、甲基红一漠甲酚绿混合指示剂(用体积分数为95%的乙醇将澳甲酚绿及甲基红分别配成1 g/L的乙醇溶液,使用时按1 g/L澳甲酚绿与1 g/L甲基红的体积比为5∶1的比例混合)、0.1 mo1/L硫酸(或盐酸)标准溶液.
牛奶样品溶液:来源当地超市的伊利250 mL纯牛奶(批号:D10209E1203)
1.2 实验方法
1.2.1 牛奶稀释样品及尿素等干扰样品的配制 取0.1 mL牛奶原品,用二次蒸馏水定容到5 mL,得50倍稀释样品,从5 mL的50倍稀释样品中取2.5 mL再次定容到5 mL,得100倍稀释样品.从100倍牛奶稀释样品中各取0.1 mL于6管试管中,分别加入干扰品(尿素或氯化铵或碳酸铵)配制成0.5、1.0、2.0、3.0、4.0、6.0 mol的干扰品.
1.2.2 牛奶稀释样品中蛋白浓度的测定 用微量凯氏定氮仪测定50倍、100倍牛奶稀释样品中的蛋白含量,分别取1 mL的50倍、100倍牛奶稀释样品于8管消化管中,蒸发至干.然后依次向各消化管中加入硫酸铜与硫酸钾(体积比为4∶100)的混合200 mg、硫酸5 mL及数粒玻璃珠至于电炉上缓慢加热消化,注意防止溶液沸腾.再将消化液用定氮仪蒸馏,蒸馏步骤为:在各消化液中加入适量的30%NaOH溶液开始蒸馏(用蒸馏水做空白液),反应出来的氨用硼酸溶液吸收,蒸馏液用0.01 mol/L的盐酸滴定(采用微量滴定管) ,计算出含氮量.将含氮量乘以6.25换算成蛋白质的含量.
1.2.3 牛奶干扰样品中蛋白浓度的测定 方法同牛奶稀释样品中蛋白浓度的测定.分别测定加入不同种类和浓度干扰物后(尿素/氯化铵/碳酸铵),50倍、100倍稀释牛奶的蛋白浓度.
1.2.4 微量凯氏定氮法的测定步骤 分别取1 mL 的50倍、100倍牛奶稀释样品和不同尿素浓度的干扰样品于8管消化管中,蒸发至干.然后依次向各消化管中加入硫酸铜与硫酸钾(体积比为4∶100)的混合物200 mg、硫酸5 mL及数粒玻璃珠置于电炉上缓慢加热消化,注意防止溶液沸腾.再将消化液用定氮仪蒸馏,蒸馏步骤为:在各消化液中加入适量的30%NaOH溶液开始蒸馏(用蒸馏水做空白液),反应出来的氨用硼酸溶液吸收,蒸馏液用0.01 mol/L的盐酸滴定(采用微量滴定管) ,计算出含氮量.将含氮量乘以6.25换算成蛋白质的含量.
2 结果与分析
2.1 牛奶稀释样品中蛋白浓度的测定
用微量凯氏定氮法测定50倍、100倍稀释样品的浓度.测定结果见表1.根据表1中微量凯氏定氮法测定的50倍牛奶稀释样品的蛋白含量数据,计算出6个50倍牛奶稀释样品平均值=801.7 ug/mL,标准差=7.32 ug/mL,CV(变异系数)=0.91%.同理,根据微量凯氏定氮法测定的100倍牛奶稀释样品的数据,计算出平均值=377.5 ug/mL,标准差=3.86 ug/mL,CV(变异系数)=1.02%,由此可见,在没有任何干扰物质存在的条件下,用微量凯氏定氮法测定牛奶蛋白含量,重现性较好,变异程度较小,精密度较高.

表1 微量凯氏定氮法测定牛奶稀释样品结果
2.2 牛奶干扰样品中蛋白浓度的测定
用微量凯氏定氮法分别测定加入不同干扰物(尿素/氯化铵/碳酸铵)的1 mL 50倍、100倍稀释牛奶的蛋白含量,结果分别见表2~4.
以原各稀释样品中测得的蛋白浓度为标准,根据表2中微量凯氏定氮法测定的加入尿素干扰物的50倍牛奶蛋白含量数据,计算相对标准偏差(RSD),分别为3.09、4.98、6.56、9.28、11.55、14.4,均大于2%;同理,根据微量凯氏定氮法测定的加入尿素干扰物的100倍牛奶稀释样品蛋白含量数据,计算其RSD分别为2.73、5.62、7.60、13.06、21.48、31.95,均大于2%,由此可见,在加入尿素时,用微量凯氏定氮法测定牛奶蛋白含量,其结果明显受到干扰,精密度差.
以原各稀释样品中的测得的蛋白浓度为标准,根据表3中微量凯氏定氮法测定的加入氯化铵干扰物的50倍牛奶稀释样品蛋白含量数据,计算RSD分别为2.22、2.68、4.07、7.20、9.33、11.6,均大于2%;同理,根据微量凯氏定氮法测定的加入干氯化铵干扰物的100倍牛奶稀释样品蛋白含量数据,计算其RSD分别为2.62、5.62、7.34、13.83、20.92、33.40,均大于2%,由此可见,在氯化铵干扰物存在的条件下,明显影响微量凯氏定氮法测定牛奶蛋白含浓度的准确性,精密度也差.
根据表4中微量凯氏定氮法测定的加入碳酸铵干扰物的50倍牛奶稀释样品蛋白含量数据,计算得出RSD分别为2.54、 3.83、 5.48、 7.80、 10.37、 12.80,均大于2%;同理,根据微量凯氏定氮法测定的加入碳酸铵干扰物的100倍牛奶稀释样品蛋白含量数据,计算其RSD分别3.18、 6.41、 9.22、 15.52、 21.11、 29.46,也均大于2%,由此可见,在碳酸铵存在的干扰物条件下,用微量凯氏定氮法测定牛奶蛋白含量准确性不好.
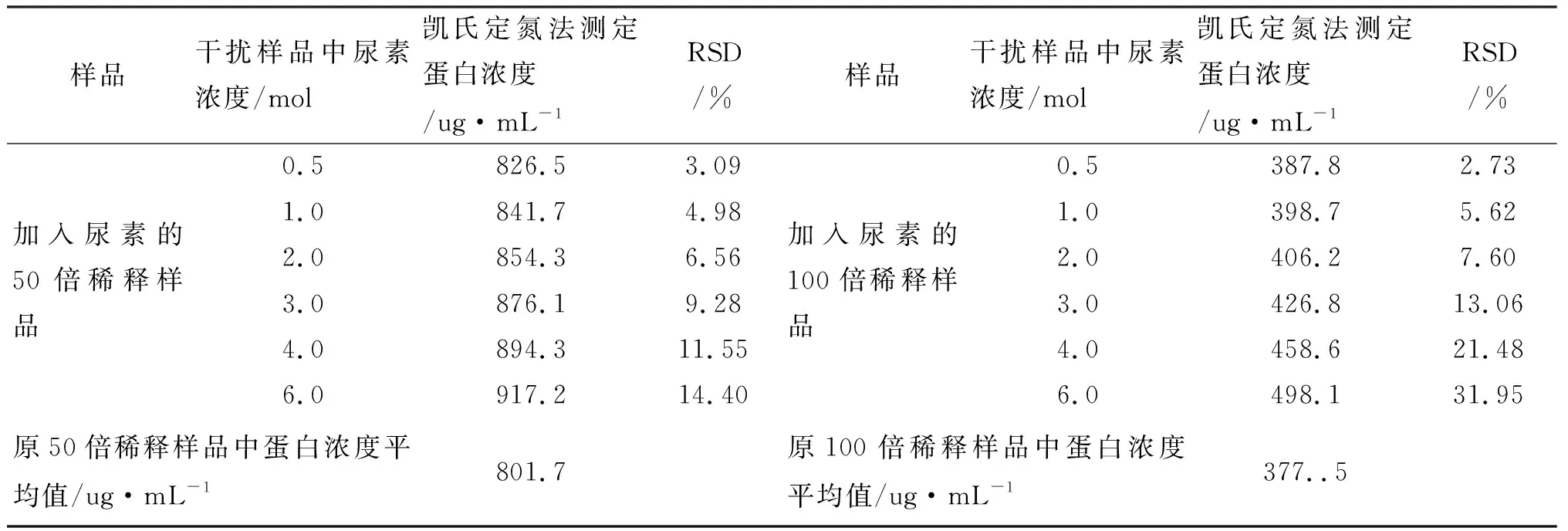
表2 微量凯氏定氮法测定尿素干扰样品结果

表3 微量凯氏定氮法测定氯化铵干扰样品结果

表4 微量凯氏定氮法测定碳酸铵干扰样品结果
2.3 微量凯氏定氮法测定牛奶稀释样品中蛋白浓度与干扰样品蛋白浓度比较
在表5~7的比较中,加入各浓度的不同种类干扰物质前后,相对误差随干扰物的浓度增加而不断增大;其中,100倍稀释牛奶样品的相对误差均在4.06%~32.05%,50倍稀释牛奶样品相对误差范围在0.99%~14.46%,显著小于100倍稀释样品的相对误差;其次,从表5~7的比较结果可以看出,在加入稀释牛奶样品的3种干扰物中,加入尿素的一组相对误差最大,加入氯化铵的一组相对误差相比最小,加入碳酸铵的一组相对误差居中.

表5 微量凯氏定氮法测定牛奶稀释样品与尿素干扰样品比较
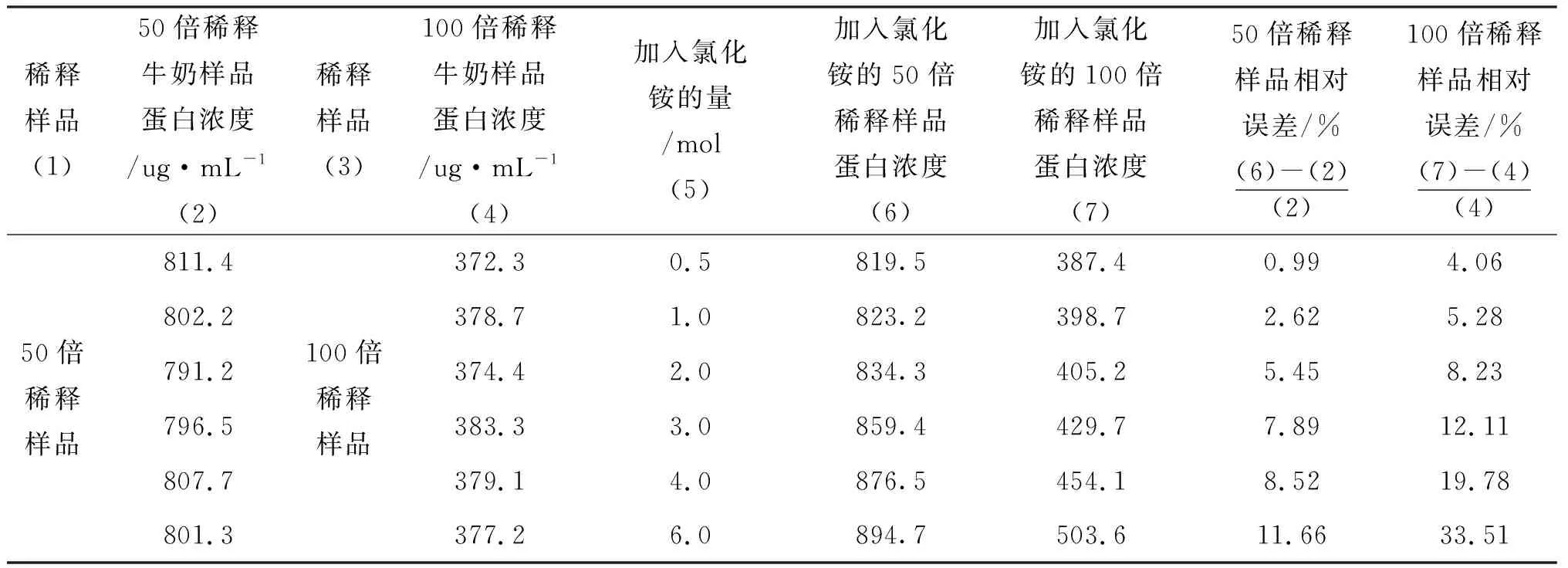
表6 微量凯氏定氮法测定牛奶稀释样品与氯化铵干扰样品比较

表7 微量凯氏定氮法测定牛奶稀释样品与碳酸铵干扰样品比较
3 讨论
微量凯氏定氮法的精确性和可重复性已经得到了国际的普遍认可,被广泛用于检测食品中蛋白质含量.本试验首先使用凯氏定氮法分别测定牛奶样品的不同浓度稀释品中的蛋白浓度,表1的结果显示50倍和100倍稀释样品中蛋白质浓度的变异系数分别为0.91%、1.02%,表明微量凯氏定氮法在测定牛奶样品中的蛋白含量稳定性好.在测定加入不同干扰物(尿素/氯化铵/碳酸铵)的50倍、100倍稀释牛奶的蛋白含量时,由表2、表3、表4结果显示其相对平均偏差均大于1%,相对标准偏差均大于2%,表明微量凯氏定氮法在测定加入不同干扰物的50倍、100倍稀释牛奶的蛋白含量时,重现性差,精密度也差,并且所测定的加入干扰物质的100倍稀释比50倍稀释牛奶牛奶的蛋白含量的准确性要差,这可能是因为相同量的干扰物质对相对稀释牛奶样品的蛋白含量影响更明显,因为相同量的干扰物质在相对稀释牛奶样品中相对较多,所占的分量较大.另外,凯式定氮法得到的尿素干扰牛奶样品中蛋白含量最高且误差最大的这一现象,这可能和加入牛奶样品中的不同干扰物的含氮量相关,尿素的含氮量为46.7%,碳酸铵含氮量为29.2%,氯化铵含氮量为26.2%,尿素中含量相对较高的非蛋白氮对微量凯氏定氮法的干扰也最明显,以至在加入稀释牛奶样品的3种干扰物中,加入尿素的一组相对误差最大.本实验在加入稀释牛奶样品的同一种干扰物中,随着加入的干扰物的量逐渐增加,干扰物对微量凯氏定氮法测定牛奶蛋白含量的干扰越明显,产生的相对误差也逐渐增大.例如在表5中,随着加入尿素干扰物的量逐渐增加,两种不同稀释度样品的相对误差分别从1.86%增加到14.46%,从4.16%增加到32.05%.总之,干扰物质中的非蛋白氮对微量凯氏定氮法测定牛奶蛋白含量有干扰,非蛋白氮含量越多,干扰越明显.
参考文献:
[1] 郭颖娜,孙 卫.蛋白质含量测定方法的比较[J].河北化工,2008,31(4):36-37.
[2] 陈智慧,史 梅,王秋香,等.用凯氏定氮法测定食品中的蛋白质含量[J].新疆畜牧业,2008,22(5):22-24.
[3] 王玉贤,强 洪.国产凯氏定氮仪测定食品中蛋白质的研究[J].分析试验室,2008,27(5):390-391.
[4] 汪家政,范 明.蛋白质技术手册[M].北京:科学出版社,2001.
[5] 田志梅.甲醛值滴定法快速测定牛奶中蛋白质含量[J].中国食品卫生杂志,2008,20(3):244-245.
[6] 陈 辉,刘振林,张忠义.凯氏定氮法测定牛奶中蛋白质的不确定度分析[J].中国卫生检验杂志,2004,14(3):373-374.
[7] 牛江梅.微波消解-凯氏定氮法测定食品中蛋白质的方法研究[J].实用预防医学,2003,10(5):780-781.
[8] 陆晓滨,李敬龙,董贝磊.提高凯氏定氮法蛋白质测定速度的研究[J].中国调味品,2003,6(1):37-39.
[9] 雷彩霞.凯氏定氮法测定粗蛋白应注意的几个问题[J].西部粮油科技,2003,(1):62-64.
[10] 于 雯,吕玉琼.全自动凯氏定氮仪测定食品中蛋白质[J].中国卫生检验杂志,2001,11(5):610.
[11] 武丽艳,郑翼腾,吴 勇,等.凯氏定氮装置的改进[J]. 化学通报,2008-2-12(B1):158-160.
[12] 夏道宗,陈明之,于新芬.过氧化凯氏定氮法在食品蛋白质分析中的应用[J].食品与药品,2005,5(4):54-56.
[13] 夏道宗,陈明之,于新芬.强化凯氏定氮法在蛋白质测定中的应用研究[J].江西食品工业,2005,3(1):24-25.
[14] 毕卫红,李 超,苗玉洁,等.利用近红外光谱技术对牛奶中蛋白质含量进行定量分析[J].计量技术,2005,(8):34-36.
