苍耳氯仿萃取物对粘虫的拒食作用及酶活性的影响
2010-11-27熊正燕
熊正燕,周 琼,苏 旭
(1.中南林业科技大学林学院,中国 长沙 410004;2. 湖南师范大学生命科学学院,中国 长沙 410081)
苍耳 (XanthiumsibiricumPatrin) 为菊科苍耳属 (XanthiumL .) 一年生草本植物,在我国各地均有分布.据报道,苍耳子可用于治疗多种疾病,并且具有一定程度的抑菌活性[1].对苍耳化学防御成分的系统研究结果显示,苍耳提取物对小菜蛾等多种害虫有生物活性[2-3],其不同溶剂提取物对害虫具有很强的拒食活性,其中,氯仿提取物的活性最高[4].在此基础上,作者进一步研究了苍耳氯仿萃取物对昆虫的拒食活性以及对昆虫中肠消化酶和血淋巴酯酶活性的影响,为苍耳活性次生物质对害虫作用机理的研究提供实验依据.
1 材料与方法
1.1 材料
粘虫(Pseudaletiaseparatawalker)由国家南方农药创制中心湖南基地提供,用玉米苗在养虫室内续代饲养,室温 (25±1)℃,60%~70% RH,测试时选取大小相近的健康幼虫供试.
苍耳采自湖南省湘潭市市郊.将采回的新鲜苍耳冲洗净尘土,晾干,50 ℃恒温烘干至脆,用植物试样粉碎机粉碎,过0.4 mm筛.粉末放置于4 ℃冰箱中保存.
1.2 方法
1.2.1 苍耳氯仿萃取物的制备 称取苍耳粉末,用5倍于粉末重量的甲醇在恒温水浴箱 (80 ℃) 中索氏提取器内回流24 h,倒出提取液,过滤,滤液浓缩至一定浓度,然后用氯仿萃取多次,萃取物浓缩至膏状,装于棕色瓶中,贴上标签,放于4 ℃冰箱中保存,测试前临时稀释.
1.2.2 选择性拒食活性的测定 拒食活性测定方法参照周琼[5]等方法,用蒸馏水将苍耳氯仿萃取物(稀释前先用丙酮溶解成1 g/mL)配成所需浓度的溶液,测试浓度根据前期测试结果,并参照张宗炳[6](1988)设定,分别为:0.025、0.05、0.1、0.25、0.5 g/mL.取玉米叶片中脉两侧的部分,裁成20 mm×20 mm的正方形,在配制好的测试液中浸渍2 s,取出待溶剂自然挥发,对照叶在相应量丙酮加蒸馏水中浸渍2 s,自然晾干.将2枚处理叶和2枚对照叶交错排列,放置在垫有湿滤纸的培养皿(Φ120 mm)中,每皿中处理组和对照组均为1枚正面朝上,1枚背面朝上.每皿接入1头粘虫4龄幼虫,测试前饥饿3 h,25 ℃饲养,测试期间及时添加相应处理后的玉米叶.24 h后将虫剔除,用透明方格纸测量取食面积.每浓度设10重复.
1.2.3酶活性的测定 用浸渍叶片法将浓度0.01 g/mL的苍耳氯仿萃取物处理的玉米叶饲喂试虫,分别取喂食后12 h和24 h存活的粘虫四龄幼虫供试.
1.2.3.1 中肠酶活性测定方法 每试取10头存活幼虫,将试虫在冰浴中迅速解剖,用预热的0.15 mol/L NaCl溶液冲去体液,用镊子抽取中肠,除去内含物,冰冻匀浆,离心15 min(11 200 r/min,4 ℃),取上清液定容至10 mL(即1 mL/中肠).冰冻贮存(-20 ℃);蛋白质含量测定采用考马斯亮蓝法[7],以酪蛋白作为标准建立标准曲线;参照陈长琨(1993)方法测定羧酸酯酶活性,以α-萘酚含量和OD值做标准曲线[8];采用二硝基水杨酸法[9]测定中肠淀粉酶活性;采用福林-酚法[10]测定蛋白酶活性.用umol/(mg蛋白质*min)表示酶比活力.每组重复3次.
1.2.3.2 血淋巴酯酶活性测定方法 试虫用蒸馏水洗净,刺破腹足,用2 mL离心管收集血淋巴,加入苯基硫脲(约占总体积的0.5%)防止氧化,置于-20 ℃冰箱中保存,保存不超过4 d;蛋白质含量与羧酸酯酶活性测试方法同上.每组重复3次.
1.3 实验数据处理
利用SPSS软件处理数据统计分析.
选择性拒食率=〔 ( 对照组取食面积-处理组取食面积 ) / ( 对照组取食面积+处理组取食面积 ) 〕× 100%
参照贾春生的方法[11]求回归方程,计算拒食中浓度(AFC50).
酶活性抑制率=﹝(对照组酶比活力-处理组酶比活力)/ 对照组酶比活力﹞×100%
2 结果与分析
2.1 苍耳氯仿萃取物对粘虫的拒食作用
喂食后24 h,对幼虫取食叶片的面积进行统计分析.结果表明,氯仿萃取物对粘虫四龄幼虫的取食有明显影响,呈明显的剂量-效应关系,在所测试的浓度范围,随处理浓度增加,对粘虫的拒食活性增强,其拒食中浓度(AFC50)为0.038 g/mL(如表1).

表1 苍耳氯仿萃取物对粘虫四龄幼虫的选择性拒食率(24 h)
**差异极显著.
2.2 苍耳氯仿萃取物对粘虫中肠消化酶活性的影响
2.2.1 苍耳氯仿萃取物对粘虫中肠蛋白酶活性的影响 分别于喂食后12 h和24 h取出10头幼虫进行蛋白质含量和蛋白酶活性测试.结果显示(图1),处理组粘虫中肠蛋白酶比活力明显低于对照(P<0.05):喂食后12 h,蛋白酶活性抑制率为39.4%;喂食后24 h,蛋白酶活性抑制率高达67.9%.
2.2.2 苍耳氯仿萃取物对粘虫中肠淀粉酶活性的影响 用经氯仿萃取物处理后的玉米叶片饲养粘虫四龄幼虫后,测试粘虫淀粉酶活性结果显示(图2),处理组粘虫中肠淀粉酶比活力明显受到抑制:喂食后12 h,淀粉酶活力受到的抑制率为27.1%;喂食后24 h,抑制率达到58.3%.
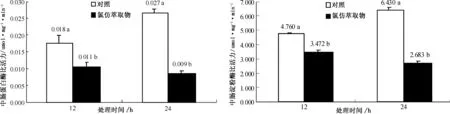
图1 苍耳氯仿萃取物对粘虫幼虫中肠蛋白酶活性的影响 图2 苍耳氯仿萃取物对粘虫幼虫中肠淀粉酶活性的影响
2.2.3 氯仿萃取物对粘虫中肠羧酸酯酶(CarE)活性的影响 喂食后12 h,粘虫中肠CarE比活力与对照组相近,这可能与粘虫取食有毒物质较少有关,喂食后24 h,粘虫中肠CarE受到明显抑制,活性降低,活性抑制率为31.28%.
2.3 氯仿萃取物对粘虫血淋巴羧酸酯酶(CarE)活性的影响
以0.01g/mL的苍耳氯仿萃取物饲养粘虫四龄幼虫,然后对其体内羧酸酯酶活性进行了测定.结果显示(图4),喂食后12 h,粘虫血淋巴CarE活性则显著低于对照(P<0.05);喂食后24 h,血淋巴CarE活性则明显高于对照(P<0.05).
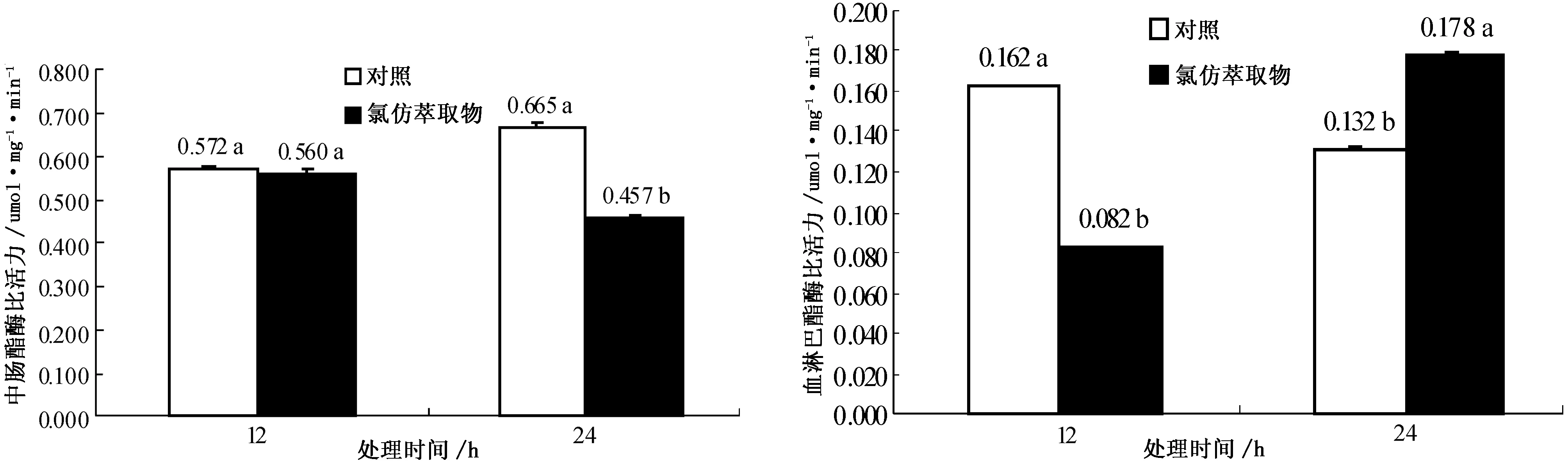
图3 苍耳氯仿萃取物对粘虫幼虫中肠羧酸酯酶活性的影响 图4 苍耳氯仿萃取物对粘虫幼虫血淋巴羧酸酯酶活性的影响
3 讨论
苍耳氯仿萃取物对粘虫四龄幼虫的拒食作用和对粘虫中肠消化酶活性的影响结果表明,苍耳氯仿萃取物中含有拒斥粘虫取食的物质.
蛋白酶和淀粉酶是昆虫体内重要的消化酶[12],影响着昆虫对食物的消化和吸收利用.昆虫中肠是消化酶分泌的主要场所,消化酶活性的变化反映了生长发育的需要[13].本研究结果表明,用氯仿萃取物处理粘虫四龄幼虫,能引起中肠淀粉酶、蛋白酶和酯酶活性发生改变,随处理时间的延长,对3种消化酶活性的抑制作用增强,具体表现为:在喂食后24 h时,粘虫中肠蛋白酶和淀粉酶活性受到的抑制率几乎是喂食后12 h活性抑制率的2倍;同时,在喂食后12 h,处理组粘虫中肠羧酸酯酶活性只略微降低,与对照组差异不显著,到24 h后明显降低且与对照差异显著,说明苍耳氯仿萃取物中含有能明显抑制粘虫幼虫中肠消化酶活性的物质,并且随时间的延长和粘虫取食量的增加抑制效果增强.根据以上分析,作者认为苍耳氯仿萃取物对粘虫四龄幼虫消化酶活性的抑制,可能是影响其取食的重要因素之一.
羧酸酯酶(CarE)又是昆虫体内的一种代谢解毒酶,是昆虫进行杀虫剂代谢的重要解毒酶系,有研究表明,植物次生物质可诱导激活或抑制害虫体内与杀虫剂代谢相关的解毒酶系,从而导致害虫对药剂敏感性的变化[14].粘虫血淋巴中羧酸酯酶活性的表现与中肠羧酸酯酶活性的表现不同,处理后12 h时明显低于对照,24 h又明显高于对照,这可能与昆虫血淋巴内营养物质的利用和解毒活性相关,中肠酯酶活性被粘虫所取食的含有苍耳氯仿提取物的食物抑制,而该活性物质进入血淋巴后,先抑制血淋巴中的羧酸酯酶活性,同时,该物质还诱导粘虫产生保护性的解毒反应,进而激活血淋巴羧酸酯酶活性升高.
植物次生物质以多种方式影响昆虫和其他草食性动物,如剧毒、致畸、干扰激素以及影响食物的消耗和利用[15]等.本研究显示苍耳氯仿萃取物可明显抑制粘虫幼虫中肠消化酶活性,并诱导激活该虫血淋巴羧酸酯酶活性,已有的研究[16-17]表明,从苍耳乙酸乙酯萃取物和氯仿萃取物中分离出的倍半萜内酯类和甾醇类物质是苍耳的重要活性次生物质,有关其对昆虫的行为、生理生化和生长发育等影响以及昆虫的行为化学感受机制等研究工作仍在进行中,以期为昆虫与植物相互关系的研究和害虫的综合治理提供有益的线索.
参考文献:
[1] 张君霞. 十五种植物提取物抑菌活性的初步研究[J]. 甘肃农业大学学报, 2003, 12(2): 122-124.
[2] 周 琼, 梁广文, 曾 玲. 几种植物提取物和药剂对桃蚜和萝卜蚜生长发育的影响[J]. 中国蔬菜, 2005,(2): 15-17.
[3] 周 琼, 刘炳荣, 舒迎花, 等. 苍耳等药用植物提取物对小菜蛾的拒食作用和产卵忌避效果[J]. 中国蔬菜, 2006,(2): 17-20.
[4] 张君霞, 张新虎, 杨小华. 苍耳不同溶剂提取物对粘虫和蚜虫的杀虫活性研究[J]. 西北师范大学学报:自然科学版, 2006, 42(3): 82-85.
[5] 周 琼, 魏美才, 刘炳荣,等. 苍耳不同分离物对害虫的拒食和忌避活性[J]. 植物保护, 2007, 33(6): 81-85.
[6] 张宗炳. 杀虫药剂的毒力测定(原理、方法、应用)[M]. 北京: 科学出版社, 1988.
[7] BRADFORD M M . A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye bingding [J]. Anal Biochem, 1976, 7(72):248-254.
[8] 陈长琨. 昆虫生理生化实验[M]. 北京:中国农业出版社, 1993.
[9] BLACKBUN M, GOLUBEVA E, BOWEN D,etal. A novel insecticidal toxin from Photorhabdus luminescens, Toxin complex a (Tca), and its histopathological effects on the midgut of Manduca sexta [J]. Appl Environ Microbiol, 1998, 64: 3 036-3 041.
[10] 周景祥, 王桂芹, 余 涛. 蛋白酶和淀粉酶活性检测方法探讨[J]. 中国饲料, 2001, (11):23-24.
[11] 贾春生. 利用SPSS 软件计算杀虫剂的LC50[J]. 昆虫知识, 2006, 43(3): 414-417.
[12] 师光禄, 王有年, 王鸿雷, 等. 万寿菊根提取物对山楂叶螨谷胱甘肽S-转移酶和蛋白酶及蛋白质含量的影响[J]. 应用生态学报, 2007, 18(2): 400-404.
[13] 唐庆峰,吴振廷, 金 涛, 等. 中华真地鳖中肠主要消化酶的活性研究[J]. 昆虫知识, 2005, 42(5): 557-561.
[14] BRATTSTEN L B. Potential role of plant allelochemical in the development of insecticide resistance [C]//BARBOSA P,LETOURNEAU D K. Novel Aspects of Insect-plant Interaction. New York: Wiley, 1998:313-348.
[15] LINDROTH R L. Differential toxicity of plant allelochemicals to insects: roles of enzymatic detoxication systems[J]. Insect-Plant Interactions, 1991,(3): 1-33.
[16] 周 琼,魏美才,欧晓明,等. 苍耳活性组分对害虫的拒食和忌避作用及其化学成分[J]. 植物资源与环境学报,2009,18(1):74-79.
[17] 周 琼,魏美才,欧晓明,等. 苍耳倍半萜内酯和博落回生物碱对3种蔬菜害虫的活性比较[J]. 植物保护,2008, 24(3):78-82.
