N-(4-氯-3-三氟甲基苯基)-N′-(对取代苯基)脲的合成
2010-11-26闫凤美郭彦春刘贺钦
闫凤美, 郭彦春, 刘贺钦
(1. 黄淮学院 化学化工系,河南 驻马店 463000; 2. 郑州大学 化学系,河南 郑州 450052)
取代脲类化合物因结构中存在抑制酶活性的基本骨架脲桥键(-NHCONH-),已被广泛开发为植物生长调节剂、除草剂、杀虫剂及医药中间体[1,2]。近年来,取代脲在分子识别、自组装等超分子化学领域也显示良好的应用前景,已引起超分子化学家的广泛关注[3,4]。因此进行取代脲类化合物的合成研究,对建立此类有效活性农药筛选库及合成选择性受体具有十分重要的意义。
本文在文献[5~8]方法的基础上,以4-氯-3-三氟甲基苯胺(1),固体光气和对取代苯胺为原料,采用一锅法合成了N-(4-氯-3-三氟甲基苯基)-N′-(对甲基苯基)脲(3a)和N-(4-氯-3-三氟甲基苯基)-N′-(对溴苯基)脲(3b)(Scheme 1),其结构经1H NMR, IR和元素分析表征。
Scheme1
1 实验部分
1.1 仪器与试剂
X-4型数字显微熔点仪(北京泰克仪器有限公司);DPX-400型超导核磁共振仪(DMSO-d6为溶剂,TMS为内标);PE-1710型红外光谱仪(KBr压片);PE-2400CHN型元素分析仪。
所用试剂均为市售分析纯或化学纯。
1.2 合成
(1) 1的合成[9]
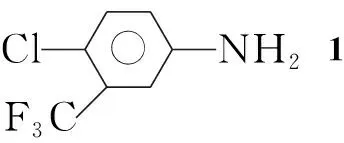
在反应瓶中加入2-氯-5-硝基三氟甲苯10.15 g(45 mmol)的乙醇(95%, 120 mL)溶液和Pd/C 0.1 g,搅拌下于室温反应2.5 h。过滤,滤液蒸除溶剂得无色液体,冷却,有琥珀色晶体析出,过滤,滤饼干燥得微黄色针状晶体,用无水乙醇重结晶得白色针状晶体1,收率82.6%,纯度99.87%(HPLC,下同), m.p.36 ℃~38 ℃;1H NMR(CDCl3)δ: 7.26~7.21(d,J=2.0 Hz, 1H, ArH),6.96~6.95(d,J=4.0 Hz, 1H, ArH), 6.71~6.70(d,J=4.0 Hz, 1H, ArH), 3.82(s, 2H, NH); IRν: 3 403(N-H), 3 030, 1 628, 1 486, 1 175, 1 132, 748, 666, 532, 458, 405 cm-1; Anal.calcd for C7H5ClF3N: C 42.99, H 2.58, N 7.16; found C 42.96, H 2.59, N 7.15。
(2) 3的合成
在三颈烧瓶中加入固体光气1.48 g(5 mmol)和1,2-二氯乙烷10 mL,冰水浴冷却,于0 ℃~5 ℃搅拌至固体光气全部溶解。滴加1 1.95 g(10 mmol)的1,2-二氯乙烷(20 mL)溶液,滴毕,于室温反应约30 min;回流(约50 ℃)反应约4 h(TLC跟踪)得含4-氯-3-三氟甲基苯异氰酸酯(2)的微黄油状物。控温50 ℃,回流状态下通N2(带出反应生成的氯化氢气体和过量的光气)至反应液呈中性。停止通N2,滴加对甲基苯胺1.07 g(10 mmol)的1,2-二氯乙烷(10 mL)溶液,滴毕,继续反应1.5 h(TLC跟踪)。冷却、静置、抽滤,滤饼用1,2-二氯乙烷洗涤,干燥得粗品,用混合溶剂[V(乙醇) ∶V(水)=1 ∶1]重结晶得3a。
用对溴苯胺代替对甲基苯胺,同法制得3b。
3a: 白色晶体,收率71.8 %,纯度98.9%, m.p.235 ℃~237 ℃;1H NMRδ: 9.07~8.46(s, 2H, NH), 8.08~7.04(m, 7H, ArH), 2.23~2.22(s, 3H, CH3); IRν: 3 288(N-H), 1 684(C=O), 1 562, 1 481 cm-1; Anal.calcd for C15H12N2OF3Cl: C 54.80, H 3.68, N 8.52; found C 54.76, H 3.67, N 8.55。
3b: 白色晶体,收率75.3%,纯度99.8%, m.p.267 ℃~269 ℃;1H NMRδ: 8.85(s, 2H, NH), 7.47~7.41(m, 7H, ArH); IRν: 3 298(N-H), 1 634(C=O), 1 590, 1 549 cm-1; Anal.calcd for C14H9N2OF3ClBr: C 42.72, H 2.30, N 7.12; found C 42.68, H 2.30, N 7.14。
2 结果与讨论
2.1 表征
在3的IR谱中,3 200 cm-1~3 400 cm-1处有N-H吸收,C=O双键受两个氮的影响,产生p-π共轭效应,极性增强,双键性降低,向低波数移动至1 630 cm-1~1 730 cm-1。元素分析结果表明,实测值与理论值基本一致。
2.2 合成
采用二氯甲烷作为溶剂,反应温度控制在50 ℃左右,可以防止高温下生成的取代苯异氰酸酯(2)发生自聚,有效地避免了对称脲副产物的生成。苯胺与三光气的摩尔比十分重要。本反应采用固体光气稍过量的方法,因为1 mol固体光气可产生3 mol光气,若苯胺过量,则2仍可继续与溶液中未反应的伯胺反应,生成副产物对称脲。另外,加料次序对反应也有极大的影响,先加入1才能得到目标产物。
另外,取代基对反应温度产生一定的影响,对位为甲基时需加热到45 ℃~50 ℃;对位为溴时则需加热至50 ℃~55 ℃。这可能是由于取代苯胺和2发生亲核加成反应时,对溴苯胺中的溴虽同时具有-I效应和+C效应,但-I>+C效应,溴的-I效应起主要作用,溴的吸电性使氨基N原子上的电子云密度降低,导致亲核能力下降,不利于反应的进行;而甲基则同时具有+I效应和+C效应,使N原子上的电子云密度升高,有利于反应的发生。
3 结论
以稍过量的固体光气和取代苯胺为起始原料,先得到相应的异氰酸酯,不经分离纯化,再与其他取代苯胺反应合成了两种双芳基取代脲。该法具有操作安全方便,反应条件温和,反应计量准确,能有效避免对称脲副产物的生成等优点,期待通过进一步的研究合成出具有更为优良特性的化合物。
[1] 宋新建,王胜,吴绍艳.N-[5-(1-邻氯苯氧乙基)-1,3,4-噻二唑-2-基]-N′-芳酰基脲的合成及其生物活性[J].应用化学,2006,23(4):444-446.
[2] Wang S, Allan R D, Skerritt J H,etal. Development of a class-specific competitive ELISA for the benzoylphenylurea insecticides[J].Journal of Agricultural and Food Chemistry,1998,46(8):3330-3338.
[3] Tobe Y, Sasaki S I , Mizuno M,etal. Novel self-assembly ofm-xylylene type dithioureas by head-to-tail hydrogen bonding[J].J Org Chem,1998,63(21):7481-7489.
[4] Kyne GM, Light M E, Hursthouse M B,etal. Enantionselective amino acid recognition using acyclic thiourea receptors[J].J Chem Soc Perkin Trans 1,2001,11:1258-1263.
[5] Piskov V B, Kasperovich V P, Tsvetkov E I,etal. Carbanilides containting amidine and imidazoline groups[J].Khimiko Farmatsevticheskii Zhurnal,1974,8(6):17-20.
[6] 聂丽,张强,吴小娟. 2,4-二氯苯氧乙酰氨基(硫)脲类衍生物的合成及生物活性[J].应用化学,2007,24(4):477-479.
[7] 冯桂荣,张相平,张会茹,等. 双芳基脲衍生物的合成[J].河北化工,2005,28(5):34-35.
[8] 付建龙,王喆,祝慧.N,N′-双(4-氯苯基)脲合成新工艺的研究[J].化学试剂,2007,29(3):187-188.
[9] Robert Filler, Herman Novar. 2- and 3-trifluoromethylyltyrosines.Hydrolytic stability of the trifluoromethyl group on the aromatic nucleus[J].Fluorinated Aromatic Amino Acids Ⅱ,1961,8:2707-2710.
