3-苯基异香豆冉酮衍生物的不对称Mannich反应研究
2010-11-26刘灏,蒋琳
刘 灏, 蒋 琳
(四川大学 华西药学院,四川 成都 610041)
构建手性季碳中心一直是不对称合成反应中最具挑战性的工作[1~3]。 3-取代异香豆冉酮作为亲核试剂为构建手性季碳中心提供了一种直接策略。
以3-取代异香豆冉酮为母核的化合物及其衍生物是重要的有机合成中间体,可用于合成医药、农药,新型抗氧剂[4],是近十年来发展起来的一类新型的抗氧化剂,效果突出,发展很快,有人甚至称其为“ 革命性的聚烯烃加工助剂”。
本文研究了以手性硫脲-叔胺化合物(A~I, Chart 1)为双功能Brønsted酸-Brønsted碱催化剂[5~8]催化3-苯基异香豆冉酮衍生物(1a~1f, Chart 2)与N-保护亚胺(2a~2h, Chart 3)的不对称Mannich反应[9~16],高收率、高映选择性地合成了一系列具有连续季碳叔碳手性中心的新化合物(3a~3l, Scheme 1)[17~19],其结构经1H NMR和13C NMR表征。
考察了A~I的催化活性,并以1a和2k反应合成3p(Scheme 2)为例,考察了溶剂和温度对反应的影响。另外还对N-保护亚胺的保护基团(2h~2k, Chart 3)进行了筛选,确定反应的最适条件,并在最适条件下对反应底物进行扩展,得到了一系列具有很高对映选择性及较高非对映选择性并含两个连续手性中心的新化合物。


CompABCDEFRCF3F3C-F---OTBS

Chart 1

Chart 2
Chart3

Chart4



Scheme1
1 实验部分
1.1 仪器与试剂
Varian IONVA2 400型核磁共振仪(CDCl3为溶剂,TMS为内标)。
催化剂A~F[5,6]和底物2a~2k[20,21]按文献方法合成;其余所用试剂均为市售分析纯。
1.2 合成
(1) 1的合成(以1a为例)[22]
在反应瓶中加入苯酚2.8 g(30 mmol)和扁桃酸3.0 g(20 mmol),冰浴冷却,搅拌下缓慢加入70%硫酸20 mL,于0 ℃搅拌至溶清;于110 ℃反应45 min。冷却至室温,倒入冰水中,用二氯甲烷(3×50 mL)萃取,合并有有机层,用饱和NaHCO3溶液洗涤,无水硫酸钠干燥,浓缩后用乙醇重结晶得白色粉末3-苯基异香豆冉酮(1a),收率26%;1H NMRδ: 7.30~7.40(m, 4H), 7.20~7.26(m, 5H)。
用类似的方法合成1b~1f。
(2) 3的合成(以3a为例)
在反应试管中依次加入催化剂D0.01 mmol,1a0.1 mmol, 4 Å分子筛15 mg及甲苯0.5 mL,氩气保护,搅拌下加入2a0.15 mmol,于-40 ℃反应。反应液经柱层析[洗脱剂:V(石油醚) ∶V(乙酸乙酯)=10 ∶1]分离得白色固体3a。
用类似的方法合成3b~3p。



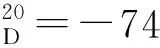








2 结果与讨论
2.1 催化剂的催化活性筛选

表1 催化剂的催化活性筛选*Table 1 Screening of catalytic activity of catalysts
*1a0.10 mmol, 2k0.15 mmol, 催化剂10 mol%,甲苯0.5 mL,于-40 ℃反应6 h,其余反应条件同1.2(2);主产物的ee值和d/r由HPLC测定
以1a(0.1 mmol)与2k(0.15 mmol)反应合成3p为模型,考察催化剂的催化活性,结果见表1。从表1可见,催化剂C,D和E的催化效果明显优于其他催化剂,其中D在对映选择性和非对选择性上均为最佳。以下的条件考察均以D为催化剂。
2.2 Mannich反应条件的筛选
(1) 溶剂对反应的影响
以D(10 mol%)为催化剂,1a0.10 mmol,于-78 ℃反应12 h,其余反应条件同表1,考察溶剂对反应的影响,结果见表2。由表2可见,以甲苯为溶剂最佳。

表2 溶剂对Mannich反应的影响*Table 2 Effect of solvent on Mannich reaction
*D10 mol%,于-78 ℃反应12 h,其余同表1; TBME(甲基叔丁基醚)
(2) 温度对反应的影响
以甲苯为溶剂,其余反应条件同2.2(1),考察温度对反应的影响,结果见表3。由表3可见,于-40 ℃反应3p获得最高的ee值,但随着温度继续下降ee值反而略有下降,d/r值并没有明显的提高。综合考虑温度对ee值,d/r值及反应时间的影响,认为-40 ℃为反应的最适温度。

表3 反应温度对Mannich反应的影响*Table 3 Effect of temperature on Mannich reaction
*同表1
(3) 亚胺保护基团对反应的影响
1a(0.1 mmol)分别与2a, 2h~2k反应合成3a,3m~3p(Chart 4和Scheme 1)的反应(反应条件同表1)考察了N-保护亚胺的保护基团对反应的影响,结果见表4。从表4可以看出,由氨基甲酸甲酯构成的2a作为底物参与反应结果最为理想,能够得到很高的ee值(93%)和不错的d/r值(6.3/1.0)。

表4 亚胺保护基团对Mannich反应的影响*Table 4 Effects of N-protection group on Mannich reaction
*2a于-40 ℃反应4 h; 2h~2k在-20 ℃反应,其余同表1
综上所述,以1和2为底物的Mannich加成反应的最佳反应条件为:以D(10 mol%)为催化剂,甲苯为溶剂,氩气保护于-40 ℃反应4 h。
2.3 1和2上的取代基对Mannich反应的影响
考虑到1与2上的取代基所产生的吸电子和给电子效应可能对反应的对映选择性和非对映选择性产生不同的影响,从而选择了具有不同取代基的芳香环的底物合成了3a~3l(Chart 4和Scheme 1),结果见表5。由表5可见,无论反应底物上芳基取代基含有吸电子基团还是供电子基团,反应均可以得到很高的ee和较高的d/r值;而含有杂环和脂肪链的底物虽然仍可以获得很高的ee值,但是d/r值较含芳环的化合物有明显的降低。

表5 1和2上的取代基对反应的影响*Table 5 Effect of substituents of 1 and 2 on the Mannich reaction
*2(0.10 mmol),D(10 mol%)为催化剂,于-40 ℃反应4 h,其余同表1
3 结论
实现了手性硫脲-叔胺催化3-取代异香豆冉酮与N-保护亚胺的不对称Mannich反应,成功合成了一系列具有连续季碳叔碳手性中心的化合物,并且获得了很高的对映选择性及较高的非对映选择性。无论当反应底物芳基取代基含有吸电子基团还是供电子基团,反应均可以得到很高的ee值和较高的d/r值;含有杂环和脂肪链的底物虽然仍可以得到很高的ee值,但是d/r值较含芳环的化合物有明显的降低。由于化合物含有两个手性中心,绝对构型需经单晶衍射才能确定,该类反应更深入的研究仍在进行中。
[1] Christoffers J, Baro A. Stereoselective construction of quaternary stereocenters advanced synthesis & catalysis[J].Adv Synth Catal,2005,347:1473-1482.
[2] Peterson E A, Overman L E. Contiguous stereogenic quaternary carbons:A daunting challenge in natural products synthesis[J].Proc Natl Acad Sci,USA,2004,101:11943-11948.
[3] Liu T Y, Chen Y C. Enantioselective construction of quaternary carbon centre catalysed by bifunctional organocatalyst[J].Org Biomol Chem,2006,4:2097-2099.
[4] 高彬,高占先,贾晓珑. 3-芳基取代苯并呋喃-2-酮类化合物的合成进展[J].化工中间体,2005,4:37-39.
[5] Doyle A G, Jacobsen E N. Small-molecule H-bond donors in asymmetric catalysis[J].Chem Rev,2007,107(12):5713-5743.
[6] Okino T, Hoashi Y, Takemoto Y. Enantioselective Michael reaction of nalonates to nitroolefins catalyzed by bifunctional organocatalysts[J].J Am Chem Soc,2003,125:12672-12673.
[7] Li B J, Jiang L, Liu M,etal. Asymmetric Michael addition of arylthiols toα,β-unsaturated carbonyl compounds catalyzed by bifunctional organocatalysts[J].Synlett,2005,4:603-606.
[8] Wang Y Q, Song J, Hong R,etal. Asymmetric Friedel-Crafts reaction of indoles with imines by an organic catalyst[J].J Am Chem Soc,2006,128:8156-8157.
[9] Jacobsen E N, Pfaltz A, Yamamoto H,etal. Comprehensive asymmetric catalysis[M].Springer:Berlin,Germany,2003.
[10] Ting A, Schaus S E. Organocatalytic asymmetric Mannich reactions:New methodology,catalyst design,and synthetic applications[J].Eur J Org Chem,2007,2007:5797-5815.
[11] Wenzel G, Jacobsen E N. Asymmetric catalytic Mannich reactions catalyzed by urea derivatives:Enantioselective synthesis ofβ-aryl-β-amino acids[J].J Am Chem Soc,2002,124:12964 -12965.
[12] Liu T Y, Chen Y C. Organocatalytic and highly stereoselective direct vinylogous Mannich reaction[J].J Am Chem Soc,2007,129:1878-1879.
[13] Tian X, Chen Y C. Organocatalytic stereoselective Mannich reaction of 3-substituted oxindoles[J].Org Lett,2008,10:3583-3586.
[14] Han B, Deng J G, Chen Y C. Discovery of bifunctional thiourea/secondary-amine organocatalysts for the highly stereoselective nitro-Mannich reaction ofα-substituted nitroacetates[J].Chem Eur J,2008,14:8094-8097.
[15] Zhang Y, Chen Y C. Organocatalytic enantioselective Mannich-type reaction of phosphorus ylides:Synthesis of chiralN-boc-β-amino-α-methylene carboxylic esters[J].J Am Chem Soc,2008,130:2456-2457.
[16] Song J, Wang Y, Deng L. The Mannich reaction of malonates with simple imines catalyzed by bifunctional cinchona alkaloids:Enantioselective synthesis ofβ-amino acids[J].J Am Chem Soc,2006,128:6048-6049.
[17] Taylor M S, Jacobsen E N. Enantioselective Michael additions toα,β-unsaturated imides catalyzed by a salen-Al complex[J].J Am Chem Soc,2003,125:11204-11205.
[18] Li H, Wang Y, Tang L,etal. Stereocontrolled creation of adjacent quaternary and tertiary stereocenters by a catalytic conjugate addition[J].Angew Chem,Int.Ed,2005,44:105-108.
[19] Poulsen T B, Alemparte C, Saaby S,etal. Direct organocatalytic and highly enantio- and diastereoselective Mannich reactions ofα-substitutedα-cyanoacetates[J].Angew Chem,Int Ed,2005,44:2896-2899.
[20] Trost B M, Jaratjaroonphong J, Reutrakul V. A direct catalytic asymmetric Mannich-type reaction via a dinuclear zinc catalyst:Synthesis of either anti- or syn-α-hydroxy-β-amino ketones[J].J Am Chem Soc,2006,128:2778-2779.
[21] Loev B, Kormendy M F. An improved synthesis of carbamates[J].J Org Chem,1963,28:3421-3426.
[22] Peris G, Vedejs E. Diastereoselective carboxyl migrations of 3-arylbenzofuranones[J].J Org Chem,2008,73:1158-1161.
