手性磷酸催化的吲哚与乙醛酸乙酯亚胺的不对称傅克烷基化反应
2010-11-26杨彩梅倪承燕刘全忠
杨彩梅, 倪承燕, 刘全忠
(西华师范大学 化学化工学院,四川 南充 637002)
不对称傅克反应是形成碳碳键的重要方法之一[1~2],它提供了一种非常有效的制备含有苄位手性中心化合物的方法。吲哚与亚胺的不对称傅克近年来受到越来越多地关注[3~9]。
乙醛酸酯亚胺与吲哚及其衍生物反应生成的甘氨酸衍生物是一类重要的氨基酸[10~13],合成该类氨基酸最直接的方法是吲哚与亚胺的傅克反应。手性磷酸催化剂常被用于催化亚胺和烯胺类化合物的傅克反应[14]。本文报道手性磷酸催化剂(1a~1i, Chart 1)催化吲哚及其衍生物(2a~2i)与乙醛酸乙酯亚胺(3)的傅克烷基化反应,成功地合成了一系列吲哚取代的甘氨酸衍生物(4a~4i,其中4b和4e为新化合物, Scheme 1),其结构经1H NMR表征。

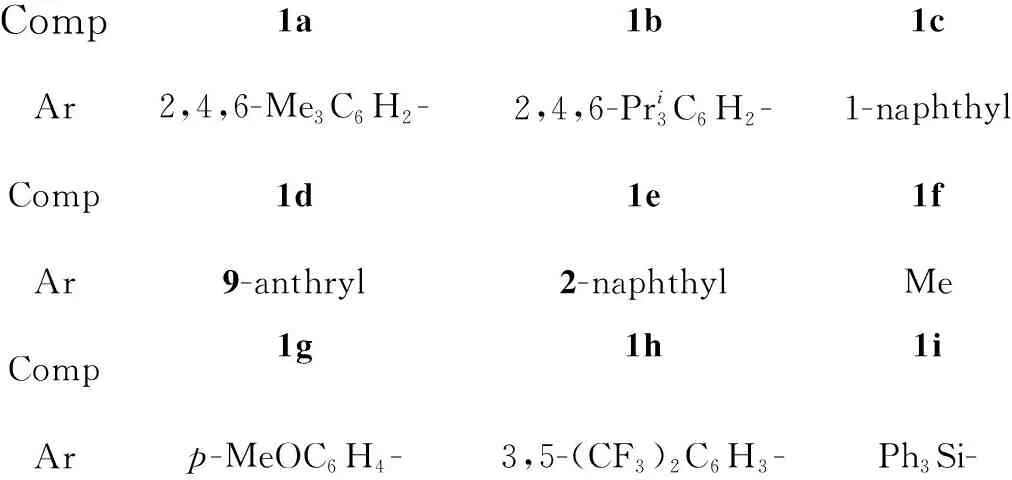
Comp1a1b1cAr2,4,6-Me3C6H2-2,4,6-Pri3C6H2-1-naphthylComp1d1e1fAr9-anthryl2-naphthylMeComp1g1h1iArp-MeOC6H4-3,5-(CF3)2C6H3-Ph3Si-
Chart 1
Scheme1
1 实验部分
1.1 仪器与试剂
电热数字型显示熔点仪(温度计未校正);Brucker AVANCE-300型核磁共振仪(CDCl3为溶剂,TMS为内标);Waters-510型高效液相色谱仪[2996紫外检测器,检测波长217 nm; OD-H手性柱;流动相:V(正己烷) ∶V(异丙醇)=8 ∶2;流速1.0 mL·min-1]。
1a~1h[15],1i[16]按文献方法合成;对甲氧基苯胺,国药试剂有限公司;其余所用试剂均为分析纯。
1.2 合成
(1) 3的合成
在干燥的试管中加入对甲氧基苯胺24.6 mg(0.2 mmol), 4 Å MS 0.1 g,氮气保护下加入乙醛酸甲酯20.4 mg(0.2 mmol)的甲苯(25.8μL)溶液和甲苯2 mL,搅拌下于室温反应2 h。过滤,滤液用无水二氯甲烷(DCM)洗涤,减压除溶得黄色油状液体3。氮气保护下,用无水DCM配成c(3)=10 mg·mL-1溶液待用。
(2) 4的合成(以4a为例)
在干燥试管中加入吲哚(2a)0.1 mmol和1a0.02 mmol,氮气保护下于低温槽(-78℃)中冷却10 min后缓慢滴加3 0.12 mmol(需30 min),于-78 ℃反应(TLC检测)。加入NaHCO3(1 mL)淬灭反应,用DCM(9 mL)提取,提取液用饱和食盐水(10 mL)洗涤,无水硫酸钠干燥。减压除去溶剂,残余物经柱层析[洗脱剂:A=V(石油醚) ∶V(乙酸乙酯)=5 ∶1]分离得浅黄色固体4a。
用类似的方法合成4b~4i(A=5 ∶1~3 ∶1)。
4a:1H NMRδ: 1.24(t,J=7.2 Hz, 2H), 3.72(s, 3H), 4.10~4.28(m, 2H), 5.33(s, 1H), 6.63(d,J=9.0 Hz, 2H), 6.75(d,J=9.0 Hz, 2H), 7.32(d,J=8.0 Hz, 1H), 7.82(d,J=7.7 Hz, 1H), 8.13(br, 1H); HPLC: tmajor=17.64 min, tminor=22.36 min。
4b:1H NMRδ: 1.19(t,J=7.1 Hz, 3H), 3.72(s, 3H), 3.92(s, 3H), 4.09~4.25(m, 2H), 5.66(s, 1H), 6.56(d,J=7.6 Hz, 1H), 6.67~6.75(m, 4H), 6.96(d,J=8.2 Hz, 1H), 7.09~7.14(m, 2H); HR-MSm/z: Calcd for (C20H22N2O4+H)+355.165 8, found 355.165 1; HPLC: tmajor=34.78 min, tminor=22.36 min;
4e:1H NMRδ: 1.20(t,J=7.2 Hz, 3H), 2.46(s, 3H), 3.72(s, 3H), 4.11~4.28(m, 2H), 5.26(s, 1H), 6.62(d,J=8.7 Hz, 2H), 6.74(d,J=9.0 Hz, 2H), 7.16~7.19(m, 1H), 7.22~7.27(m, 2H), 7.94(s, 1H), 8.34(br, 1H); HR-MSm/z: Calcd for (C20H22N2O3+H)+339.170 9, found 339.170 5; HPLC: tmajor=20.15 min, tminor=22.77 min。
其余化合物的产率和ee值见表4,表征数据[17]与Scheme 1结构相符。
2 结果与讨论
2.1 催化剂的催化活性比较
以2a与3反应合成4a为模型[1 20 mol%,其余反应同1.2(2),下同],考察1a~1i对4a产率和对映选择性的影响,结果见表1。从表1可看出,1结构中的电子效应对反应有明显的影响,当1的芳环上连有供电基(1b,1c)时,其催化活性较连有吸电子基(1h,1i)的高,这可能是由于苯环上的电子密度增大,导致该类催化剂的催化活性提高。从表1还可看出,1a的催化活性最高,这与文献[9]报道的1d是催化该反应最好的催化剂有很大的差异。
2.2 付克(F-C)反应条件优化
(1) 反应溶剂和反应温度
以1a为催化剂,其余反应条件同2.1,考察溶剂和温度对付克反应的影响,结果见表2。由表2可见,溶剂和温度对反应有很大的影响。在相同的温度(0 ℃)下,以甲苯、氯仿、乙醚、四氢呋喃等为溶剂时,收率和ee值均比DCM低得多。溶剂相同,温度越低,虽产率没有明显变化,但对映选择性却达到87%。
(2) 催化剂用量
以1a为催化剂,其余反应条件同2.1,考察催化剂用量对付克反应的影响。结果见表3,从表3可见,催化剂用量对对映选择性影响不大,但对收率有较大影响。当1a用量从10 mol%升到20 mol%时,4a的对映选择性从80%升到87%,而产率却从67%提高到96%;用量增至25 mol%时,产率变化不大,但对映选择性却下降。1a的最佳用量为20 mol%。

表1 手性磷酸的催化活性*Table 1 Catalytic activity of chiral phosphoric acids
*时间30 min, 1 20 mol%,其余反应条件同1.2(2);分离收率;ee值由HPLC测定

表2 反应溶剂和反应温度对付克反应的影响*Table 2 Effect of reaction solvents and reaction temperature on F-C reaction
*1a20 mol%,其余同表1

表3 催化剂用量对付克反应的影响*Table 3 Effect of catalyst amount on F-C reaction
*DCM为溶剂,其余同表2

表4 4的实验结果*Table 4 Experimental results of 4
*1a20 mol%, DCM为溶剂,其余反应条件同1.2(2)
综上所述,付克烷基反应的最佳反应条件为:1a为催化剂,用量为20 mol%, DCM为溶剂,于-78 ℃反应30 min。
2.3 扩展实验
在最佳实验条件下考察了2a~2i与3的傅克烷基化反应,结果见表4。从表4可以看出,取代基电子效应对反应的影响较大。当R为供电子取代基(2d,2e)时,对应产物的收率和对应选择性较低;当R为吸电子取代基(2f,2g)时,对应产物的ee值有所提高,获得中等的ee值;当R为强吸电子取代基(3h,3i)时,反应几乎不发生。
3 结论
以手性磷酸1a(20 mol%)为催化剂,DCM为溶剂,于-78 ℃反应30 min,成功地催化吲哚衍生物与乙醛酸酯亚胺的不对称傅克反应,合成了一系列(3-吲哚)甘氨酸衍生物,最高产率和ee值分别为96%和87%。
[1] Olah G A. In Friedel-Crafts and Related Reactions[M].Wiley,New York,1963.
[2] Olah G A. In Friedel Crafts Chemistry[M].Wiley,New York,1973.
[3] Wang Y Q, Song J, Hong R,etal. Asymmetric Friedel-Crafts reaction of indoles with imines by an organic catalyst[J].J Am Chem Soc,2006,128:8156-8157.
[4] Kang Q, Zhao Z A, You S L. Highly enantioselective Friedel-Crafts reaction of indoles with imines by a chiral phosphoric acid[J].J Am Chem Soc,2007,129:1484-1485.
[5] Rowland G B, Rowland E B, Liang Y X,etal. The highly enantioselective addition of indoles toN-acyl imines with use of a chiral phosphoric acid catalyst[J].Org Lett,2007,9:2609-2611.
[6] Terada M, Yokoyama S, Sorimachi K,etal. Chiral phosphoric acid-catalyzed enantioselective aza-Friedel-Crafts reaction of indoles[J].Adv Synth Catal,2007,349:863-1867.
[7] Li G, Rowland G B, Rowland E B,etal. Organocatalytic enantioselective Friedel-Crafts reaction of pyrrole derivatives with imines[J].Org Lett,2007,9:4065-4068.
[8] Taylor M S, Jacobsen E N. Highly enantioselective catalytic acyl-Pictet-Spengler reactions[J].J Am Chem Soc,2004,126:10558-10559.
[9] Kang Q, Zhao Z A, You S L. Enantioselective synthesis of (3-indolyl)glycine derivatives via symmetric Friedel-Crafts reaction between indoles and glyoxylate imines[J].Tetrahedron,2009,65:1603-1607.
[10] Kawasaki T, Ohno K, Enoki H,etal. Syntheses of bis(indolyl)piperazine alkaloids, dragmacidin B and C,and dihydrohamacanthin A[J].Tetrahedron Lett,2002,43:4245-4248.
[11] Kawasaki T, Enoki H, Matsumura K,etal. First total synthesis of dragmacidin a via indolylglycines[J].Org Lett,2000,2:027-3029.
[12] Yang C G, Wang J, Tang X X,etal. Asymmetric aminohydroxylation of vinyl indoles: a short enantioselective synthesis of the bisindole alkaloids dihydro-hamacanthin A and dragmacidin A [J].Tetrahedron:Asymmetry,2002,13:383-394.
[13] Katz A H, Demerson C A, Shaw C C,etal. Synthesis and analgesic activity of pemedolac(cis-1-ethyl-1,3,4,9-tetrahydro-4-(phenylmethyl)pyrano[3,4]indole-1-ace atic acid)[J].J Med Chem,1988,31:1244-1250.
[14] 盛益飞,张安将,郑晓健,等. 有机催化的不对称傅克烷基化反应[J].有机化学,2008,28:605-616.
[15] Akiyama T, Morita H, Itoh J,etal. Chiral brønsted acid catalyzed enantioselective hydrophosphonylation of imines:Asymmetric synthesis ofα-amino phosphonates[J].Org Lett,2005,7(13):2583-2585.
[16] Storer R I, Carrera D E, Ni Y,etal. Enantioselective organocatalytic reductive amination[J].J Am Chem Soc,2006,12:84-86.
[17]4c:1H NMRδ: 1.20(t,J=6.9 Hz, 3H), 3.72(s, 3H), 3.87(s, 3H), 4.11~4.29(m, 2H), 5.29(s, 1H), 6.61(d,J=8.9 Hz, 2H), 6.75(d,J=9.0 Hz, 2H), 6.87~6.90(m, 1H), 7.21~7.28(m, 3H), 8.04(br, 1H); HPLC: tmajor=42.64 min, tminor=49.51 min.4d:1H NMRδ: 1.19(t,J=7.1 Hz, 3H), 2.47(s, 3H), 3.73(s, 3H), 4.11~4.25(m, 2H), 5.30(s, 1H), 6.62(d,J=8.9 Hz, 2H), 6.75(d,J=8.9 Hz, 2H), 7.04~7.07(m, 1H), 7.20~7.28(m, 2H), 7.60(s, 1H), 8.01(br, 1H); HPLC: tmajor=23.55 min, tminor=32.68 min.4f:1H NMRδ: 1.20(t,J=6.9 Hz, 3H), 2.47(s, 3H), 3.73(s, 3H), 4.11~4.17(m, 2H), 5.30(s, 1H), 6.62(d,J=8.9 Hz, 2H), 6.75(d,J= 8.9 Hz, 2H), 7.05~7.20(m, 1H), 7.26~7.30(m, 2H), 7.50(s, 1H); HPLC: tmajor=17.39 min, tminor=20.04 min.4g:1H NMRδ: 1.20(t,J=7.5 Hz, 3H), 3.72(s, 3H), 4.10~4.28(m, 3H), 5.27(s, 1H), 6.61(d,J=8.9 Hz, 2H), 6.74(d,J=8.9 Hz, 2H), 7.10~7.14(m, 2H), 7.24~7.27(m, 1H), 7.69(s, 1H), 8.10(br, 1H); HPLC: tmajor=19.34 min, tminor=24.55 min.4h:1H NMRδ: 1.21(t,J=6.9 Hz, 3H), 3.71(s, 3H), 4.13~4.28(m, 2H), 5.36(s, 1H), 6.60(d,J=9.0 Hz, 2H), 6.74(d,J=8.9 Hz, 2H), 7.40~7.43(m, 2H), 8.13~8.17(m, 1H), 8.50(s, 1H); HPLC: tmajor=27.29 min, tminor=37.59 min.
