新型4-芳氧基吡啶并[3′,2′∶4,5]噻吩并[3,2-d]嘧啶衍生物的合成*
2010-11-26张广龙欧阳贵平李文举包文艳
张广龙, 欧阳贵平, 李文举, 包文艳
(贵州大学 精细化工研究开发中心 教育部绿色农药与农业生物工程重点实验室,贵州 贵阳 550025)
吡啶并[3′,2′∶4,5]噻吩并[3,2-d]嘧啶作为喹唑啉类似物逐渐受到科研人员的广泛关注。该稠杂环体系同时含有吡啶、噻吩、嘧啶三类重要的活性结构单元,部分化合物对表皮生长因子受体络氨酸激酶抑制剂[1]、代谢型谷氨酸酶抗洁剂[2]、磷酸二酯酶4抑制剂[3]、抗过敏[4]、杀菌[5]、消炎[6]等具有较好的生物活性。其衍生物拥有平面大分子和多变性的结构,而且碱性吡啶环片段在生物体内易于和体内生物碱、氨基酸类等物质结合对新药的开发具有很大研究价值[7]。
4-位芳胺取代吡啶并噻吩并嘧啶化合物已经得到深入研究[8,9],但由于此类化合物具有较差的溶解性、较高的熔点以及极为苛刻的反应条件使其应用受到限制[10]。



CompabcdefArOHCMeO-MeOOHC-OHC-OMe-MeO--CompghijklAr--O2N-Cl-ClCl-CN-
Scheme1
本文在前人的研究基础上对先导化合物合成方法进行了改进,探索出了一条新型4-芳氧基吡啶并[3′,2′∶4,5]噻吩并[3,2-d]嘧啶(4)的合成路线。2-氯-3-氰基吡啶与巯基乙酸乙酯经闭环反应制得3-氨基吡啶并[3′,2′∶4,5]噻吩-2-甲酸乙酯(1);1与甲酰胺第二次成环生成吡啶并[3′,2′∶4,5]噻吩并[3,2-d]嘧啶-4-酮(2);2经氯化后与取代苯酚反应合成了12个新型的4-取代芳氧基吡啶并[3′,2′∶4,5]噻吩并[3,2-d]嘧啶(4a~4l, Scheme 1),其结构经1H NMR,13C NMR, IR和元素分析表征。
1 实验部分
1.1 仪器与试剂
X-5型数字显微熔点仪(温度计未校正) ;美国JEOL公司 ECX-500 MHz型超导核磁共振仪(CDCl3为溶剂,TMS为内标);日本岛津公司 Prestige-21型红外光谱仪(KBr压片); 德国Elememtar公司Vario-Ⅲ型元素分析仪。
所用试剂和溶剂均为市售分析纯或化学纯。
1.2 合成
(1)1的合成[11]
氮气保护,在三颈烧瓶中加入DMSO 80 mL,搅拌下于25 ℃~30 ℃分3次加入氢化钠NaH(2.0 g, 83 mmol);搅拌10 min后分2次加入氢化钠NaH(0.5 g, 20.8 mmol)。回流反应至无气泡生成,滴加巯基乙酸乙酯10 mL(91 mmol),滴毕,回流反应30 min。快速滴加2-氯-3-氰基吡啶8 g(58 mmol)的DMSO(80 mL)溶液(当滴液与反应液接触面出现血红色时减慢滴加速度,并加大搅拌力度),滴毕,反应3 h~4 h(TLC跟踪)。趁热倒入500 mL冰水中,静置过夜。抽滤,滤饼用冰水(3×200 mL)洗涤,干燥得淡黄色固体1,收率90.1%, m.p.182 ℃~183 ℃。
(2) 2的合成[12]
在单颈瓶中加入1 2.0 g(9.0 mmol)和99.5%甲酰胺50 mL,搅拌下于135 ℃反应1 h;于170 ℃反应约5 h(TLC跟踪)。冷却至室温,抽滤,滤饼用乙酸乙酯(10 mL)和冰水(3×10 mL)洗涤,无水乙醇重结晶得白色针状晶体2,收率87.6%, m.p.341 ℃~343 ℃。
(3) 4-氯吡啶并[3′,2′∶4,5]噻吩并[3,2-d]嘧啶(3)的合成[1]
在三口瓶中加入1,2-二氯乙烷100 mL,搅拌下于室温滴加草酰氯5 mL(59 mmol),滴毕,反应10 min后滴加DMF 3 mL,搅拌至白色泡沫消失得韦氏试剂。加入2 0.61 g(3 mmol),回流(83 ℃)反应3 h(TLC跟踪)。冷却至室温,用氯仿(3×33 mL)萃取,合并有机相,分别用水(3×33 mL),饱和食盐水(2×50 mL)洗涤,无水硫酸镁干燥,脱溶,自然风干得淡黄色固体3,收率90.6%,m.p.217 ℃~218 ℃。
(4)4a~4l的合成通法
在三口瓶中依次加入取代苯酚0.92 mmol,缚酸剂K2CO31 g和乙腈30 mL,搅拌下于室温反应约10 min后加入3 0.2 g(0.90 mmol),升温至82 ℃(回流)反应5 h~8 h(TLC跟踪)。趁热倒入200 mL冰水中,静置过夜;抽滤,滤饼用饱和K2CO3溶液或30%NaOH(2×20 mL)洗涤,经甲醇重结晶或硅胶柱层析(洗脱剂:乙酸乙酯)分离得白色晶体4a~4l。
2 结果与讨论
4的实验结果见表1,光谱数据见表2和表3。

表1 4的实验结果Table 1 Experimental results of 4

表2 4的1H NMR数据Table 2 1H NMR data of 4
续表2

Comp1H NMR δ4f8.94(dd, J=6.3 Hz, 1H, 7-H), 8.89(s, 1H, 2-H), 8.79(dd, J=9.7 Hz, 1H, 9-H), 7.73^7.76(m, 1H, 8-H), 7.38^7.41(dd, J=8.1 Hz, 1H, PhH), 7.20(dd, 1H, PhH),7.19(dd, J=7.5 Hz, 1H, PhH), 7.17(s, 1H, PhH), 2.37(s, 3H, CH3)4g8.87(dd, J=6.3 Hz, 1H, 7-H), 8.86(s, 1H, 2-H), 8.73^8.75(dd, J=9.7 Hz, 1H, 9-H), 7.73^7.76(m, 1H, 8-H), 7.28^7.30(dd, J=8.6 Hz, 2H, PhH), 7.17^7.18(dd, J=8.6 Hz, 2H, PhH), 2.41(s, 3H, CH3)4h8.88(dd, J=6.3 Hz, 1H, 7-H), 8.83(s, 1H, 2-H), 8.74^8.76(dd, J=9.7 Hz, 1H, 9-H), 7.73^7.76(m, 1H, 8-H), 7.17(s, 3H, PhH), 2.17(s, 6H, CH3)4i8.98(dd, J=6.3 Hz, 1H, 7-H), 8.94(s, 1H, 2-H), 8.86(dd, J=9.7 Hz, 1H, 9-H), 7.76^7.79(m, 1H, 8-H), 8.37(s, 1H, PhH), 8.23^8.25(dd, J=10.4 Hz, 1H, PhH), 7.93^7.95(dd, J=10.9 Hz, 1H, PhH), 7.82^7.85(t, J=8.0 Hz, 1H, PhH)4j8.98(dd, J=6.3 Hz, 1H, 7-H), 8.93(s, 1H, 2-H), 8.83^8.85(dd, J=9.7 Hz, 1H, 9-H), 7.77^7.79(m, 1H, 8-H), 7.70(dd, J=8.0 Hz, 1H, PhH), 7.62(dd, J=8.0 Hz, 1H, PhH), 7.51^7.54(t, J=8.1 Hz, 1H, PhH), 7.42^7.45(t, J=7.5 Hz, 1H, PhH)4k8.98(dd, J=6.3 Hz, 1H, 7-H), 8.94(s, 1H, 2-H), 8.84^8.86(dd, J=9.7 Hz, 1H, 9-H), 7.77^7.79(m, 1H, 8-H), 7.90(s, 1H, PhH), 7.66^7.68(dd, J=9.2 Hz, 1H, PhH), 7.60^7.63(dd, J=10.9 Hz, 1H, PhH)4l8.99(dd, J=6.3 Hz, 1H, 7-H), 8.97(s, 1H, 2-H), 8.85^8.87(dd, J=9.7 Hz, 1H, 9-H), 7.78^7.80(m, 1H, 8-H), 8.07(dd, J=7.5 Hz, 1H, PhH), 7.91(m, 1H, PhH), 7.76(dd, J=8.6 Hz, 1H, PhH), 7.59^7.61(m, 1H, PhH)
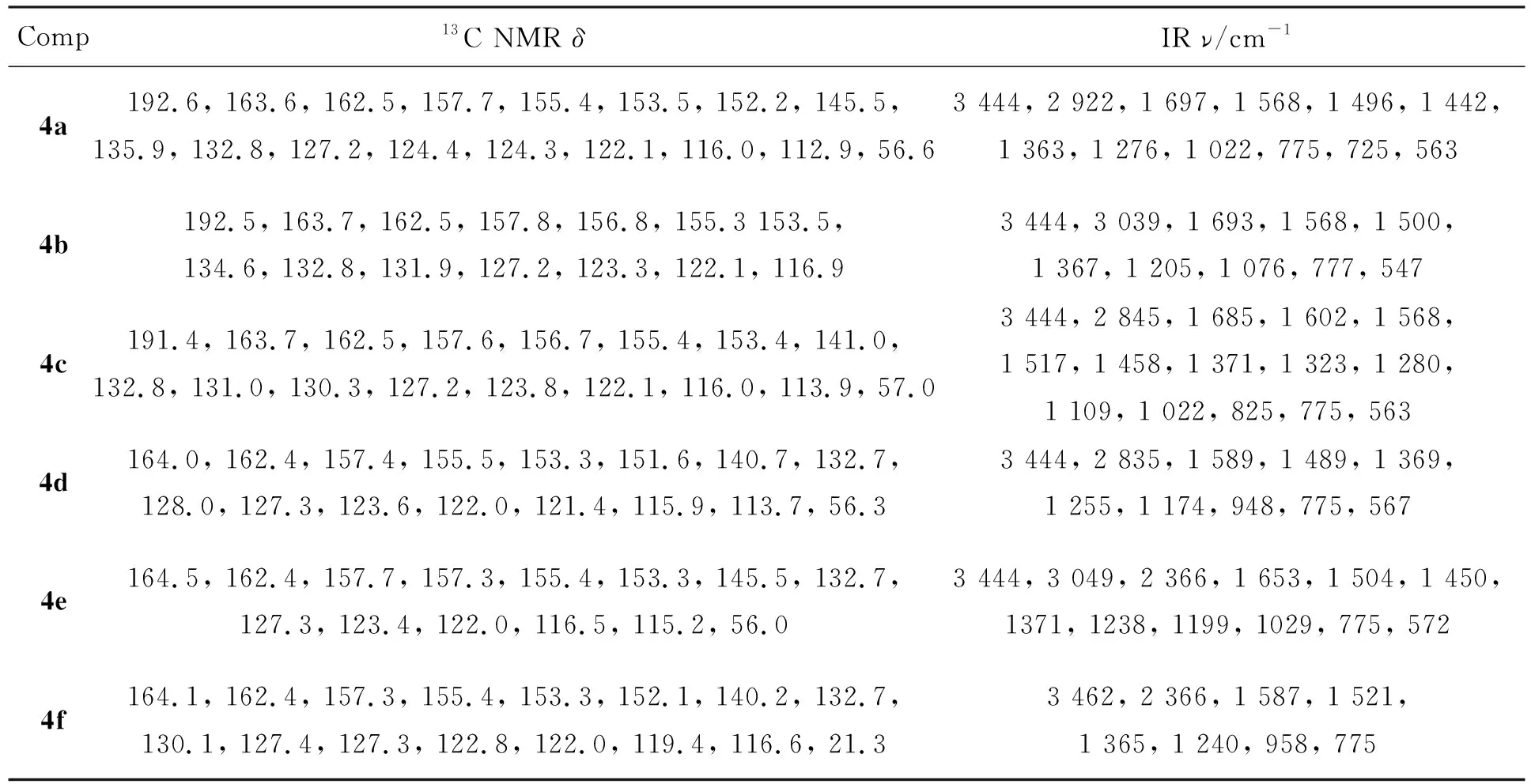
表3 4的13C NMR和IR数据Table 3 13C NMR and IR data of 4
续表3

Comp13C NMR δIR ν/cm-14g164.5, 163.3, 157.2, 154.9, 152.2, 149.7, 136.1, 132.0, 130.4, 127.6, 121.5, 120.6, 117.6, 21.13 444, 3 041, 2 920, 1 587, 1 564, 1 502, 1 446, 1 373, 1 327, 1 273, 1 249, 1 201, 1 064, 954, 817, 773, 4954h163.4, 163.3, 157.3, 155.2, 152.2, 149.3, 132.0, 130.8, 128.9, 127.7, 126.0, 120.6, 16.53 444, 2 974, 2 922, 1 751, 1 724, 1 587, 1 566, 1 519, 1 446, 1 369, 1 325, 1 172, 1 089, 948, 7754i163.8, 162.5, 157.7, 155.2, 153.5 152.4, 149.0, 132.8, 131.7, 129.7, 127.2, 122.1, 121.7, 118.2, 116.83 444, 3 070, 2 918, 1 585, 1 529, 1 514, 1 446, 1 365, 1 350, 1 328, 1 247, 1 209, 1 074, 960, 813, 775, 495 4j163.3, 162.5, 157.8, 155.4, 153.5, 148.0, 132.9, 131.0, 129.3, 128.6, 127.2, 126.6, 125.1, 122.1, 116.13 462, 1 589, 1 517, 1 440, 1 363, 1 076, 769, 5304k163.1, 162.5,157.9, 155.3, 153.6, 147.1, 132.9, 132.0, 130.5, 129.4, 127.9, 127.2, 126.5, 122.2, 116.13 325, 1 585, 1 529, 1 207, 1 055, 773, 5634l163.3, 162.5,158.1, 155.3, 153.7 153.4, 135.9, 134.4, 132.9, 127.8, 127.1, 124.3, 122.2, 116.4, 115.6, 106.83 429, 2 231, 2 231, 1 591, 1 487, 1 373, 775

表4 反应温度和时间对2收率的影响*Table 4 Effect of reaction temperature and time onyield of 2
*反应条件同1.2(2)
2.1 1的合成
在1的合成中,以DMSO为溶剂时可防止反应温度低于19 ℃引起结晶。控制2-氯-3-氰基吡啶的DMSO溶液的滴加速度不能过快以及NaH的规格含量大于80%,少量分批加入等条件使收率大大提高。
2.2 2的合成
在2的成环反应中,反应温度和时间对反应有较大影响(表4)。若温度一直低于135 ℃反应72 h,TLC跟踪发现几乎无反应;温度高于190 ℃反应1 h,反应液变黑(大于190 ℃甲酰胺部分分解一氧化碳和氨气),反应72 h后冷凝管口附着大量白色溶于水的晶体{部分原料分解为3-氨基吡啶并[3′,2′ ∶4,5]噻吩-2-甲酸},反应液静置数天后才会有少量针状晶体析出,收率较低。严格控制起始温度135 ℃反应5 h后升温至170 ℃反应,TLC跟踪发现约5 h反应完全,收率能到达96%左右。
2.3 3的合成
合成3的传统方法是用三氯氧磷作为氯化试剂以吡啶作为溶剂回流4 h,趁热倒入冰水中用乙醇重结晶[13]。为了寻找更为高效的方法,本文比较了不同氯化试剂对反应的影响。结果发现用草酰氯和三乙胺或吡啶的混合溶剂可使3的收率达93%,反应时间很短(1 h),后处理也较简单,相对于其他的氯化试剂和氯化方法来说,有着显著的优势。
2.4 4的合成
4的合成采用取代苯酚稍过量以及与缚酸剂K2CO3先回流10 min后再加3的方法首次将各种取代芳氧基引入到吡啶并[3′,2′ ∶4,5]噻吩并[3,2-d]嘧啶中。
[1] Showalter H D H, Bridges A J, Zhou H R,etal. Tyrosine kinase inhibitors.16.6,5,6-tricyclic benzo thieno[3,2-d]pyrimidines and pyrimido[5,4-b]-and-[4,5-b]indoles as potent inhibitors of the epidermal growth factor receptor tyrosine kinase[J].J Med Chem,1999,42(26):5464-5474.
[2] Zheng G Z, Bhatia P, Daanen J,etal. Structure-activity relationship of triazafluorenone derivatives as potent and selective mGluR1 antagonists[J].J Med Chem,2005,48(23):7374-7388.
[3] Santacana L M P, Moll J T, Ferrer J G. Pyridothienopyrimidine derivatives[P].US 0 207 645A1,2008.
[4] Quintela J M, Peinador C, Veiga C,etal. Synthesis and antiallergic activity of pyridothienopyrimidines[J].Bioorg Med Chem,1998,6:1911-1925.
[5] Abdel-Rahman A E, Bakhite E A, Al-Taifi E A. Synthesis and antimicrobial activity of new pyridothienopyrimidines and pyridothienotriazines[J].J Chin Chem Soc,2002,49(2):223-231.
[6] Riyadh S M, Abdallah M A, Abbas I M,etal. A aacile one-pot synthesis of pyrido[3′,2′ ∶4,5]thieno[3,2-d][1,2,4] triazolo[5,4-a] pyrimidin-5-one[J].Int J Pure Appl Chem,2006,1(1):57-64.
[7] Abdelhamid A O, Ismail Z H, Abde-Gawad S M,etal. Synthesis of some new thieno[2,3-b]pyridines,pyrimidino[4′,5′ ∶4,5]thieno[2,3-b]pyridines,and 2,3-dihydro-1,3,4-thiadiazoles[J].Phosphorus Sulfur Silicon Relat Elem,2009,184:58-75.
[8] Quintela J M, Peinador C, Gonzlez L,etal. PiperazineN-substituted naphthyridines,pyridothienopyrimidines and pyridothieno-triazines:New antiprotozoals active against philasterides dicentrarchi[J].Eur J Med Chem,2003,38:265-275.
[9] Gaber H M, Elgemeie G E H, Ouf S A,etal. Heterocyclic synthesis with 4-hydrazinopyridothienopyrimidines:Synthesis of pyridothienotriazolopyrimidines and heterocyclylpyridothienopyrimidines with biological Interest[J].Heteroat Chem,2005,16(4):298-307.
[10] Zhao C L, Tovar C, Yin X F,etal. Synthesis and evaluation of pyrido-thieno-pyrimidines as potent and selective Cdc7 kinase inhibitors[J].Bioorg Med Chem Lett,2009,19:319-323.
[11] Bridges A J, Denny W A, Fry D,etal. Tricyclic compounds capable of inhibiting tyrosine kinases of the epidermal growth factor receptor family[P].US 5 679 683,1997.
[12] Li M D, Zheng Y G, Ji M. Synthesis of gefitinib from methyl 3-hydroxy-4-methoxy benzoate[J].Mol,2007,12:673-678.
[13] Schneller S W, Clough F W. Synthesis of pyrido[3′,2′ ∶4,5]thieno[3,2-d]pyrimidone derivatives(1): Pyrido[3′,2′ ∶4,5]thieno[3,2-d]pyrimidone and several of its derivatives have been synthesized[J].J Heterocycl Chem,1974,11(6):975-977.
