4,7-非对称二取代苯并噻二唑的合成*
2010-11-26桑言奎单益凡赵丽华
桑言奎, 单益凡, 赵丽华, 汤 杰, 杨 帆
(华东师范大学 化学系,上海 200062)
2,1,3-苯并噻二唑衍生物作为重要的发色团被广泛应用于光电材料分子的设计与性质研究[1~4]。例如,以2,1,3-苯并噻二唑为重要单元的聚合物、富勒烯-2,1,3-苯并噻二唑[5,6]、噻吩-2,1,3-苯并噻二唑[7,8]、咔唑-2,1,3-苯并噻二唑[9]等显示了特有的电荷传输和电致发光性能。一些以2,1,3-苯并噻二唑为基本单元的系列小分子是潜在的红光发光材料[2,10]和双光子吸收材料[11,12]。
目前关于2,1,3-苯并噻二唑类衍生物的研究报道虽然较多,但大多集中在4,7-位对称结构的合成与性质研究,且合成方法也较单一(即通过4,7-位双溴化,再偶联得到相应的化合物)。Marappan Velusamy等[13]报道了4,7-位非对称的二取代苯并噻二唑D-π-A型染料分子具有很好的光电转换效率[13],但对于4,7-位非对称二取代苯并噻二唑衍生物的合成方法却报道较少。
本文以以邻甲苯胺为起始原料,经3步反应制得4-甲基-2,1,3-苯并噻二唑(1); 1经α-溴代水解制得4-羟甲基-2,1,3-苯并噻二唑(3); 3再经IBX(2-碘酰基苯甲酸)选择性氧化合成了4-甲酰基-2,1,3-苯并噻二唑(4)。1经环上溴代和α-溴代制得4-溴-7-溴甲基-2,1,3-苯并噻二唑(6); 6经水解和IBX选择性氧化制得4-甲酰基-7-溴-2,1,3-苯并噻二唑(8)。 8与给电子基团通过缩合或偶联反应合成了具有4,7-位非对称苯并噻二唑D-π-A型分子结构的新化合物4-甲酰基-7-N,N-二甲氨基-2,1,3-苯并噻二唑(9)和4-甲酰基-7-[4-(N,N-二甲氨基)]苯基-2,1,3-苯并噻二唑(10)(Scheme 1),其结构经NMR和HR-MS表征。该路线为合成系列4,7-位非对称官能化的二取代苯并噻二唑砌块提供了一条有效的途径。9和10的光电性质测试正在进行中。
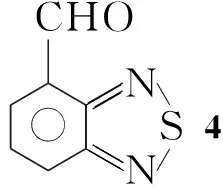


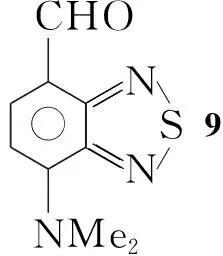

Scheme1
1 实验部分
1.1 仪器与试剂
Bruker-500型核磁共振仪(CDCl3为溶剂,TMS为内标); Bruker micrOTOF Ⅱ型高分辨飞行时间质谱仪。
所用试剂为分析纯,使用前经纯化或干燥处理。
1.2 合成
(1) 1的合成
在三颈瓶中加入乙酸酐65 mL,搅拌下于室温滴加邻甲苯胺10.7 mL(<40 ℃),滴毕,反应30 min。冷却至10 ℃~12 ℃得粉红色浆状物,缓慢滴加65%浓硝酸12.6 mL,滴毕,反应1 h。倒入冰水(300 mL)中,抽滤,滤饼用冰水(3×100 mL)洗涤后转移至烧瓶中,加入浓盐酸30 mL,回流反应2 h。冷却至室温,搅拌下加入H2O(150 mL),析出橙黄色沉淀,搅拌30 min;抽滤,滤饼用水(3×7 mL)洗涤,干燥得粗品;用乙醇重结晶得橙黄色针状晶体2-甲基-6-硝基苯胺(Ⅰ)7.3 g, m.p.94 ℃~96 ℃,与文献值一致。
将Ⅰ 1.52 g(10 mmol)溶于EtOH(40 mL)中,搅拌下加入10%Pd/C 0.30 g,通入氢气,于室温反应2 h。用硅藻土过滤,滤饼用EtOH洗涤,合并滤液和洗液,浓缩得3-甲基-1,2-苯二胺(Ⅱ),收率98%。
将Ⅱ 3.7 g(30 mmol)溶于二氯甲烷(60 mL)中,搅拌下加入三乙胺16 mL,滴加二氯亚砜7 mL,滴毕,回流反应6 h。冷却至室温,滴加水30 mL,用1 mol·L-1NaOH溶液中和后用二氯甲烷(3×30 mL)萃取,合并萃取液,用饱和食盐水洗涤,无水Na2SO4干燥,浓缩,残余物经硅胶柱层析[洗脱剂:A=V(石油醚) ∶V(乙酸乙酯)=20 ∶1]纯化得淡黄色油状物1 3.1 g,收率69%。
(2)3的合成
在反应瓶中加入1 1.05 g(7 mmol), BPO(过氧化苯甲酰)60 mg和CCl415 mL,搅拌使其溶解;于50 ℃加入NBS(N-溴代丁二酰亚胺)1.25 g(7 mmol),回流反应30 min。冷却,抽滤,滤饼用CCl4洗涤,合并滤液和洗液,浓缩得淡黄色针状固体4-溴甲基-2,1,3-苯并噻二唑(2)1.7 g。
2用二氧六环(20 mL)和饱和Na2CO3溶液(40 mL)溶解后回流反应30 min。冷却,分层,水层用乙酸乙酯萃取,合并有机层,用饱和食盐水(2×10 mL)洗涤,无水Na2SO4干燥,浓缩,残余物经硅胶柱层析(洗脱剂:A=20 ∶1)纯化得米黄色固体31.0 g,收率86%;1H NMRδ: 2.75(t,J=8.0 Hz, 1H, OH), 5.17(d,J=8.0 Hz, 2H, CH2), 7.56~7.61(m, 2H, ArH), 7.93(d,J=8.0 Hz, 1H, ArH)。
(3)4的合成
在反应瓶中加入30.27 g(1.5 mmol)和DMSO 10 mL,搅拌使其溶解;加入IBX 0.84 g(3 mmol),于40 ℃~50 ℃反应2 h。冷却,加水30 mL,析出白色固体,抽滤,滤饼用乙酸乙酯淋洗;合并滤液与洗液,分层,水层用乙酸乙酯萃取,合并有机层,分别用饱和NaHCO3溶液和饱和食盐水(2×15 mL)洗涤,无水Na2SO4干燥,浓缩得浅黄色固体40.22 g,收率89%;1H NMRδ: 7.80(m, 1H, ArH), 8.22(d,J=8.0 Hz, 1H, ArH), 8.31(d,J=8.0 Hz, 1H, ArH), 10.87(s, 1H, CHO)。
(4) 4-甲基-7-溴-2,1,3-苯并噻二唑(5)的合成
在反应瓶中加入11.5 g(10 mmol)和氢溴酸10 mL,搅拌使其溶解;加入Br20.6 mL(12 mmol),回流反应12 h。冷却,倒入40 mL冰水中,用二氯甲烷(3×10 mL)萃取,合并有机相,分别用饱和亚硫酸氢钠溶液饱和食盐水洗涤,无水Na2SO4干燥,浓缩,残余物经硅胶柱层析(洗脱剂:A=10 ∶1)分离得浅黄色固体5 1.9 g,收率83%。
(5)6的合成
用合成2[1.2(2)]的方法由5制得淡黄色针状固体6 1.5 g;1H NMRδ: 4.94(s, 2H, CH2), 7.54(d,J=4.0 Hz, 1H, ArH), 7.82(d,J=4.0 Hz, 1H, ArH)。
(6) 4-甲酰基-7-溴-2,1,3-苯并噻二唑(8)的合成
用合成3[1.2(2)]的方法由6制得4-溴7-羟甲基-2,1,3-苯并噻二唑(7)。用合成4[1.2(3)]的方法由7制得白色固体80.38 g,总收率82%(以6计算)。
(7) 9的合成
在反应瓶中加入8 0.37 g(1.5 mmol)和二甲胺水溶液15 mL,搅拌下回流反应2 h。抽滤,滤饼用水洗涤后用二氯甲烷(10 mL)溶解,用饱和食盐水洗涤,干燥,浓缩得红色固体9 0.21 g,收率68%;1H NMRδ: 3.60(s, 6H, NCH3), 6.46(d,J=8.0 Hz, 1H, ArH), 8.04(d,J=8.0 Hz, 1H, ArH), 10.31(s, 1H, CHO); HR-MS(ESI)m/z: Calcd for C9H10N3OS 208.054 0, found 208.054 5{[M+1]+}。
(8) 10的合成
在单颈瓶中依次加入4-(N,N-二甲氨基)苯硼酸0.25 g(1.5 mmol), 8 0.37 g(1.5 mmol), K3PO4·3H3O 1.2 g(4.5 mmol), 1×10-4mmol·mL-1CPC(N,N-二甲基-3-氯苄胺环钯)1.5 mL,二氧六环12 mL和水7 mL, N2保护,搅拌下于120 ℃反应6 h。冷却、浓缩,加水(50 mL)和乙酸乙酯 (40 mL),分层,水层用乙酸乙酯(2×30 mL)萃取,合并有机相,用无水Na2SO4干燥,减压浓缩,残余物经硅胶柱层析(洗脱剂:A=5 ∶1)分离得红色固体10 0.38 g,收率90%;1H NMRδ: 3.09(s, 6H, NCH3), 6.87(d,J=8.0 Hz, 2H, ArH), 7.81(d,J=8.0 Hz, 1H, ArH), 8.03(d,J=8.0 Hz, 2H, ArH), 8.25(d,J=8.0 Hz, 1H, ArH), 10.71(s, 1H, CHO);13C NMRδ: 188.9, 162.6, 151.3, 143.0, 133.5, 130.8, 124.8, 124.4, 123.8, 112.0, 100.5, 40.2; HR-MS(ESI)m/z: Calcd for C15H14N3OS 284.085 8, found 284.085 2{[M+1]+}。
2 结果与讨论
在由Ⅱ环合合成1的过程中,通常采用吡啶作碱,由于吡啶在后处理时难以彻底除去,并且气味较大,所以本文尝试用三乙胺代替吡啶,结果发现,产物易于处理,收率也较好。
在2水解合成3时,用饱和碳酸钠溶液替代文献[14]方法中的高氯酸银水溶液进行水解,不仅试剂价格低廉、方便易得,而且产率也较高,溴代和水解两步总收率达86%(63%[14])。
3和7可经选择性氧化制备4和8。IBX作为一种温和、高选择性和环境友好的氧化剂,可高效地将伯醇氧化为醛。经实验探索,在IBX/DMSO体系中,本文分别以89%和82%的收率得到了4和8。
在10的合成中,本实验室采用新型催化剂CPC高效催化8与4-(N,N-二甲氨基)苯硼酸的Suzuki偶联,以90%的收率得到了偶联产物10。
[1] Neto B A D, Lopes A S, Ebeling G,etal. Photophysical and electrochemical properties ofπ-extended molecular 2,1,3-benzothiadiazoles[J].Tetrahedron,2005,61:10975-10982.
[2] Justin K R, Lin J T, Velusamy M,etal. Color tuning in benzo[1,2,5]thiadiazole-based small molecules by amino conjugation/deconjugation:Bright red-light-emitting diodes[J].Adv Funct Mater,2004,14:83-90.
[3] Zhang X, Gorohmaru H, Kadowaki M,etal. Benzo-2,1,3-thiadiazole-based,highly dichroic fluorescent dyes for fluorescent host-guest liquid crystal displays[J].J Mater Chem,2004,14:1901-1904.
[4] Kraft A, Grimsdale A C, Holmes A B. Electroluminescent conjugated polymers-seeing polymers in a new light[J].Angew Chem Int Ed Engl,1998,37:402-428.
[5] Herguth P, Jiang X, Liu M S,etal. Highly efficient fluorene- and benzothiadiazole-based conjugated copolymers for polymer light-emitting diodes[J].Macromolecules,2002,35:6094-6100
[6] Hou Q, Xu Y, Yang W,etal. Novel red-emitting fluorene-based copolymers[J].J Mater Chem,2002,12:2887-2892.
[7] Jayakannan M, Van Hal P A, Janssen R A J. Synthesis and structure-property relationship of new donor-acceptor-type conjugated monomers and polymers on the basis of thiophene and benzothiadiazole[J].J Polym Sci:Part A:Polym Chem,2002,40:251-261.
[8] Karikomi M, Kitamura C, Tanaka S,etal. New narrow-bandgap polymer composed of benzobis(1,2,5-thiadiazole) and thiophenes[J].J Am Chem Soc,1995,117:6791-6792.
[9 Huang J, Niu Y, Yang W,etal. Novel electroluminescent polymers derived from carbazole and benzothiadiazole[J].Macromolecules,2002,35:6080-6082.
[10] Yang Z D, Feng J K, Ren A M. Theoretical study of one-photon and two-photon absorptionproperties for 2,1,3-benzothiadiazole-based red-fluorescent dyes[J].Journal of Molecular Structure:Theochem,2008,848:24-33.
[11] Sonar P, Singh S P, Sudhakar S,etal. High-mobility organic thin film transistors based on benzothiadiazole-sandwiched dihexylquaterthiophenes[J].Chem Mater,2008,20:3184-3190.
[12] Zhou Y, He Q, Yang Y,etal. Binaphthyl-containing green- and red-emitting molecules for solution-processable organic light-emitting diodes[J].Adv Funct Mater,2008,18:3299-3306.
[13] Marappan V, Justin T K R, Lin J T,etal. Organic dyes incorporating low-band-gap chromophores for dye-sensitized solar cells[J].Org Lett,2005,7(10):1899-1902.
[14] Chan M K, Kwok W H, Zhang H,etal. Cyclic bis-benzimidazole ligands and metal complexes thereof[P].US 6 376 664,2002.
