曙红Y在牛血清白蛋白表面上的Langmuir吸附反应研究
2010-11-26彭毛祁红林吴辉盛立娇周建刚宋功武
彭毛,祁红林,吴辉,盛立娇,周建刚,宋功武
(湖北大学 化学化工学院,湖北 武汉 430062)
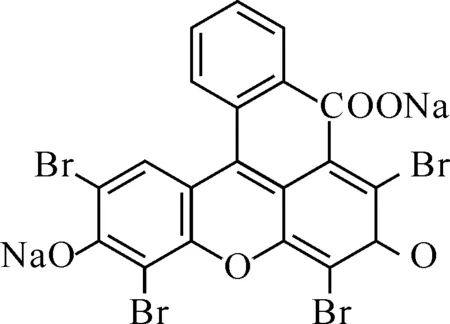
Scheme 1 EY的分子结构式
曙红Y(Eosin Y,EY)是一种阴离子型光谱探针,主要以静电作用力与蛋白质结合[1],已被广泛应用于蛋白质[2]、壳聚糖[3]、药物[4-5]及表面活性剂[6]的检测,以及与生物大分子作用的机理研究[7]等.生物大分子拥有复杂的立体构象,折叠、螺旋、盘绕等使大分子产生大量的沟壑和空穴,同性电荷相互靠近形成很多微电场谷[8].由于电场的作用,带有电荷的小分子探针被吸附到微相电场表面.EY分子在溶液中带有负电荷,与带正电荷物质存在静电作用.本文中研究了EY与牛血清白蛋白(BSA)的结合作用,计算出了结合比,结合常数等,并进行了试验条件讨论,测定了蛋白质的工作曲线.EY的分子结构式,如Scheme 1所示:
1 实验部分
1.1仪器与试剂UV 2300分光光度计(上海天美科学仪器有限公司);WH-3微型漩涡混合仪(上海沪西分析仪器厂有限公司);TB-85型恒温水浴槽(Shimadzu);准确称取一定量牛血清白蛋白(BSA)(武汉天源生物技术有限公司,66 000 g/mol),配制成2.12×10-5mol/L的水溶液,置于4 ℃下保存;曙红Y(EY)(上海试剂三厂),储备液浓度为1.01×10-3mol/L;试验用水均为二次去离子水,其他无机盐试剂未标明的均为分析纯.
1.2实验方法在25 mL 比色管中加入0.2 mL EY 溶液和一定量的BSA 溶液,稀释至12.5 mL 刻度处,漩涡混匀,放置6 min 后用1 cm 比色皿测其在534、511 nm 处的吸光度,根据公式(1~7)计算各个参数,并绘制Langmuir等温吸附曲线.
2 结果与讨论
2.1基本原理蛋白质分子由于复杂的立体构象形成微弱静电场[9],在其作用下,带电荷的小分子以单分子层形式被吸附到微相电场表面.由于生化反应平衡方程与吸附剂在溶液中对吸附质分子的蛋分子层吸附一致,故使用Langmuir 单分子层等温吸附理论解释蛋白质分子与小分子间相互作用是可行的[10].
Langmuir等温吸附方程为:
γ-1=N-1+(KNCL)-1
(1)
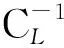
γ=η×CL0/CS
(2)
CL=(1-η)CL0
(3)
η=(AC-ΔA)/A0
(4)
AC=(ΔA-βΔA′)/(1-αβ)
(5)
η是L的有效反应率;CS是蛋白的初始浓度;CL0是染料的初始摩尔浓度.A0、ΔA分别是以水为参比试剂空白、以试剂空白为参比结合产物在结合产物最大吸收波长λ2下所测得的吸光度;AC是结合产物在λ2下经光谱修正后的实际吸光度;ΔA′是结合产物以试剂空白为参比在结合产物峰谷λ1下测得的吸光度;α、β为光谱校正常数,计算公式分别为:
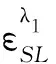
(6)
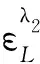
(7)
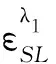
2.2吸收光谱分析EY溶液及其与BSA的反应溶液的吸收光谱图如图1所示.在400~600 nm 范围内,EY在514 nm 处有一最大吸收峰,当加入BSA 后,最大吸收峰红移至 527 nm 波长处,吸光度值降低.当以试剂空白为参比时,结合产物的吸收峰和谷吸收分别为 534 nm和511 nm,选此二波长为测定波长λ2、λ1.

图1 EY及EY-BSA结合产物的A值EY: 1.62×10-5 mol/L; BSA: 6.86×10-6 mol/L.
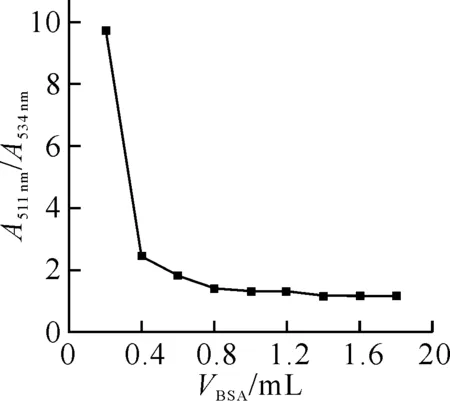
图2 吸光度比值随VBSA的变化曲线EY: 1.62×10-5 mol/L;BSA: 4.21×10-5 mol/L.
固定EY 的用量,向溶液中加入不同体积的BSA 溶液,以试剂空白为参比,计算其谷与峰处的吸光度比值,如图2所示.当BSA 加入量(VBSA)大于1.4 mL 时接近最小并基本保持恒定,这表明蛋白用量超过1.4 mL 时溶液中已没有游离的 EY,据此可以计算出α=0.634 4.以水为参比,由EY 溶液的吸收光谱中534 nm和511 nm 处的吸光度值,根据公式(7)计算出β=0.183 5.
2.3反应条件的研究
2.3.1 反应时间的影响 加入一定量的EY和BSA溶液后,在不同反应时间下测其吸收曲线,研究结合比γ随时间的变化.结果显示,EY与BSA的在室温下(26 ℃)反应速度较快,在6 min 后体系基本达到稳定且在半小时内都能保持不变,因此选择溶液放置 6 min 后进行测量.
2.3.2 离子强度的影响 加入不同量1.0 mol/L NaCl 溶液实验离子强度的影响,反应液的离子强度的变化对EY-BSA结合物的结合比的影响结果如图3所示.从图中可看出,EY-BSA结合物的结合比γ随离子强度的增加而降低.这是由于Na+、Cl-浓度高时,也能被蛋白质中的微电场所吸附,占据了部分微相表面,从而使EY 的吸附有所减少,结合比减小.
2.3.3 温度的影响 在25~52 ℃ 温度范围内研究了EY-BSA结合反应的吸收随温度变化的情况,结果如图4所示,可见,结合比随温度的升高而逐渐减小.这是由于温度升高加快了吸附在蛋白质分子上的EY解离,造成溶液中游离态的EY浓度升高,结合比下降.这些现象符合固体表面单分子层吸附的一般规律,支持了生物大分子内微静电场假设.
2.4结合常数的测定固定EY的用量,改变BSA(2.12×10-5mol/L)溶液的加入量.分别在30、45和60 ℃下,按实验方法测定反应液在吸收峰(534 nm)和谷(511 nm)处的吸光度值,分别计算AC、η、CL、γ值等,绘制1/γ-1/CL曲线,如图5所示.
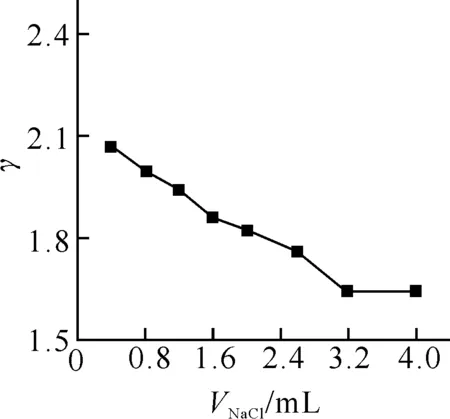
图3 离子强度对EY-BSA体系的影响BSA: 3.19×10-6 mol/L; EY: 8.08×10-6 mol/L.
图4 温度对EY-BSA结合比的影响BSA: 3.19×10-6 mol/L;EY: 8.08×10-6 mol/L.
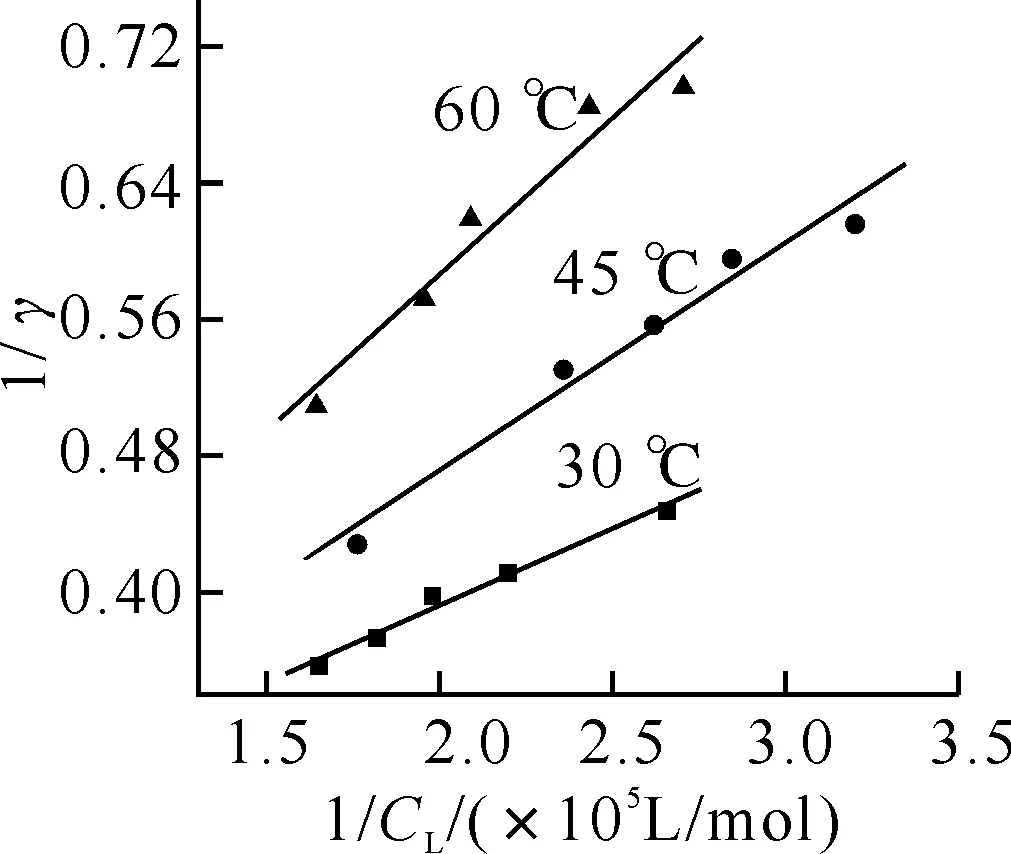
图5 EY-BSA体系的1/γ - 1/CL 关系曲线图BSA: 3.19×10-6 mol/L.
由图可见,各曲线均有较好的线性关系,因此曙红Y与BSA的结合符合Langmuir 单分子层吸附,即微相表面吸附.
根据直线的斜率和截距可分别求得各温度下结合物的结合常数及最大结合数,见表1.可见,温度的升高,EY的结合常数降低,这是由于温度的升高,吸附在蛋白质表面上的EY分子的解离加速,从而导致结合常数减小.

表1 EY-BSA体系在不同温度下的结合常数
2.5蛋白质溶液的工作曲线配制系列牛血清白蛋白标准溶液,按实验方法测量,计算AC值,测定蛋白质的工作曲线.结果表明,蛋白质在0~0.20 g/L浓度范围内吸收是线性的:AC=1.494 9C+ 0.010 18(R=0.997 6),该方法的检出限为 20 mg/L.
2.6金属离子的干扰在相对误差为±5%时,分别往一定量的结合反应体系中加入各种金属离子,对3.19×10-6mol/L BSA溶液测定它们的干扰情况,结果列入表2中.由结果可知,这些物质的干扰较小,不影响直接测定.
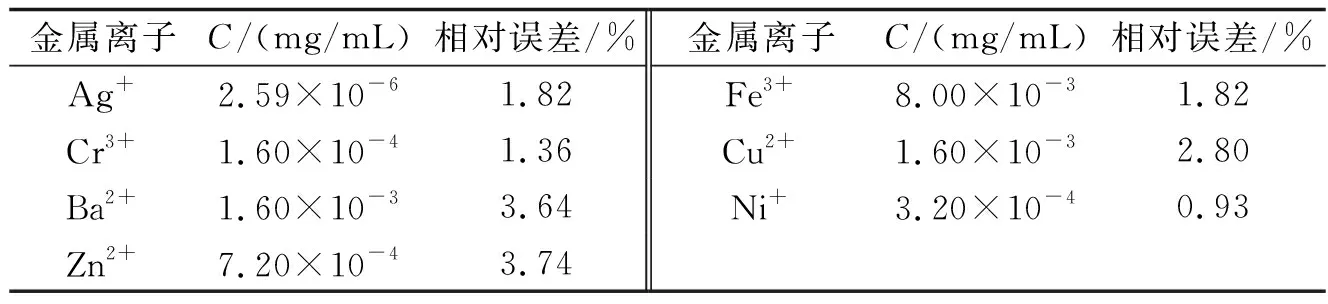
表2 金属离子干扰情况
3 结论
本试验探讨了曙红Y在蛋白质上的吸附聚集反应,由结果可知,温度的升高,加快了吸附在BSA上的EY分子的解离,造成溶液本体EY浓度升高,这一现象符合固体表面单分子层吸附的一般规律.通过Langmiur单分子层等温吸附理论研究,表明该过程符合Langmuir 等温吸附,同时也支持了生物大分子内微静电场假设.该方法原理简单易懂,操作方便,结果可靠,对研究环境污染物在生物大分子上的聚集机理与毒性作用等有重要意义.
参考文献:
[1] 杨昌英,刘义,朱军成,等.光谱法研究吲哚美辛舒林酸及其金属配合物与牛血清蛋白的相互作用[J].分析化学,2008,36(4):473-477.
[2] Waheed A A,Gupta P D.Estimation of submicrogram quantities of protein using the dye eosin Y[J].J Biochem Biophys Methods,2000,42(3):125-132.
[3] Du W L,Xu Z R,Han X Y,et al.Preparation,characterization and adsorption properties of chitosan nanoparticles for eosin Y as a model anionic dye[J].J Hazard Mater,2008,15(1-2):152-156.
[4] 赵小辉,牛卫芬.曙红Y共振光散射法测定双嘧达莫[J].应用化学,2008,25(6):693-696.
[5]El-Brashy A M,Metwally M E S,El-Sepai F A.Spectrophotometric determination of some fluoroquinolone antibacterials by binary complex formation with xanthene dyes[J].Il Farmaco,2004,5(10):809-817.
[6] Kovács-Hadady K,Fábián I.The determination of benzalkonium chloride in eye-drops by difference spectrophotometry[J].J Pharm Biomed Anal,1998,16(5):733-740.
[7] Gao D J,Tian Y,Liang F H,et al.Investigation on the pH-dependent binding of Eosin Y and bovine serum albumin by spectral methods[J].J Lumin,2007,127(2):515-522.
[8] Gao H W,Jiang J,Yu L Q.Study on spectrometric probe of protein solution with p-Iodochlorophosphonazo as adsorbate by MPASC technique[J].Analyst,2001,126(4):528-533.
[9] Gao H W,Xu W Q.Langmuir aggregation of Evans blue on cetyltrimethylammonium bromide and on proteins and its application Analytica[J].Chimica Acta,2002,458(2):417-424.
[10] 郜洪文,陈运生.探针体在蛋白质大分子上Langmuir吸附聚集及应用——蛋白质/荧光桃红B(PB)结合反应研究[J].高等学校化学学报,2002,23(5):825-827.
[11] Gao H W.Dual-wavelength spectrophotometric determinations of copper and its composition of the complex with eriochrome blue black R[J].Recl Trav Chim Pays-Bas,1995,114(2):61-64.
