胡芦巴籽中特征性香味成分分析
2010-11-24任晓锋朱文静马海乐
任晓锋,朱文静,马海乐,陈 钧
1江苏大学食品与生物工程学院;2江苏大学京江学院,镇江 212013
胡芦巴籽中特征性香味成分分析
任晓锋1*,朱文静2,马海乐1,陈 钧1
1江苏大学食品与生物工程学院;2江苏大学京江学院,镇江 212013
为建立胡芦巴籽中特征性香味成分胡芦巴内酯含量的分析方法,采用溶剂提取及 Oldershow柱浓缩胡芦巴籽中的胡芦巴内酯,气相色谱外标法定量分析胡芦巴内酯的含量,气相色谱-质谱法定性鉴定胡芦巴内酯的结构;并测定了安徽产的胡芦巴籽中的胡芦巴内酯的含量;结果标明采用气相色谱法分析胡芦巴内酯,高效、准确、重现性好、分析时间适中。
胡芦巴;胡芦巴内酯;气相色谱法;气相色谱-质谱法
胡芦巴 (Trigonella foenum-graecumL.),别名香草、香豆子、苦豆等,为豆科胡芦巴属一年生草本植物,全株具香气。广泛分布于亚洲、非洲和欧洲。胡芦巴籽的乙醇浸膏微甜有苦味,具有令人愉快的焦糖样烤香,常用于烟草加香工艺中,能抑制烟的辛辣刺激性,掩盖杂气,矫正吸味,增添烟香[1]。
对于胡芦巴籽中的特征性风味成分的研究,Girardon,P.等最先报道其特殊风味可能与胡芦巴内酯 3-Hydroxy-4,5-d imethyl-2(5H)-furanone(sotolone)有关[2],结构式见图 1。 Imre Blank等的研究也证实了这一结论,并发现它的香味阈值非常低,在0.02 ng/L空气、0.3μg/L水中,人的鼻子即可以感觉到,具有很强的调香潜力[3]。国内相关研究不多,董丽等用自制的新型固相微萃取(SPME)涂层。对胡芦巴浸膏的挥发性成分进行萃取,用气相色谱/质谱(GC/MS)联用技术进行分离分析,共鉴定出 29种成分[4],但是未鉴定出胡芦巴内酯,这可能在制备胡芦巴浸膏的过程中,浓缩时引起胡芦巴内酯成分丢失。目前未曾看到国内有关胡芦巴籽中胡芦巴内酯的提取及分析方法报道。本文首次从安徽产胡芦巴籽中提取胡芦巴内酯,气相色谱外标法定量分析了胡芦巴内酯的含量,并应用 GC/MS联用技术进行了鉴定,为其含量分析提供依据。
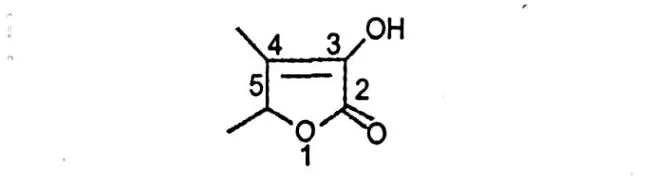
图 1 胡芦巴内酯的结构式Fig.1 Molecular structure of sotolone
1 材料与方法
1.1 材料、试剂与仪器
胡芦巴籽:购自镇江存仁堂药店,产地安徽,经生药学研究所欧阳臻教授鉴定为豆科胡芦巴属植物胡芦巴的成熟种子;胡芦巴内酯标准品:大连金菊香料有限公司产品,纯度大于 97;石油醚 (60~90℃):分析纯,使用前经 Oldershow柱精馏处理;无水乙醇、Na2CO3、Na2SO4、浓 HCl、NaCl等试剂均为分析纯。
Agilent 4890D气相色谱仪:美国安捷伦公司;铁碾槽;Oldershow精馏柱;6890N气相色谱-质谱联用仪(美国惠普公司);N2000色谱工作站 (浙江大学智能研究所)。
1.2 实验方法
1.2.1 供试液制备
胡芦巴籽(100 g)加入 200 mL水-乙醇 (95∶5, v/v)溶液置于铁碾槽中研磨,将研磨的混合物置于高速组织捣碎机中,再加入 200 mL水-乙醇 (95∶5, v/v)溶液高速捣碎(2×10 min),离心 30 min(10000 rpm),上清液用 3×400 mL石油醚萃取,有机相加入 3×100 mL饱和Na2CO3萃取酸性饱和部分,分液后水相加入 5 mol/L HCl酸化调 pH=2,再用 4× 100 mL石油醚萃取,有机相再用饱和 NaCl洗涤,然后用Oldershow柱浓缩至 10 mL以下,无水 Na2SO4干燥,定容至 10 mL,即为供试液。
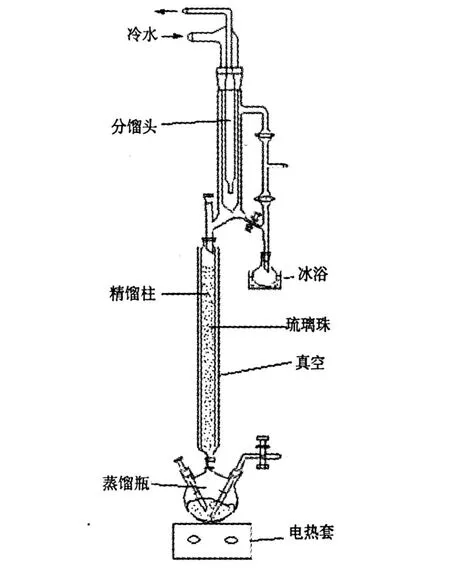
图 2 Oldershow精馏柱装置Fig.2 Oldershow fractionation apparatus
Oldershow柱是一个小型精馏装置,由分馏头、精馏柱和蒸馏瓶三部分组成,精馏柱的夹套抽真空,柱体内部填充玻璃珠,改善气液接触。蒸馏瓶中的混合物中的各组分,由于物质沸点的不同,先后经过精馏柱,通过分馏头部分的活塞控制回流比,可以使低沸点易挥发组分从分馏头分出,高沸点难挥发组分则回流到蒸馏瓶中,从而达到不同沸点的多种组分分馏提纯的目的。
1.2.2 气相色谱条件
Agilent 4890D气相色谱仪,HP-1毛细管柱 (30 m×0.250 mm×0.25μm),进样口温度 250℃,F ID检测器温度为 250℃,起始温度 90℃,保留 5 min,程序升温速率 15℃/min,终止温度 210℃,保留 5 min,载气高纯氮气,载气流速约 1 mL/min,总流量为 34 mL/min,分流比约 40:1。进样 1μL。
1.2.3 气相色谱-质谱联用分析条件
毛细管气相色谱柱 HP-5MS(0.25 mm×30 m ×0.25μm),载气氦气,流速 50 mL/min,分流比 50∶1,进样口温度 240℃,柱温:初温 90℃、保留 5 min,终温 210℃、保留 10 min,升温速率 15℃/min。电子轰击源 EI,电离能量70 ev,离子源温度 260℃。质量扫描范围为 30~380 amu,进样量 1μL。
2 结果与讨论
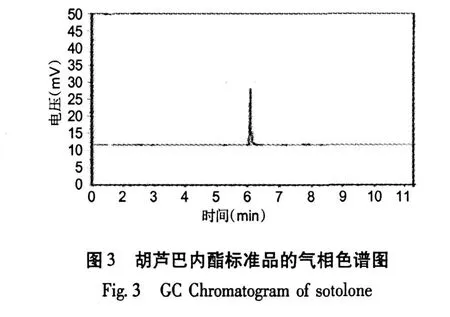
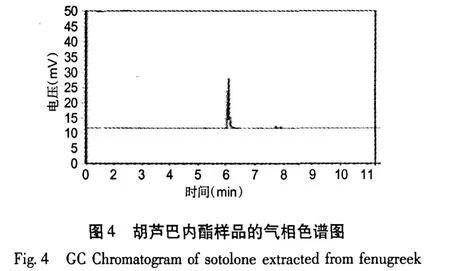
2.1 胡芦巴内酯的气相色谱定性分析
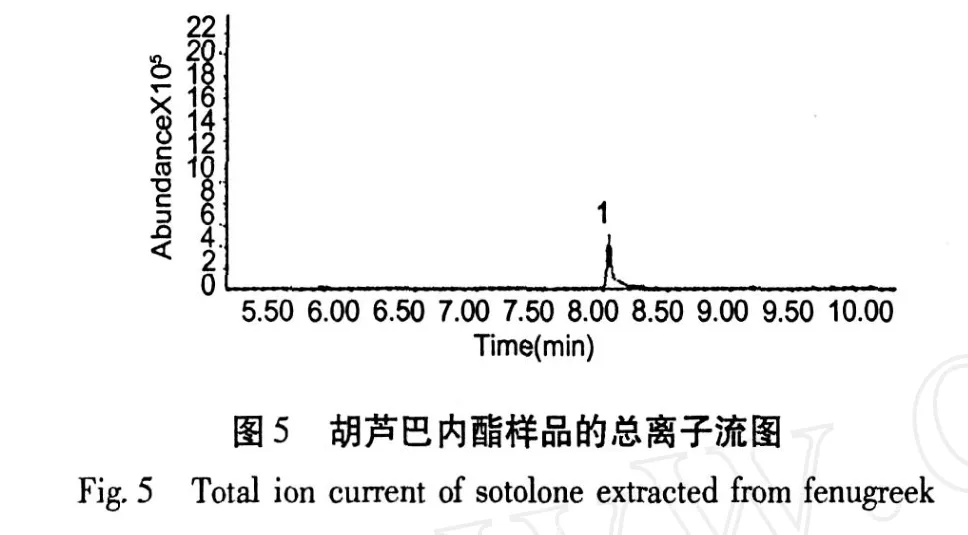
图 3为胡芦巴内酯标准品的气相色谱图,图 4为“1.2.2气相色谱条件”项下样品的色谱图。由图4可以看出样品处理以后排除了脂肪酸的干扰,并且使胡芦巴内酯得到了富集。气相色谱的分离效果良好,保留时间适宜,且样品和标准品的出峰时间一致,可以推断为同一种物质。
2.2 气相色谱-质谱联用鉴定胡芦巴内酯
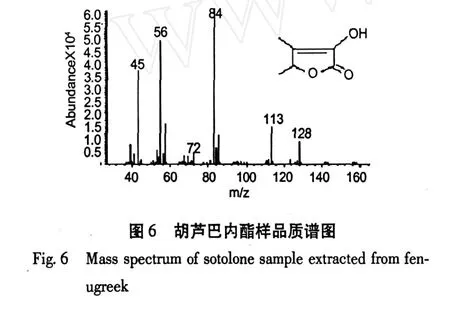
图 5为胡芦巴内酯样品的总离子流质谱图,图6为胡芦巴内酯样品的质谱图。胡芦巴内酯的定性是经测定其质谱、查阅有关文献[5],并结合有机化合物的质谱断裂规律来确定的。图 6中的分子离子峰为m/z128。图 7为胡芦巴内酯质谱峰可能的形成过程。
2.3 胡芦巴内酯标准曲线的建立
精密称取胡芦巴内酯标准品适量,加入精馏处理的石油醚,超声促溶,配制 81μg/mL,101μg/ mL,162μg/mL,202μg/mL和 1013μg/mL的胡芦巴内酯标准溶液,按照“1.2.2气相色谱条件”分析,每个样品进样 3次,取峰面积的平均值。以浓度为横坐标,胡芦巴内酯峰面积为纵坐标做线性回归,得回归方程 Y=796.48+63036X,线性范围 81~1013μg/mL。R2=0.9993。
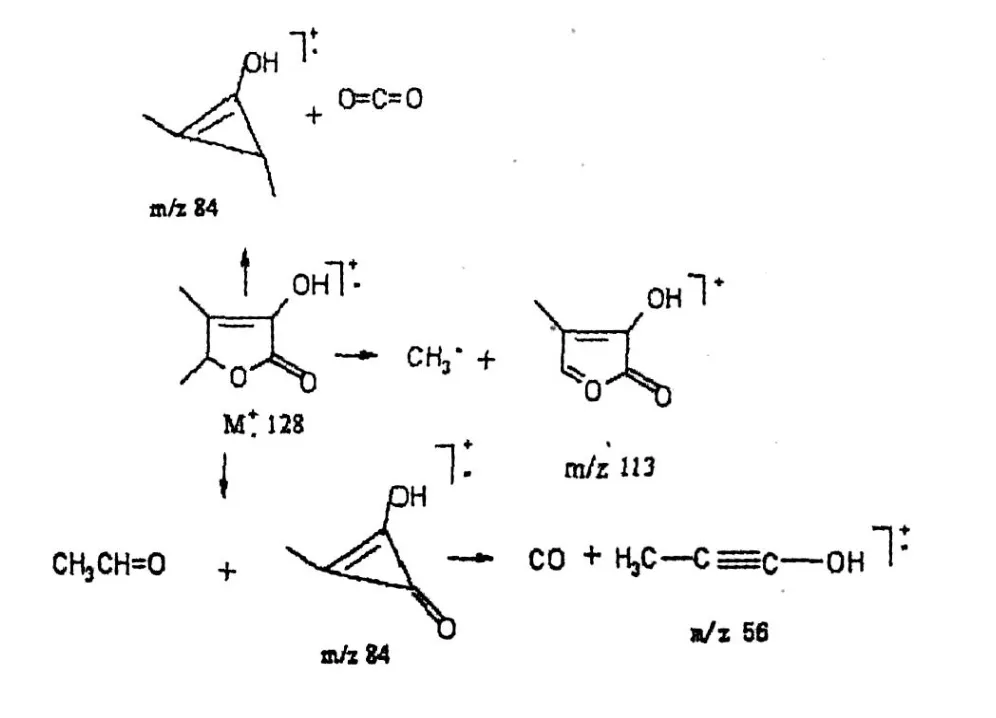
图 7 胡芦巴内酯样品的质谱分析Fig.7 Mass spectrum analyses of sotolone from fenugreek
2.4 精密度和重现性试验
以同一份胡芦巴内酯标准品溶液,连续进样 5次,每次1μL,记录色谱图,以色谱峰面积计算,RSD =2.18%(n=5),按胡芦巴样品液制备方法提取,按胡芦巴内酯样品液制备方法提取制备 5份平行的样品供试液,进行进样,每份供试液进样 1μL,连续进样 5次,RSD=3.02%(n=5)。
2.5 加样回收率试验
取已知含量的胡芦巴籽,添加 1 mL的 0.1 mg/ mL标准品的石油醚溶液于原料中,按照样品供试液制备方法提取、测定,并计算回收率。平均回收率为96.14%,RSD=2.26%(n=5).
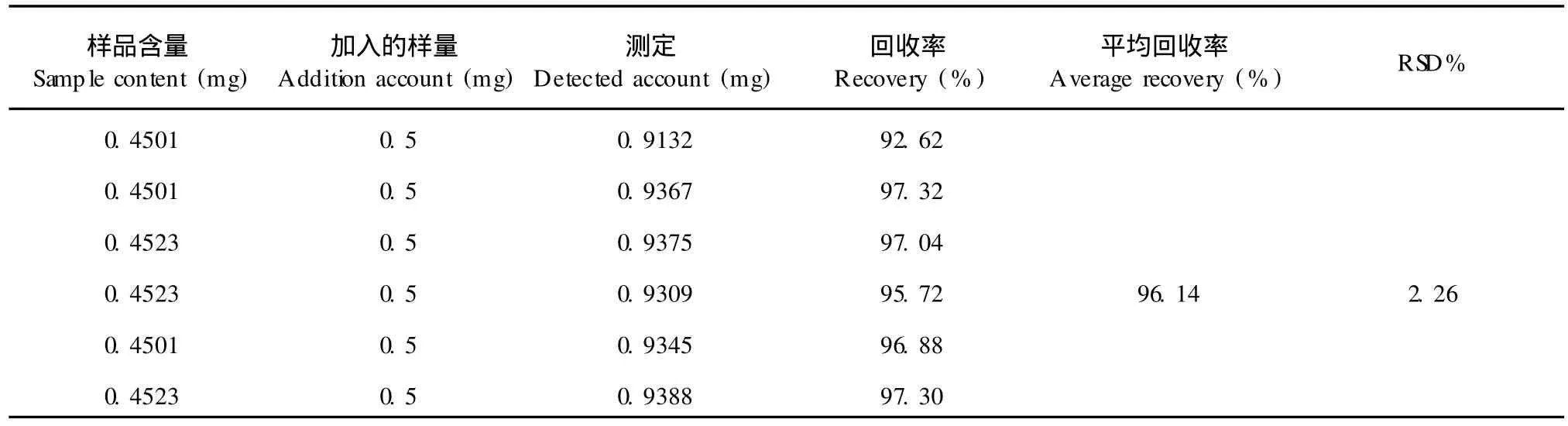
表 1 胡芦巴内酯的加样回收率实验Table 1 Results of sotolone’s recovery test
2.6 稳定性试验
将样品供试液在室温下贮存,于 0、0.5、2、4、8、12、24 h测定,结果样品溶液在 24 h内基本稳定, RSD=3.24%(n=7)。由于分析样品以石油醚为溶剂,而石油醚易挥发,因此样品宜现配现测,避免由于溶剂挥发造成的误差。
2.7 样品测定结果
对安徽产的胡芦巴籽中的胡芦巴内酯的含量进行了测定,每个样品重复试验三次,取其平均值,含量为 4.5 mg/kg。
2.8 讨论
本实验中测得安徽产的胡芦巴籽中的胡芦巴内酯含量很低,只有 4.5 mg/kg,但也在文献[3]报道的不同产地、不同年份的胡芦巴籽中的胡芦巴内酯含量(3 mg/kg~25 mg/kg)范围内,并且贮存时间越长,含量增高。这可能是因为产地的不同影响了胡芦巴籽中胡芦巴内酯前体物的含量,而贮存时间的长短影响了胡芦巴内酯前体物转化为胡芦巴内酯的生物转化过程。但是即使是贮存了 10年的胡芦巴籽,其胡芦巴内酯含量也只有 25.1 mg/kg。陈永宽等[6]等设计了一种合成胡芦巴内酯的简便方法:以草酸二乙酯为原料,经二步反应合成胡芦巴内酯。操作简便,产率为 67%,合成路线如下:
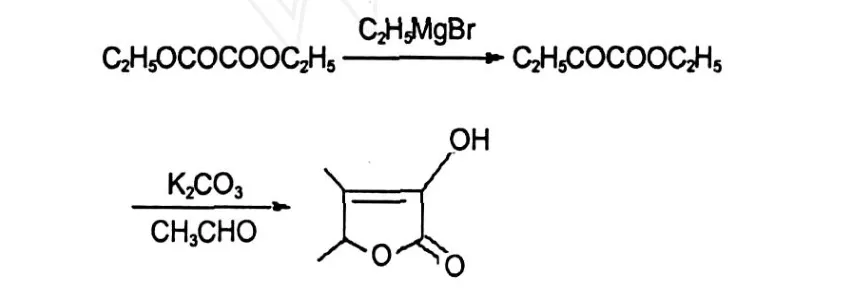
图 8 胡芦巴内酯的合成路线[9]Fig.8 The synthesis process of sotolone[9]
食品行业使用胡芦巴浸膏作为食用香料,由文献[4]的结果可以看出在制备胡芦巴浸膏的过程中胡芦巴内酯成分已经丢失了,因此使用时可以将胡芦巴内酯合成品添加到胡芦巴浸膏中,以期得到更佳的增香效果。
3 结论
本文建立了胡芦巴内酯的气相色谱分析方法,高效、准确、分析时间适中,可用于原料中胡芦巴内酯的定性及定量分析。
1 Mao DB(毛多斌).Cigarette Blend and Flavoring(卷烟配方和香精香料).Beijing:Chemical Industry Press,001.200-203.
2 Sauvaire Y,Girardon P,Baccou JC,et al.Changes in growth, proteins and free amino acids of developing seed and pod of fenugreek.Phytochem istry,1984,23:479-486.
3 Blank I,Lin JM,Devaud S,et al.The Principal Flavor Components of Fenugreek(Trigonella foenum-graecum L.).ACS Sym posium Series,1997,660(3):12-28.
4 DongL(董丽),CaiLS(蔡凌霜),Zhu SK(朱书奎).Analysis of Volatile Components of Fenugreek Concrete by Gas Chromatography/Mass Spectrometry with Solid-Phase Microextraction.J W uhan Univ,Nat Sci(武汉大学学报,理学版),2004,(2):151-156.
5 Zhang ZX(张正行).Spectrum Analysis of Organic Compounds(有机光谱分析)Beijing:People’sMedical Publishing House,2009.188-208.
6 Chen YK(陈永宽),Kong NC(孔宁成),Li C(李聪),et al.A Convenient Synthesis of Fenugreck Lactone.Fine Chem (精细化工),2002,9:510-511.
Analysis of the Principal Flavor Components in Fenugreek(Trigonella foenum-graecumL.)
REN Xiao-feng1*,ZHU Wen-jing2,MA Hai-le1,CHEN Jun11School of Food and B iological Engineering;2Jing jiang college,Jiangsu University,Zhenjiang 212013,China
In order to establish a method for deter mination of the principal flavor components sotolone in fenugreek,sotolone was extracted from fenugreek by solvent and concentrated on Oldershow column.Sotolone in fenugreek was determinated according to the extra-calibration curve by GC and identificated by GC-MS.Sotolone in fenugreek produced in Anhui province was determinated.The method using GC-MS and GC was high-efficient,precise,and stable with an acceptable analysis time.
fenugreek;sotolone;GC;GC-MS
1001-6880(2010)06-1065-04
2009-05-31 接受日期:2009-09-24
中国烟草总公司云南省公司项目(2001(B)203)
*通讯作者 Tel:86-511-88780201;E-mail:rxfzwj@126.com
TQ651+.2
A
