高糖和外源性硝化试剂导致人脐静脉内皮细胞蛋白质硝化的研究*
2010-11-24赵玉玲卢乃浩高中洪
赵玉玲, 卢乃浩, 高中洪
(1.浙江师范大学 化学与生命科学学院,浙江 金华 321004;2.华中科技大学 化学与化工系,湖北 武汉 430074)
高糖和外源性硝化试剂导致人脐静脉内皮细胞蛋白质硝化的研究*
赵玉玲1, 卢乃浩2, 高中洪2
(1.浙江师范大学 化学与生命科学学院,浙江 金华 321004;2.华中科技大学 化学与化工系,湖北 武汉 430074)
采用细胞生物学及化学方法,检测了高浓度的糖和外源性硝化试剂作用于人脐静脉内皮细胞(ECV304)后所导致的细胞蛋白氧化损伤及硝化损伤.结果发现:高浓度的糖(30和40 mmol/L)可以导致细胞发生氧化损伤,主要包括降低细胞存活率、降低胞内还原型谷胱甘肽(GSH)的含量、增加胞内一氧化氮(NO)代谢产物亚硝酸盐和硝酸盐的含量;在细胞蛋白内也检测到蛋白质硝化的产物.研究发现:蛋白质硝化可以进一步加强细胞损伤的程度,而高浓度的糖和外源性硝化试剂导致的细胞蛋白硝化有所不同,其原因可能是在糖尿病血管并发症中蛋白质是有选择地发生硝化反应的.
糖尿病血管并发症;高浓度的糖;外源性硝化试剂;蛋白质硝化;内皮细胞
内皮作为血液和间质之间的半渗透屏障,可使水和小分子的交换容易进行,同时它还参与了代谢、合成以及调控途径[1].内皮功能的丧失会损害血管,该现象在Ⅰ型和Ⅱ型糖尿病中都有发生.在糖尿病以及糖尿病血管并发症的发生和发展过程中,高浓度的糖可以产生活性氧已经得到了公认[2-4].一氧化氮(NO)是最重要的血管舒张剂,同时参与了Ⅰ型糖尿病[5]和Ⅱ型糖尿病[6-7]的发生和发展.
氧化应激发生时,氧自由基的生成增加,进而可以抑制过量产生的一氧化氮,产生更强的氧化剂如硝化酪氨酸残基,损伤蛋白质,生成硝化蛋白,已经在糖尿病研究中得到了证实[8-9].在糖尿病病体内,高浓度的糖诱导内皮细胞产生硝基酪氨酸,说明过氧亚硝基阴离子可能参与了糖尿病及糖尿病血管并发症的发病过程[8,10].但是对高浓度的糖导致内皮细胞产生蛋白质硝化还知之甚少.
本文拟探讨:(1)高浓度的糖是否可以损伤内皮细胞?(2)高浓度的糖导致的硝化现象与外源性硝化试剂有何不同?
1 材料与方法
1.1试剂与药品
兔多克隆抗3-硝基酪氨酸(3-NT)抗体购自Upstate公司;辣根酶标记山羊抗兔IgG(H+L),增强化学发光(ECL)试剂购自Pierce公司;D-葡萄糖、邻苯二甲醛(OPA)、谷胱甘肽(GSH)、氯高铁原卟啉(hemin)、葡萄糖氧化酶(GOx,用于体内持续释放H2O2)及烟酸己可碱(Hoechst33342)均购自Sigma公司;溴化-4,5-二甲基-2-噻唑基-2,5-二苯基氮唑(MTT,噻唑蓝)及细胞培养所需物品均购自Gibco公司;亚硝酸盐(nitrite)及其他试剂均为国产分析纯.
1.2主要实验仪器
SPECTR Amax PLUS384型酶标仪,倒置荧光显微镜,凝胶成像系统及凝胶分析软件,DYY-7C型电泳仪,DYC-40C型半干电转移槽,RF-5301型荧光分光光度计,Beckman高速离心机,Beckman P/ACETMMDQ型毛细管电泳仪,SSQ-H型不锈钢水浴锅.
1.3细胞培养
人脐静脉内皮细胞系(ECV304)购自中国典型培养物保藏中心(CCTCC,中国武汉).单层贴壁生长,上皮状,用含10%新生小牛血清、100 U/mL青霉素和100 μg/mL链霉素的DMEM高糖完全培养基于37 ℃,含5% CO2的培养箱中培养.每隔1 d进行细胞换液,每隔3 d传代1次.为了保证细胞株的稳定性,用于进行实验的细胞传代不超过8代.分别将1×105个/mL细胞接种至24孔培养板、6孔培养板、35 mm培养皿和10 cm培养皿中培养,当细胞培养到有大约80%融合时,换入无血清培养基再培养24 h,然后进行分组培养72 h.细胞分组如下:正常对照组(Blank,正常葡萄糖浓度的完全培养基)、高糖Ⅰ组(HG30,在正常浓度葡萄糖的基础上增加D-葡萄糖至终浓度为30 mmol/L)、高糖Ⅱ组(HG40,在正常浓度葡萄糖的基础上增加D-葡萄糖至终浓度为40 mmol/L)和hemin-nitrite-H2O2体系(hemin,2.0 μmol/L;nitrite,0.75 mmol/L;GOx,2.0 mU/mL).
1.4细胞存活率测定
细胞存活率通过对培养的细胞内固定的脱氢酶活性进行MTT测试得到[11].
1.5细胞内谷胱甘肽(GSH)含量测定
细胞内GSH含量的测定参照文献[12]中的方法进行,对于细胞的处理则参照文献[13]的方法进行了修改.
1.6细胞内外一氧化氮(NO)含量测定
用毛细管电泳法测定细胞内亚硝酸盐及培养基中硝酸盐的含量,以此反映高糖导致细胞内外产生的NO的含量.
1.6.1 培养基中硝酸盐含量测定
用等体积的三氯乙酸(TCA,20%)溶液沉淀培养基中的蛋白质,混匀,静置30 s,以8 000 r/min离心15 min,弃沉淀;取上清再重复一次离心过程.弃沉淀,上清液用于测定细胞外的硝酸盐含量.
1.6.2 细胞内亚硝酸盐含量测定
细胞在收获前用冰冷的磷酸盐缓冲液(PBS,pH 7.4)洗涤2次,4 000 r/min离心15 min(4 ℃);弃上清,沉淀用冰冷的磷酸盐缓冲液(pH 7.4)洗涤2次,重复离心;所得沉淀溶解在200 μL PBS中,细胞悬液反复冻融3次,在冰浴中轻微超声进行匀浆,4 000 r/min离心15 min(4 ℃).弃沉淀,上清液用于测定细胞内的亚硝酸盐含量.
1.7细胞凋亡检测
通过荧光染料Hoechst33342进行细胞凋亡的检测[14].药物作用后的细胞,每孔加入1 mL 5 μg/mL的Hoechst33342溶液,在室温下避光负载30 min.洗去多余的荧光染料,Petri培养皿置于倒置荧光显微镜的载物台上观察,用紫外光激发观测,用电荷耦合元件(CCD)系统拍照.
1.8细胞内蛋白质硝化检测
高浓度的糖以及hemin-nitrite-H2O2体系导致ECV304细胞产生的蛋白质硝化现象通过免疫印迹法(western blot)进行检测.收获10 cm培养皿中的细胞进行裂解,裂解后的细胞悬液离心处理后测其蛋白浓度.取80 μL已知蛋白浓度的细胞悬液,加入20 μL上样缓冲溶液(5×),混匀后置于沸水中煮3 min,然后按照保持各组上样蛋白量一致的原则,取相应量样品放在十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)上进行电泳.电泳后,细胞蛋白被转移到硝酸纤维素膜上,用抗3-硝基酪氨酸(3-NT)多克隆抗体(稀释倍数为1∶8 000)进行免疫印迹,之后,用辣根过氧化物酶标记的羊抗兔二抗(稀释倍数为1∶3 000)搅动孵育,用增强化学发光(ECL)法检测3-NT水平.曝光时间视实验效果而定.
1.9细胞内蛋白质含量测定
蛋白质含量按Bradford法[15]测定,以牛血清白蛋白(BSA)为标准.
1.10数据统计
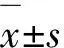
2 结 果
2.1高糖对细胞存活率的影响
终浓度为30和40 mmol/L的D-葡萄糖,可以显著降低ECV304细胞活力(见图1).对内皮细胞,高浓度的糖作用72 h已经可以造成糖尿病的体外模型[16].
2.2高糖对细胞内GSH含量的影响
如图2所示,终浓度为30和40 mmol/L的D-葡萄糖作用72 h后,细胞内GSH的含量显著减少,其最大减少量几乎达到50%,并且呈剂量依赖趋势.
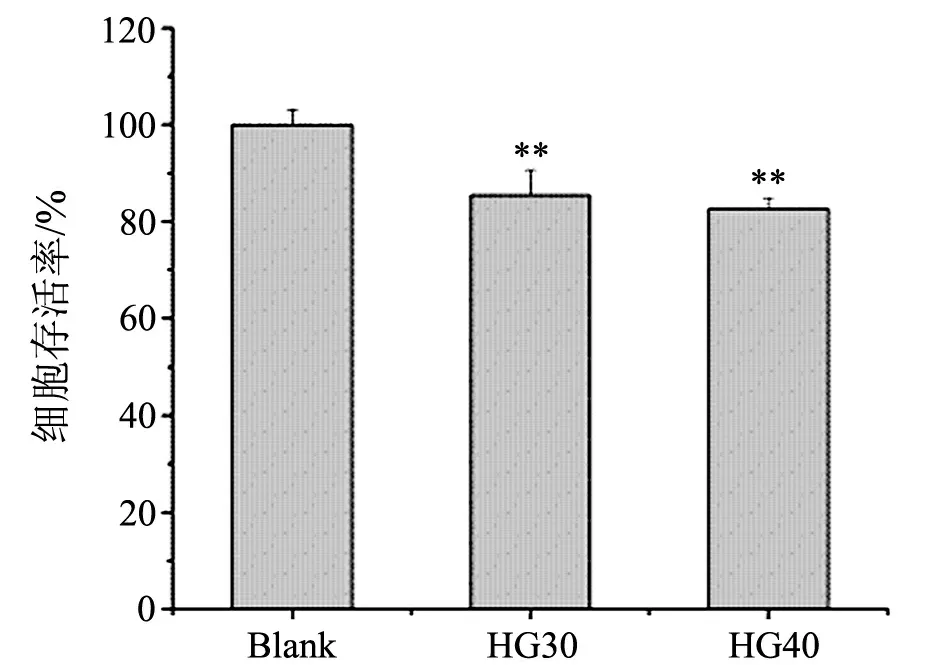
**表示Plt;0.01,高糖Ⅰ组和Ⅱ组与对照组差异显著图1 高浓度的糖对细胞活力的影响
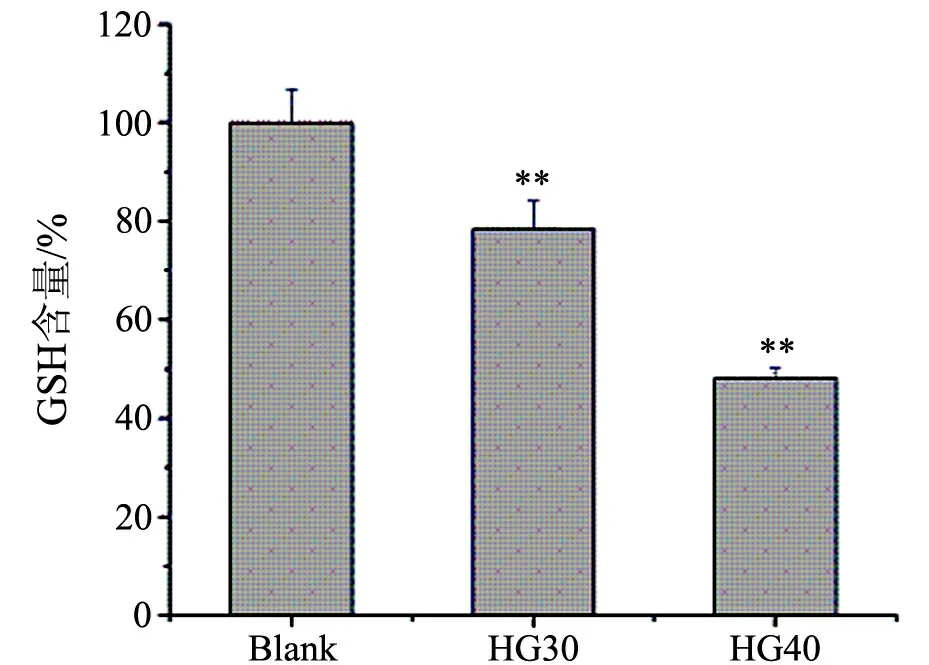
**表示Plt;0.01,高糖Ⅰ组和Ⅱ组与对照组差异显著图2 高浓度的糖对细胞内GSH含量的影响
2.3高糖对亚硝酸盐和硝酸盐含量的影响
如图3所示,终浓度为30和40 mmol/L的D-葡萄糖作用72 h后,显著增加了细胞内亚硝酸盐的含量,其增加量可以达到40%(见图3(a)),培养基中硝酸盐的含量则增加了25%(见图3(b)).
2.4Hemin-nitrite-H2O2体系对细胞活力的影响
如图4所示,在给定的浓度下,hemin-H2O2(H-GOx)体系可以显著降低ECV304细胞的存活率,而一定浓度的亚硝酸盐(Nitrite,0.75 mmol/L)则对细胞生长基本没有影响.当在hemin-H2O2体系中加入亚硝酸盐后,hemin-nitrite-H2O2(H-N-GOx)体系对细胞的损伤加重,说明硝化反应会进一步加重细胞损伤的程度.
2.5Hemin-nitrite-H2O2体系对细胞凋亡的影响
Hemin-nitrite-H2O2体系作用于细胞后,观察到细胞核变形,部分细胞核碎裂成小块,呈现典型的凋亡形态(见图5,箭头所指),证实hemin-nitrite-H2O2体系可以损伤细胞.
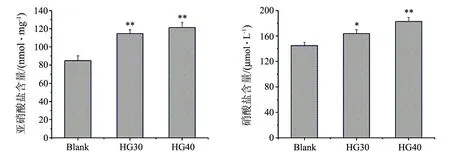
(a)亚硝酸盐含量 (b)硝酸盐含量**表示Plt;0.01,高糖Ⅰ组和Ⅱ组与对照组有极显著差异图3 高浓度的糖对细胞内亚硝酸盐和细胞外硝酸盐含量的影响
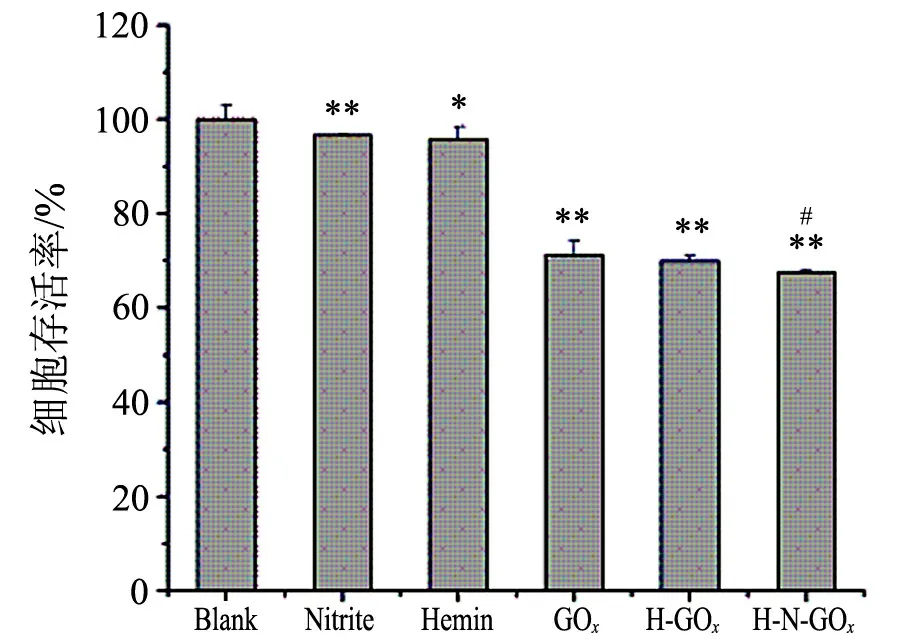
**表示Plt;0.01,药物作用组与对照组差异显著#表示Plt;0.05,hemin-H2O2体系加入亚硝酸盐前后差异显著图4 Hemin-nitrite-H2O2体系对细胞活力的影响
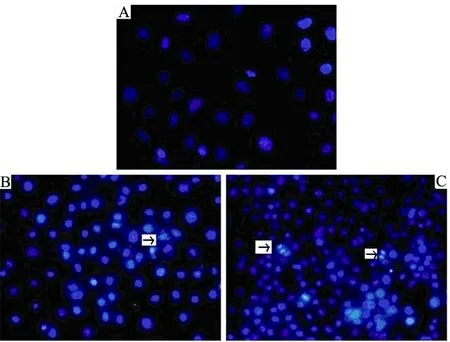
A:对照组;B:hemin-GOx作用;C:hemin-nitrite-GOx作用图5 Hemin-nitrite-H2O2体系导致的细胞凋亡
2.6高糖及hemin-nitrite-H2O2体系对细胞内蛋白质硝化的影响
高浓度的糖作用于ECV304细胞72 h后,Western blot显示在细胞中原有的硝化蛋白条带的强度增加,特别是分子量为 34,43和50 kD碱基对的细胞蛋白(见图6(a)中条带2和条带3),暗示高浓度的糖作用于细胞72 h后发生了明显的蛋白质硝化现象.
在hemin-nitrite-H2O2体系所导致的细胞蛋白质硝化反应中,除了原有的硝化条带之外,还另外增加了分子量为11,17和20 kD碱基对的硝化条带(见图6(a)中条带7),并且原有的硝化条带的强度也有所增加.
3 讨 论
在糖尿病血管病变的发生和发展中,内皮功能丧失及进一步的损伤发挥了重要的作用[17-19].体液中葡萄糖浓度的增加与糖尿病血管并发症的
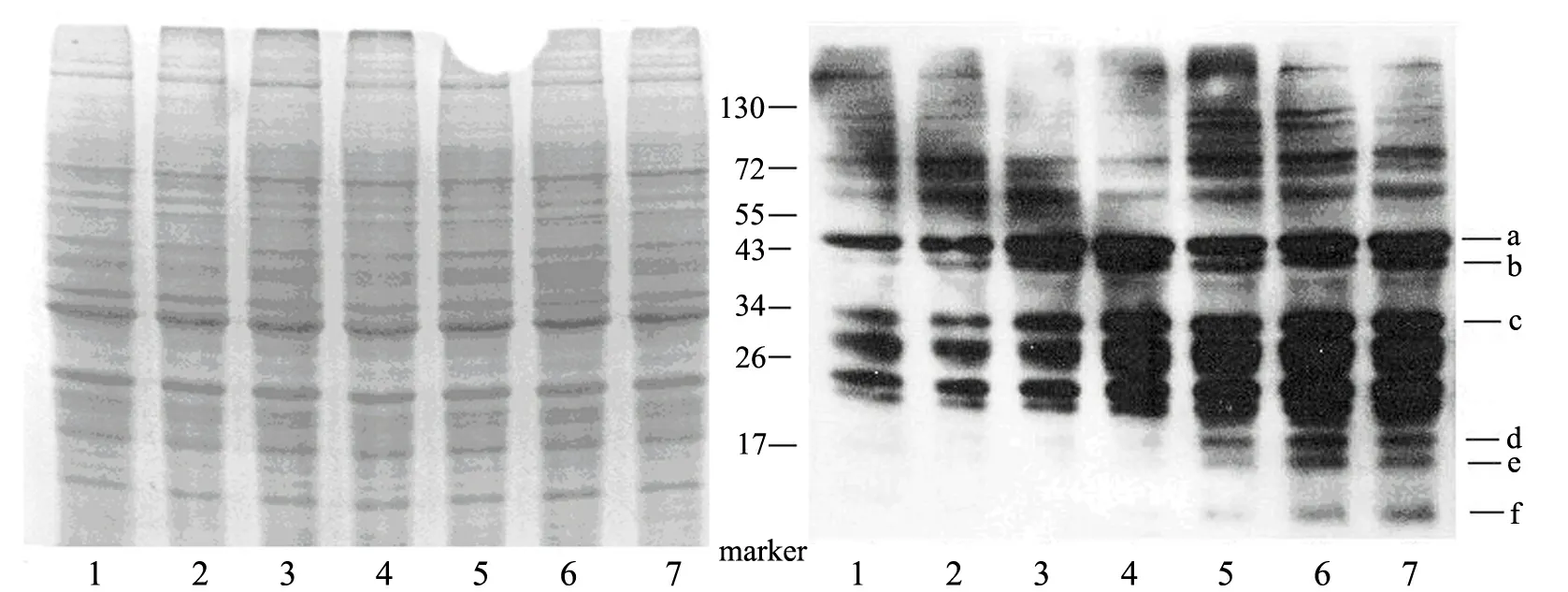
(a)SDS-PAGE电泳和Western blot检测
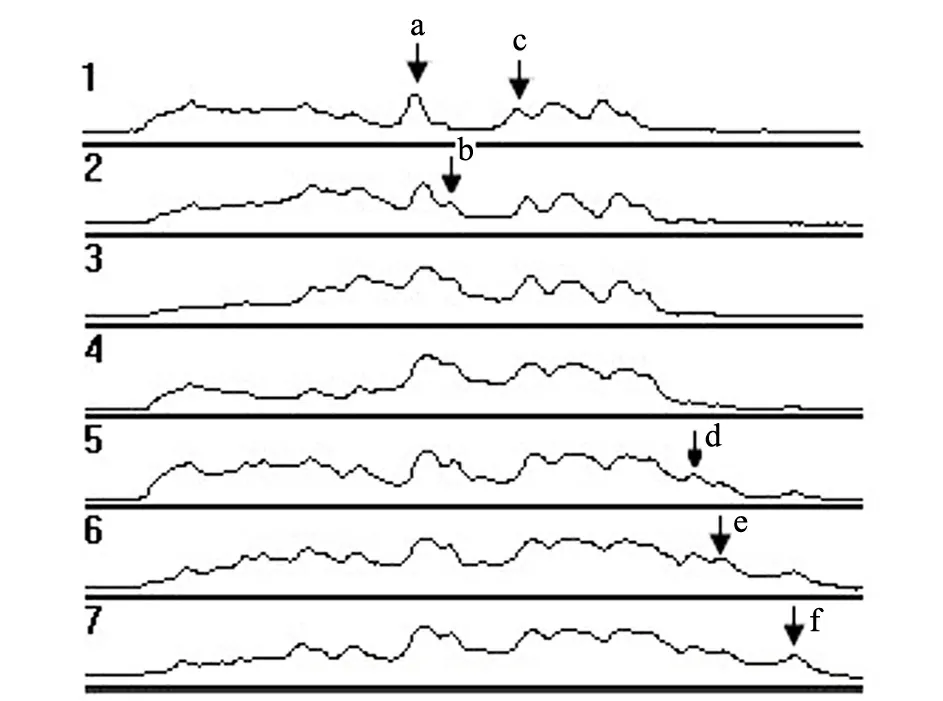
(b)蛋白硝化相应的光密度图谱

(c)特定分子量蛋白硝化的光密度1:Blank;2:HG30;3:HG40;4:hemin;5:nitrite;6:hemin-GOx;7:hemin-nitrite-GOx**表示Plt;0.01,高糖和hemin-nitrite-H2O2体系作用后与对照组有极显著差异图6 高浓度的糖及hemin-nitrite-H2O2体系导致的细胞蛋白质硝化
发生和发展紧密相关.高浓度的糖可以在糖尿病病人体内产生氧化应激,导致严重的内皮功能丧失,主要包括降低细胞存活率[20]、打破抗氧化酶体系的平衡[21]及增加NO的释放(亚硝酸盐和硝酸盐含量增大)[22]等.本研究发现:高浓度的糖作用于ECV304细胞72 h后,可以降低细胞存活率(见图1)、降低GSH含量(见图2)、增加活性氮含量(见图3).这些实验结果表示:高浓度的糖作用于ECV304后可以产生氧化损伤.
高浓度的糖作用于内皮细胞时会产生超氧阴离子(O2.-),O2.-能够结合NO,进而产生更强的氧化剂和硝化剂——过氧亚硝基阴离子(ONOO-),ONOO-可以进一步导致蛋白质发生蛋白质酪氨酸硝基化.已经在高浓度的糖作用的内皮细胞中发现了蛋白质硝化现象[11,23].含有铁卟啉的蛋白,如血红素蛋白、肌红蛋白、含铁卟啉的酶,以及铁卟啉本身,均可以催化NO-2/H2O2体系发生蛋白质硝化反应生成3-硝基酪氨酸(3-NT)[24],这在生理病理条件下是较ONOO-更可能发生的反应.为了观察高浓度的糖和外源性硝化试剂导致的蛋白质硝化反应之间的异同、硝化反应对细胞存活率及凋亡的影响,本实验以hemin-nitrite-H2O2体系作为外源性硝化试剂,观察了它们对ECV304细胞的影响,结果发现:终浓度分别为30 mmol/L(见图6(a)中条带2)和40 mmol/L(见图6(a)中条带3)的D-葡萄糖作用于ECV304细胞72 h后,蛋白质中硝化条带的数量和强度都有所增加(尤其是分子量为34,43和50 kD碱基对的蛋白质).由此推测,高浓度的糖作用于ECV304细胞后,先产生ONOO-,然后ONOO-再损伤蛋白质发生酪氨酸硝化,且高浓度的糖引起的蛋白质硝化对不同的蛋白质有一定的选择性.
从图4和图5可以发现,尽管外加的亚硝酸盐在给定的浓度下对ECV304细胞无损伤,却可以显著加重hemin-H2O2体系对细胞的损伤程度.类似的现象在文献[25]中也有报道.对这一现象唯一的解释,就是在hemin-H2O2体系中加入亚硝酸盐后发生了蛋白质硝化反应,加重了细胞损伤的程度.文献[26]的报道与我们的推测类似,即:外加亚硝酸盐后可以导致小鼠肝脏中酶活性进一步降低,而其原因可能就是肝脏蛋白发生了蛋白质硝化反应.通过比较hemin-nitrite-H2O2体系和hemin-H2O2体系作用于ECV304细胞后的蛋白质硝化现象,可以发现:在分子量为11,17,20,66和80 kD碱基对的细胞蛋白中,hemin-nitrite-H2O2体系导致硝化的条带强度大于hemin-H2O2体系(见图6(a));同时,硝化条带的增加更为明显(11,17和20 kD碱基对),说明蛋白质硝化反应可以导致细胞进一步损伤[25].无论外源性试剂还是高浓度的糖所导致的蛋白质硝化条带在分子量为90~170 kD碱基对的强度都有所降低,对于该现象,还需要对其机理做进一步的研究.
4 结 论
通过本研究可以推出如下结论:(1)高浓度的糖可以剂量依赖性地导致ECV304细胞产生损伤,主要包括:降低细胞存活率、降低GSH含量、增加活性氮含量(细胞内亚硝酸盐含量及培养基中硝酸盐含量),以及蛋白质硝化现象发生;(2)蛋白质硝化可以进一步加重细胞损伤;(3)对某些蛋白质来说,高浓度的糖所导致的蛋白质硝化现象同其他外源性硝化试剂(如hemin-nitrite-H2O2体系)所导致的蛋白质硝化相类似,不同之处在于:外源性硝化试剂所导致的蛋白质硝化主要发生在小分子量蛋白质上(11,17和20 kD碱基对).通过对比高浓度的糖及外源性硝化剂所导致的蛋白质硝化,可以推测:在糖尿病血管并发症的发生和发展中,蛋白质硝化反应参与了损伤过程,并且蛋白质中的酪氨酸会有选择地发生硝化反应.
[1]Rubani G M.The role of endothelium in cardiovascular homeostasis and diseases[J].J Cardiovasc Pharmacol,1993,22(Suppl 4):1-14.
[2]Ceriello A.Oxidative stress and diabetes-associated complications[J].Endocr Pract,2006,12(Suppl 1):60-62.
[3]Nishikawa T,Araki E.Impact of mitochondrial ROS production in the pathogenesis of diabetes mellitus and its complications[J].Antioxid Redox Signal,2007,9(3):343-353.
[4]Brezniceanu M L,Liu Fang,Wei Chichang,et al.Catalase overexpression attenuates angiotensinogen expression and apoptosis in diabetic mice[J].Kidney Int,2007,71(9):912-923.
[5]Chan N N,Vallance P,Colhoun H M.Nitric oxide and vascular responses in Type Ⅰ diabetes[J].Diabetologia,2000,43(2):137-147.
[6]Farkas K,Sármán B,Jermendy G,et al.Endothelial nitric oxide in diabetes mellitus:too much or not enough?[J].Diabetes Nutr Metab,2000,13(5):287-297.
[7]Endemann D H,Schiffrin E L.Nitric oxide,oxidative excess,and vascular complications of diabetes mellitus[J].Curr Hypertens Rep,2004,6(2):85-89.
[8]Cosentino F,Eto M,Paolis P D,et al.High glucose causes upregulation of cyclooxygenase-2 and altes prostanoid profile in human endothelial cells:role of protein kinase C and reactive oxygen species[J].Circulation,2003,107(7):1017-1023.
[9]Reddy S,Bradley J.Immunohistochemical Demonstration of Nitrotyrosine,a Biomarker of Oxidative Stress,in Islet Cells of the NOD Mouse[J].Ann N Y Acad Sci,2004,1037:199-202.
[10]Zou Minghui,Shi Chaomei,Cohen R A.High glucose via peroxynitrite causes tyrosine nitration and inactivation of prostacyclin synthase that is associated with thromboxane/prostaglandin H(2) receptor-mediated apoptosis and adhesion molecule expression in cultured human aortic endothelial cells[J].Diabetes,2002,51(1):198-203.
[11]Mosmann T.Rapid colorimetric assay for cellular growth and survival:application to proliferation and cytotoxicity assays[J].J Immunol Methods,1983,65(1/2):55-63.
[12]Hissin P J,Hilf R A.Fluorimetric method for determination of oxidized and reduced glutathione in tissues[J].Anal Biochem,1976,74(1):214-226.
[13]Jiao Hongli,Ye Ping,Zhao Baolu.Protective effects of green tea polyphenols on human HepG2 cells against oxidative damage of fenofibrate[J].Free Radic Biol Med,2003,35(9):1121-1128.
[14]Sun Lina,Li Liaoliao,Li Zhengbin,et al.Protective effects of TREK-1 against oxidative injury induced by SNP and H2O2[J].Acta Pharmacol Sin,2008,29(10):1150-1156.
[15]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72:248-254.
[16]Kwon H,Jun H S,Yang Yang,et al.Development of autoreactive diabetogenic T cells in the thymus of NOD mice[J].J of Autoimmunity,2005,24(1):11-23.
[17]Ruderman N B,Williamson J R,Brownlee M.Glucose and diabetic vascular disease[J].FASEB J,1992,6(11):2905-2914.
[18]Cohen R A.Role of nitric oxide in diabetic complications[J].Am J Ther,2005,12(6):499-502.
[19]Zou Minghui,Ullrich V,Cohen R.Peroxynitrite and vascular endothelial dysfunction in diabetes mellitus[J].Endothelium,2004,11(2):89-97.
[20]Duffy A,Liew A,O′Sullivan J,et al.Distinct effects of high-glucose conditions on endothelial cells of macrovascular and microvascular origins[J].Endothelium,2006,13(1):9-16.
[21]Tachi Y,Okuda Y,Bannai C,et al.High concentration of glucose causes impairment of the function of the glutathione redox cycle in human vascular smooth muscle cells[J].FEBS Let,1998,421(1):19-22.
[22]Pricci F,Leto G,Amadio L,et al.Oxidative stress in diabetes-induced endothelial dysfunction involvement of nitric oxide and protein kinase C[J].Free Radic Biol Med,2003,35(6):683-694.
[23]El-Remessy A B,Bartoli M,Platt D H,et al.Oxidative stress inactivates VEGF survival signaling in retinal endothelial cells via PI 3-kinase tyrosine nitration[J].J Cell Sci,2005,118:243-252.
[24]Chen H J,Chang C M,Lin Wenpeng,et al.H2O2/Nitrite-Induced Post-translational Modifications of Human Hemoglobin Determined by Mass Spectrometry: Redox Regulation of Tyrosine Nitration and 3-Nitrotyrosine Reduction by Antioxidants[J].Chembiochem,2008,9(2):312-323.
[25]Zhao Yuling,Li Hailing,Gao Zhonghong,et al.Effects of flavonoids extraced from Scutellaria baicalensis Georgi on hemin-nitrite-H2O2induces liver injury[J].Eur J Pharm,2006,536(1/2):192-199.
[26]Turowski S G,Jank K E,Fung H L.Inactivation of hepatic enzymes by inhalant nitrite—in vivo and in vitro studies[J].AAPS J,2007,9(3):E298-E305.
(责任编辑 薛 荣)
Highglucoseandexogenousnitratingagentsinducedhumanumbilicalveinendothelialcellinjury:involvementofproteintyrosinenitration
ZHAO Yuling1, LU Naihao2, GAO Zhonghong2
(1.CollegeofChemistryandLifeScience,ZhejiangNormalUniversity,JinhuaZhejiang321004,China; 2.DepatmentofChemistryandChemicalEngineering,HuazhongUniversityofScienceandTechnology,WuhanHubei430074,China)
Oxidative and nitrative injury in human umbilical vein endothelial cells (ECV304) induced by high glucose and exogenous nitrating agent were detected by cell biological and chemical methods. It was found that high glucose (30 mmol/L and 40 mmol/L) stimulated ECV304 injury in a dose-dependent manner, including reducing cell viability, decreasing glutathione (GSH) content, increasing the production of nitric oxygen (NO) (increased nitrite content in cell and nitrate content in medium) and generating protein tyrosine nitration. It was also found that protein tyrosine nitration could induce cell injury further. Tyrosine nitration induced by high glucose was different from extrinsic factors. It could be speculated that protein was nitrated selectively to generate nitrotyrosine in diabetic vascular complications.
diabetic vascular complications; high glucose; exogenous nitrating agent; protein nitrotyrosine; endothelial cells
1001-5051(2010)01-0082-07
2009-07-02
浙江师范大学博士科研启动基金资助项目(ZC304009077);浙江师范大学校级青年基金资助项目(KYJ06Y09040)
赵玉玲(1977-),女,河南南阳人,讲师,博士.研究方向:生物无机化学.
R363.2+1
A
