PIAS1基因沉默对胰腺腺泡细胞炎症反应的影响
2010-11-24陈平董文杰孙蕴伟姚玮艳章永平乔敏敏袁耀宗
陈平 董文杰 孙蕴伟 姚玮艳 章永平 乔敏敏 袁耀宗
·论著·
PIAS1基因沉默对胰腺腺泡细胞炎症反应的影响
陈平 董文杰 孙蕴伟 姚玮艳 章永平 乔敏敏 袁耀宗
目的观察活化信号转导和转录激活因子的蛋白抑制因子-1(PIAS1)基因特异性siRNA干扰大鼠胰腺腺泡细胞株AR42J后对雨蛙素诱导炎症反应的影响,探讨其在胰腺炎发病中的作用。方法采用脂质体法将靶向PIAS1的siRNA和阴性siRNA转染AR42J细胞, 24 h后分别加入雨蛙素继续培养24 h。同时设脂质体+雨蛙素组、雨蛙素组及仅加PBS的对照组。Western blotting检测p38丝裂原激活蛋白激酶(p38MAPK)及磷酸化p38MAPK(P-p38MAPK)表达;RT-PCR及Western blotting检测各组细胞肿瘤坏死因子α(TNF-α)、白介素1β(IL-1β)、IL-6、基质金属蛋白酶9(MMP-9)的mRNA和蛋白表达。结果siRNA+雨蛙素组、阴性siRNA+雨蛙素组、脂质体+雨蛙素组、雨蛙素组及对照组细胞p38MAPK表达量分别为1.93±0.11、1.22±0.10、1.30±0.17、1.32±0.21、0.12±0.02;P-p38MAPK表达量分别为2.10±0.25、1.36±0.20、1.26±0.15、1.23±0.25、0.58±0.48, siRNA+雨蛙素组较其余各组明显增加(P值均<0.05)。siRNA+雨蛙素组细胞TNF-α、IL-1β、IL-6、MMP-9 mRNA表达量分别为1.66±0.15、1.66±0.15、1.90±0.01、1.56±0.20;蛋白的表达量分别为2.06±0.37、2.20±0.34、1.80±0.10、1.17±0.05,均较其他雨蛙素处理组表达上调(P值均<0.05)。结论PIAS1参与雨蛙素诱导的胰腺腺泡细胞p38MAPK活性与下游炎症介质的表达调控。
胰腺; 活化信号转导和转录激活子的蛋白抑制剂-1; 炎症; 细胞因子
现有研究认为,活化信号转导和转录激活因子的蛋白抑制因子-1(protein inhibitor of activated signal transducer and activator of transcription 1,PIAS1)通过阻断转录因子的DNA结合活性、募集转录的共抑制子或共激活子和促进蛋白SUMO化等机制来调节STAT信号转导途径相关蛋白转录过程[1],它能阻止免疫调控基因的产物,以防止失控性炎症反应[2]。大鼠胰腺腺泡细胞株ARJ42细胞具有类似正常胰腺腺泡细胞合成和分泌消化酶样功能[3],被广泛应用于胰腺腺泡细胞分泌、生长、增殖、分化、凋亡和炎症体外模型的研究。本研究应用RNA干扰技术静默PIAS1基因,观察雨蛙素诱导的AR42J急性胰腺炎体外模型的p38丝裂原激活蛋白激酶(p38 mitogen-activated protein kinase, p38MAPK)信号通路变化及其下游调控的炎症介质的表达,探讨PIAS1在急性胰腺炎病程中的作用。
材料和方法
一、siRNA的设计及合成
根据GenBank的PIAS1基因序列(NM_001106829),应用Ambion公司网上交互式软件在线设计3对siRNA。siRNA-A上游5′-GCAAAU-GGUUAUGAGCCUUTT-3′,下游5′-AAGGCUCAUAACCAUUUGCTT-3′;siRNA-B上游5′-GCUGGA-CGAACUGAUCAAATT-3′,下游5′-UUUGAUCAGUUCGUCCAGCTT-3′;siRNA-C上游5′-CCGGAUCAUUCUAGAGCUUTT-3′,下游5′-AAGCUCUAGAAUGAUCCGGTT-3′。同时,设计1对阴性对照siRNA,上游5′-UUCUCCGAACGUGUCACGUTT-3′,下游5′-ACGUGACACGUUCGGAGAATT-3′。所有siRNA由上海英骏生物技术有限公司合成。
二、有效siRNA筛选
AR42J细胞购自ATCC公司。常规培养后取对数生长期细胞,以每孔3×105个细胞接种于6孔培养板。当细胞覆盖达60%~80%时采用脂质体(Invitrogen公司)分别转染3对siRNA。Western blotting和RT-PCR筛选最有效siRNA。
三、细胞分组
同上述方法在6孔板中培养细胞达60%~80%融合时,采用脂质体分别转染siRNA(最有效的) 和阴性siRNA,24 h后分别加入雨蛙素(10-8mol)继续培养24 h。同时设脂质体+雨蛙素组、雨蛙素组及仅加PBS的对照组,每组设3个复孔。
四、RT-PCR检测细胞mRNA表达
Trizol试剂(Invitrogen公司)提取各组细胞总RNA,采用M-MLV第一链cDNA合成试剂盒(上海生物工程公司)合成cDNA。目的基因引物序列见表1,由上海英骏生物技术有限公司合成。反应条件:94℃ 4 min,94℃ 45 s、56℃(PIAS1和MMP-9)或55℃(GAPDH)或58℃(IL-6、IL-1β)或60℃(TNF-α)45 s,72℃延伸45 s,35个循环,72℃ 5 min。扩增产物经电泳分离,Bio-Rad凝胶成像系统摄影,Quantity One软件灰度分析,以目的条带与GAPDH条带灰度值的比值表示mRNA的表达量。
五、Western blotting检测细胞蛋白的表达
采用RIPA分裂液(申能博彩公司)抽提细胞总蛋白,BCA法定量蛋白,行常规Western blotting。抗p38MAPK、P-p38MAPK、PIAS1、TNF-α、IL-1β、IL-6、MMP-9一抗均购自Santa cruz公司,抗GAPDH抗体购自上海康成公司,ECL购自Amersham Biosciences公司。最后经数码成像系统扫描,以目的条带与GAPDH条带灰度值比值作为蛋白表达量。
六、统计学方法
结 果
一、最有效靶向PIAS1的siRNA筛选
siRNA-C转染细胞后PIAS1mRNA表达缺如,PIAS1蛋白也最弱(图1),故均以siRNA-C进行下一步的所有实验。

表1 所测目的基因引物序列
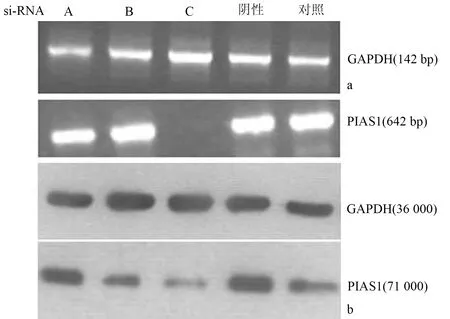
图1 转染细胞PIAS1mRNA(a)和蛋白(b)的表达
二、p38MAPK及P-p38MAPK、TNF-α、IL-1β、IL-6、MMP-9蛋白表达的变化
雨蛙素处理后AR42J细胞p38MAPK、P-p38MAPK、TNF-α、IL-1β、IL-6、MMP-9蛋白表达均较对照组明显增加 (P值均<0.05),其中siRNA+雨蛙素组细胞的表达较其他雨蛙素处理组增加更显著(P值均<0.05,图2,表2)。
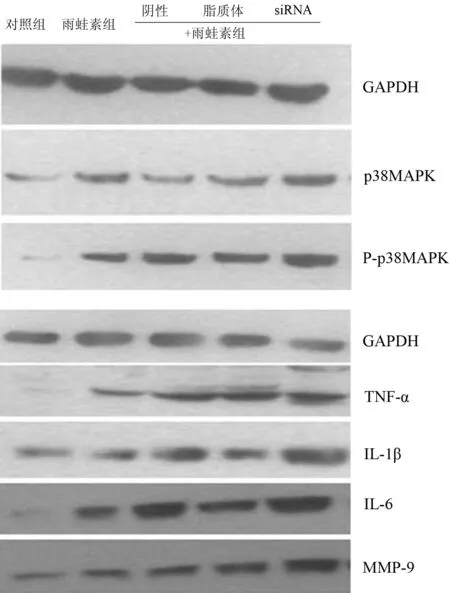
图2各组细胞p38MAPK、P-p38MAPK、TNF-α、IL-1β、IL-6、MMP-9 蛋白的表达(Western blotting)
三、各组细胞TNF-α、IL-1β、IL-6、MMP-9 mRNA表达的变化
雨蛙素处理AR42J细胞后,TNF-α、IL-1β、IL-6、MMP-9 mRNA表达均较对照组明显增加(P值均<0.05),其中siRNA+雨蛙素组的表达又较其他雨蛙素处理组增加更明显(P值均<0.05,图3,表3)。
表2 各组细胞p38MAPK、P-p38MAPK 、TNF-α、IL-1β、IL-6、MMP-9蛋白表达的变化
注:与对照组比较,aP<0.05;与siRNA+雨蛙素组比较,bP<0.05
表3 各组细胞TNF-α、IL-1β、IL-6、MMP-9 mRNA表达的变化
注:与对照组比较,aP<0.05;与siRNA+雨蛙素组比较,bP<0.05
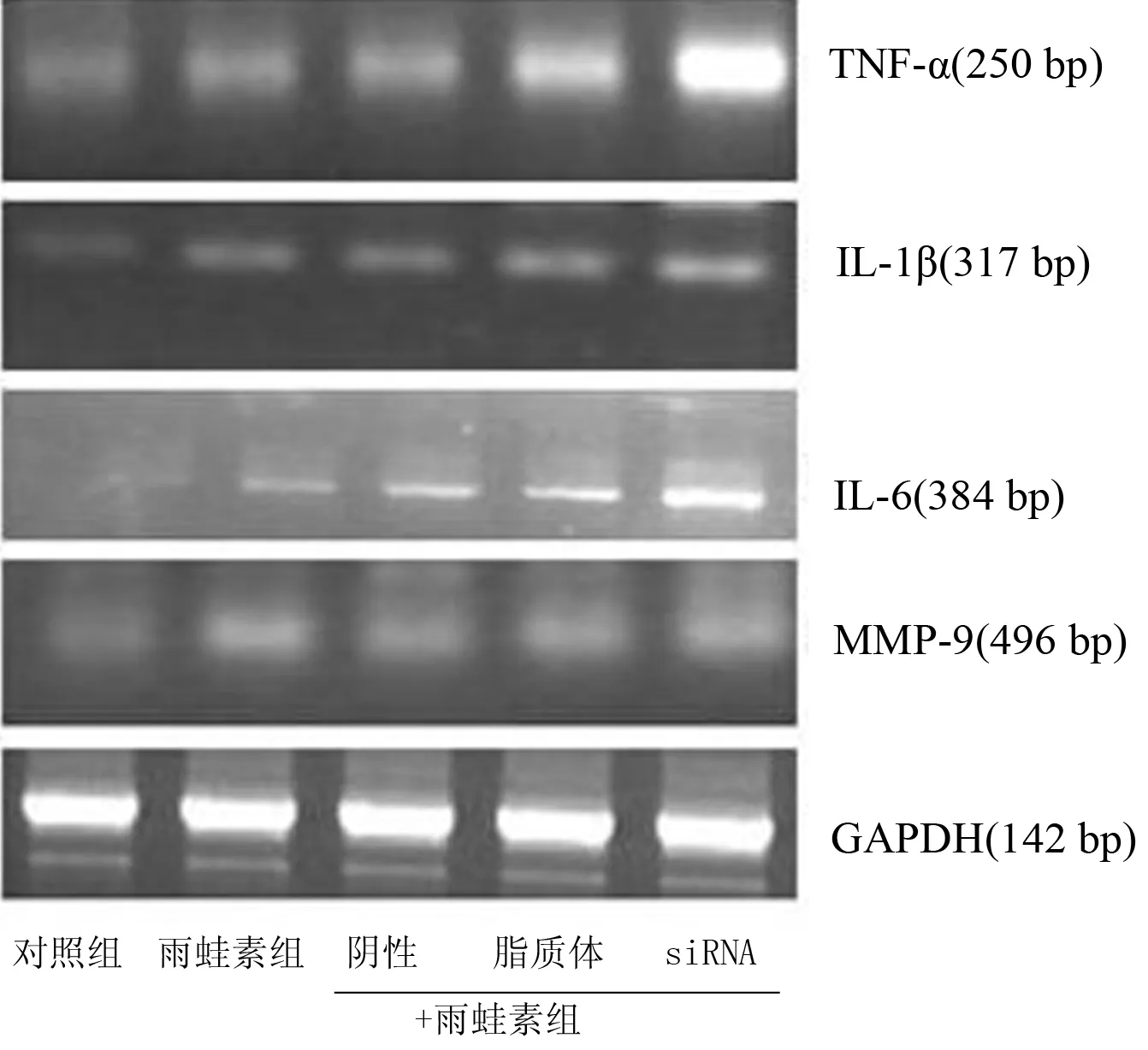
图3各组细胞TNF-α、IL-1β、IL-6、MMP-9 mRNA的表达(RT-PCR)
讨 论
在急性胰腺炎发病机制研究中发现,TNF-α、IL-1β、IL-6、MMP-9等炎症介质参与诱导病程中全身炎症反应综合征及多脏器功能失调的发生,炎症介质过度释放已成为疾病早期患者病死的原因之一[4]。促炎症介质释放的信号通路在这过程中发挥关键作用,其中p38MAPK参与促进疾病的进展,而应用特异性抑制剂可降低急性胰腺炎模型动物死亡率,改善病情[5-6]。我们既往的研究结果显示,p38MAPK信号转导通路介导急性胰腺炎大鼠 TNF-α和IL-1β等炎症介质的释放,阻断p38MAPK信号转导通路可改善急性胰腺炎病情[7]。本结果同样显示雨蛙素诱导的的AR42J细胞体外炎症模型,p38MAPK蛋白活性增加, TNF-α、IL-1β、IL-6、MMP-9表达增高。
现已证实,PIAS1敲除小鼠经脂多糖处理后血清中炎症介质水平增高明显,发育迟缓,围产期死亡增加,因此认为PIAS1敲除小鼠对脂多糖诱导的脓毒血症具有超敏性[8]。此外,Liu等[9]发现在TNF-α或脂多糖刺激下,PIAS1中的Ser 90磷酸化,通过SUMO化作用于IκB激酶α,发挥抑制核因子κB活性,减轻炎症反应。因此,有必要了解PIAS1在急性胰腺炎病程中的作用机制。
本实验采用RNA干扰技术沉默AR42J细胞的PIAS1基因表达后,雨蛙素可明显增加细胞p38MAPK的活性,同时增加TNF-α、IL-1β、IL-6、MMP-9等促炎症介质的转录。其原因可能是PIAS1能抑制炎症介质释放,调控过度炎症反应;而抑制PIAS1基因的表达,则弱化其对炎症反应的调控所致。但具体的作用方式仍需要进一步探索。
[1] Kahyo T,Nishida T,Yasuda H.Involvement of PIAS1 in the sumoylation of tumor suppressor p53.Mol Cell,2001,8:713-718.
[2] Liu B,Yang Y,Chernishof V,et al.Proinflammatory stimuli induce IKKalpha-mediated phosphorylation of PIAS1 to restrict inflammation and immunity.Cell, 2007,129:903-914.
[3] Yu JH,Lim JW,Kim KH,et al.NADPH oxidase and apoptosis in cerulein-stimulated pancreatic acinar AR42J cells.Free Radic Biol Med,2005,39: 590-602.
[4] 袁耀宗,陈平.应加强重症急性胰腺炎的综合治疗.临床消化病杂志,2006,18:19-20.
[5] Greenhalgh CJ,Hilton DJ.Negative regulation of cytokine signaling.J Leukoc Biol,2001,70:348-356.
[6] Yubero S,Ramudo L,Manso MA,et al.The role of redox status on chemokine expression in acute pancreatitis.Biochem Biophys Acta,2009,1792:148-154.
[7] Chen P,Zhang Y,Qiao M,et al.Activated protein C,an anticoagulant polypeptide,ameliorates severe acute pancreatitis via regulation of mitogen-activated protein kinases.J Gastroenterol,2007,42:887-896.
[8] Liu B,Mink S,Wong KA,et al.PIAS1 selectively inhibits interferon-inducible genes and is important in innate immunity.Nat Immunol, 2004, 5: 891-898.
[9] Liu B,Yang R,Wong KA,et al.Negative regulation of NF-kappaB signaling by PIAS1.Mol Cell Biol,2005,25:1113-1123.
2010-02-14)
(本文编辑:屠振兴)
EffectofPIAS1genesilencingoninflammatoryresponseofpancreaticacinarcell
CHENPing,DONGWen-jie,SUNYun-wei,YAOWei-yan,ZHANGYong-ping,QIAOMin-min,YUANYao-zong.
DepartmentofGastroenterology,RuijinHospital,SchoolofMedicine,ShanghaiJiaotongUniversity,Shanghai200025,China
YUANYao-zong,Email:yyz28@medmail.com.cn
ObjectiveTo investigate the effect of protein inhibitor of activated signal transducer and activator of transcription 1 (PIAS1) gene silencing on the inflammatory response of rat pancreatic acinar cell lines AR42J with cerulein stimulation, to study its role in the pathogenesis of acute pancreatitis.MethodsThe siRNA targeting PIASI was designed, synthesized, transfected into AR42J cells by lipofectmine 2000. 24 h later, cerulean was added and cultured for another 24 h. Subsequent AR42J cells with cerulein stimulation were divided into 4 groups: cerulein, liposome, negative-siRNA and PIAS1-siRNA groups. In addition, a group with PBS was as control group. The activity of p38 mitogen-activated protein kinase (p38MAPK) was detected by western blotting. TNF-α, IL-1β, IL-6, matrix metalloproteinase (MMP) 9 expression were analyzed by RT-PCR and western blotting, respectively.ResultsThe expression of p38MAPK in PIAS1-siRNA, negative-siRNA, liposome, cerulein,and control group was 1.93±0.11, 1.22±0.10, 1.30±0.17, 1.32±0.21, 0.12±0.02; while the expression of phosphorylated p38MAPK was 2.10±0.25, 1.36±0.20, 1.26±0.15, 1.23±0.25, 0.58±0.48, the expression in PIAS1-siRNA group was significantly increased when compared with other groups (P<0.05). The levels of TNF-α, IL-1β, IL-6, MMP-9 mRNA were 1.66±0.15,1.66±0.15, 1.90±0.01, 1.56±0.20 in PIAS1-siRNA group, while the expression of protein was 2.06±0.37,2.20±0.34, 1.80±0.10, 1.17±0.05, which was markedly higher than those in other group (P<0.05).ConclusionsPIAS1 gene silencing could enhance p38MAPK activity, and improve inflammatory mediator expression in pancreatic acinar cells with cerulein stimulation.
Pancreas; Protein inhibitor of activated signal transducer and activator of transcription 1; Inflammation; Cytokines
10.3760/cma.j.issn.1674-1935.2010.06.008
200025 上海,上海交通大学医学院附属瑞金医院消化内科
袁耀宗,Email:yyz28@medmail.com.cn
