早期阻断MCP-1对实验性急性坏死性胰腺炎的作用
2010-11-23程礼胡国勇何鸿霖韩伟王兴鹏
程礼 胡国勇 何鸿霖 韩伟 王兴鹏
·论著·
早期阻断MCP-1对实验性急性坏死性胰腺炎的作用
程礼 胡国勇 何鸿霖 韩伟 王兴鹏
目的探讨趋化因子MCP-1对实验性急性坏死性胰腺炎(ANP)及其并发症的影响。方法60只SD大鼠按数字表法分为假手术组、ANP组和MCP-1多抗干预组(干预组),各20只。采用3.5%牛黄胆酸钠制备ANP模型,干预组于制模后0、6 h皮下注射抗MCP-1多抗。观察血清淀粉酶、MCP-1、D-乳酸含量变化;观察胰腺、肺、小肠组织病理改变及MCP-1 mRNA的表达;检测胰腺MCP-1蛋白表达;检测肺、小肠髓过氧化酶(MPO)含量。结果干预组12 h的血淀粉酶、MCP-1、D-乳酸含量分别为(4666±412)U/L、(39.53±8.25)pg/ml 和(6.3±2.2)mg/L,均显著低于ANP组的(9611±363)U/L、(63.42±9.32)pg/ml和(9.3±2.1)mg/L(P值均<0.05);胰腺、肺、小肠组织MCP-1 mRNA表达量分别为0.431±0.009、0.211±0.018和0.442±0.017,均显著低于ANP组的0.624±0.010、0.523±0.019和0.569±0.024(P值均<0.05);胰腺MCP-1蛋白表达评分为2.0±0.1,显著低于ANP组的4.0±0.2(P<0.05);肺、小肠组织MPO含量分别为(11.1±3.0)U/g组织和(19.2±2.0)U/g组织,均与ANP组的(39.2±3.1)U/g组织和(13.1±2.1)U/g组织有显著差异(P值均<0.05)。结论早期阻断MCP-1不但可以减轻急性胰腺炎病理损伤,而且能减轻急性肺损伤和肠屏障的损伤程度。
胰腺炎,急性坏死性; 趋化因子类; MCP-1; 肺损伤; 肠道屏障
单核细胞趋化蛋白-1 (monocyte chemotacite protein-1, MCP-1)属于趋化因子CC亚家族,由67个氨基酸组成。它能促进细胞迁移,诱导整合蛋白活化、细胞呼吸爆发和其他细胞因子的转录,促使多种淋巴因子的释放[1-2]。研究表明,胰腺腺泡细胞能持续合成MCP-1[3]。 Rau等[4]报道,急性胰腺炎(AP)有局部和(或)全身并发症患者的血清和腹水中MCP-l含量明显升高。本实验应用MCP-1多克隆抗体干预急性坏死性胰腺炎(ANP)大鼠,观察其对ANP及其并发症的影响,为临床应用提供实验依据。
材料和方法
一、模型制备及分组
60只SD雄性大鼠,230~250 g,清洁级,上海交通大学附属第一人民医院宝山动物实验室代购。按数字表法随机分为ANP组、MCP-1干预组(干预组)和假手术组,各20只。以胰胆管内逆行注射3.5%牛黄胆酸钠(Sigma公司)1.5 ml/kg体重制备ANP大鼠模型。干预组于造模后0、6 h皮下注射30 mg/ml的兔抗鼠MCP-1多克隆抗体(上海交通大学药学院韩伟实验室提供)100 μl。ANP组注射等体积的对照血清。假手术组轻触胰腺后关腹。各组分别于术后6、12、24、48 h分批处死大鼠,取血并收集胰头部组织、距回肠末端10 cm小肠组织和右中肺组织。
二、检测指标
1.血淀粉酶、D-乳酸及MCP-1检测:淀粉酶由全自动生化仪测定。D-乳酸应用D-乳酸试剂盒(Sigma公司)测定。MCP-1应用ELISA法测定。
2.胰腺、小肠和肺组织病理学检查:各组织置入10%甲醛固定,常规切片、HE染色,并阅片。
3.胰腺组织MCP-1蛋白检测:采用ABC免疫组化方法。试剂盒购自武汉博士德生物科技公司,按说明书操作。以PBS代替一抗作为阴性对照,用已知表达MCP-1的组织作为阳性对照。结果采用半定量方法。以胞质出现棕红色颗粒为阳性,随机选择5个高倍视野计数阳性细胞百分率,<5%计0分,5%~9%1分,10%~19% 2分,20%~50% 3分,>50% 4分,取均值。
4.小肠和肺组织MPO含量检测:各组织分别匀浆后4℃离心,取上清液,采用MPO试剂盒(南京建成生物工程研究所)测定MPO含量。
5.组织MCP-1 mRNA检测:采用RT-PCR方法。应用Trizol试剂提取组织总RNA。引物序列:MCP-1上游:5′-CACGCTTCTGGGCCTGTTG-3′,下游:5′-CAGCCGACTCATTGGGATCATC-3′,扩增片段131 bp;内参18 s RNA上游:5′-GGACCAGAGCGAAAGCATTTGC-3′,下游:5′-CGCCAGTCGGCATCGTITATG-3′,扩增片段115 bp。PCR反应条件: 95℃ 1 min,94°C 3 0 s、55℃(MCP-1)或58℃(18sRNA)30 s、72℃ 30 s, 30个循环,72℃ 7 min。PCR产物经电泳分离,图像分析系统扫描,以MCP-1/18sRNA条带的灰度值比作为MCP-1mRNA相对表达量。
三、统计学处理
结 果
一、胰腺、小肠和肺组织病理改变
假手术组胰腺无显著改变。ANP组6 h见胰腺间质水肿,腺泡小叶结构破坏,局灶凝固性或脂肪坏死,炎细胞浸润增加;12 h胰腺组织片状出血,大片坏死,血管破裂出血,大量中性粒细胞和单核细胞浸润。干预组胰腺损伤较ANP组明显减轻(图1上)。
假手术组肠黏膜绒毛结构完整。ANP组多数绒毛上皮坏死剥落,绒毛顶端间隙显著,中央乳糜管扩张,固有膜中度水肿伴炎症细胞浸润。干预组肠黏膜损伤较ANP组显著减轻(图1中)。
假手术组肺脏无异常变化。ANP组肺泡肿胀,间质水肿、增厚、炎症细胞聚集增多,局灶性肺不张。干预组仅见轻度肺泡肿胀,中性粒细胞浸润减少(图1下)。

图1ANP组(a)和干预组(b)12 h的大鼠胰腺(上)、小肠(中)和肺(下)组织病理改变(HE ×100)
二、大鼠胰腺组织MCP-1蛋白表达的变化
ANP组6、12 h时可见腺泡细胞胞质内强阳性表达,24 h时阳性细胞数减少。干预组见少量腺泡细胞阳性染色(图2)。MCP-1蛋白表达评分见表1。
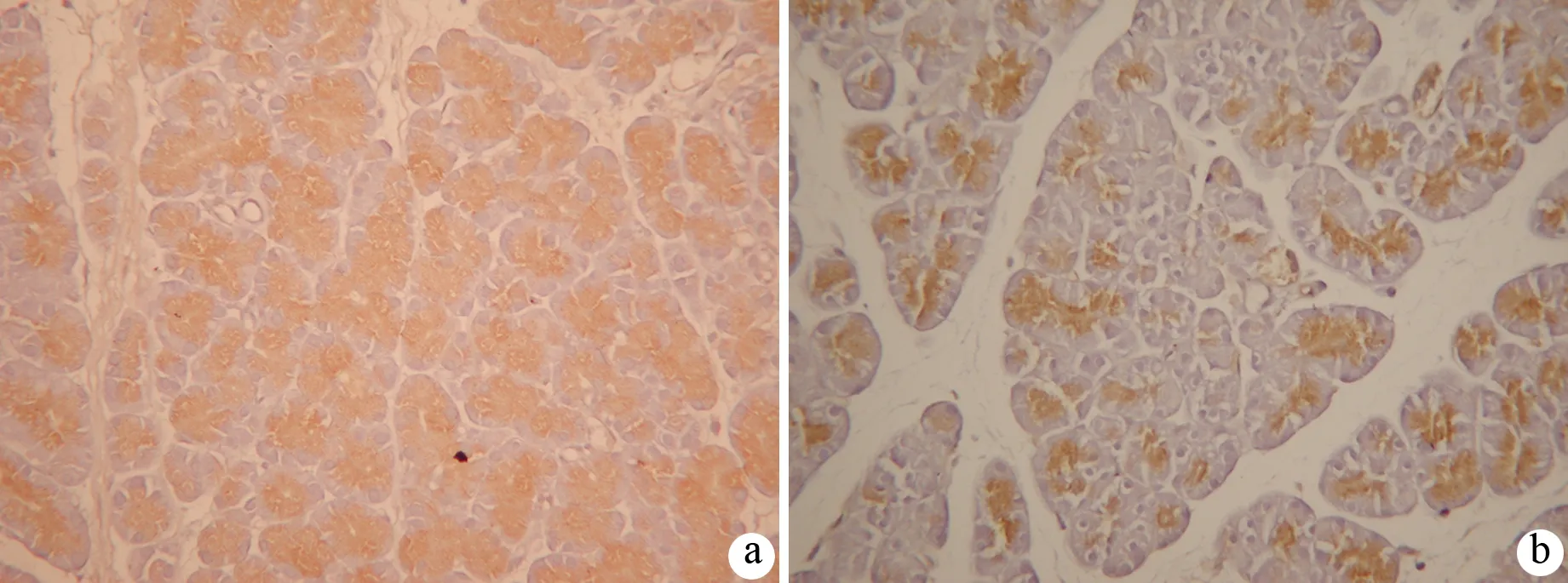
图2ANP组(a)和干预组(b)12 h的胰腺MCP-1表达(免疫组化 ×200)
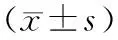
表1 各组大鼠胰腺MCP-1蛋白表达积分
注:与ANP组比较,aP<0.05
三、血淀粉酶、D-乳糖、MCP-1含量的变化
ANP组6 h时血清淀粉酶即升高,12 h达高峰。干预组血清淀粉酶仅12 h时较ANP组显著下降(P<0.05,表2)。
ANP组血D-乳酸水平较对照组显著升高(P<0.05),24 h到达峰值,干预组血D-乳酸水平较ANP组下降,48 h恢复正常(表2)。
ANP组6 h血清MCP-1含量显著升高,12 h到达峰值。干预组各时间点MCP-1含量均较ANP组显著降低(P<0.05,表2)。
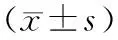
表2 各组大鼠血清淀粉酶、D-乳酸、MCP-1活性变化
注:与ANP组比较,aP<0.05
四、小肠及肺组织MPO含量变化
ANP组及干预组小肠及肺组织MPO含量逐渐上升,12 h或24 h到达峰值,但干预组上升缓慢,均与ANP组有显著差异(P<0.05,表3)。
五、胰腺、小肠及肺组织MCP-1 mRNA表达的变化
假手术组各组织MCP-1 mRNA表达无明显变化。ANP组6 h时,胰腺、肺和小肠MCP-1 mRNA表达均显著升高。干预组的胰腺、肺和小肠MCP-1 mRNA表达均较ANP组显著下降(表4)。

表3 小肠及肺组织MPO含量的变化
注:与ANP组比较,aP<0.05
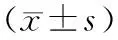
表4 胰腺、小肠、肺组织MCP-1 mRNA表达量的变化
注:与ANP组比较,aP<0.05
讨 论
细胞因子尤其是趋化因子在AP的发病和疾病演变过程中的作用受到人们的日益关注,早期对细胞因子、趋化因子进行干预,防止胰腺炎向重症发展,防治多器官功能衰竭已经成为国内外学者关注的焦点[5]。
本实验结果显示,ANP大鼠MCP-1含量增高,胰腺组织MCP-1 mRNA和蛋白表达增强。抗MCP-1抗体干预后,血清MCP-1含量显著下降,胰腺病理损伤减轻,同时,肺组织损伤明显减轻,肺MPO水平明显下降。提示MCP-1在胰腺炎及其肺并发症的发生、发展中起重要作用。此外,造模后6 h小肠MCP-1 mRNA表达升高,抗MCP-1抗体干预后,小肠组织MPO和血清D-乳酸含量明显下降,肠黏膜病理损害减轻,提示阻断MCP-1对肠屏障有保护作用。
[1] Mélik-Parsadaniantz S, Rostène W.Chemokines and neuromodulation.J Neuroimmunol,2008,198:62-68.
[2] Kalinowska A, Losy J.Investigational C-C chemokine receptor 2 antagonists for the treatment of autoimmune diseases. Expert Opin Investig Drugs,2008,17:1267-1279.
[3] Bhatia M,Brady M,Kang YK. MCP-1 but not CINC synthesis is increased in rat pancreatic acici in response to cerulein hyperstimulation. Am J Physiol Gastrointest Liver Physiol, 2002, 282:G77-G85.
[4] Rau B, Baumgart K, Kruger CM, et al. CC-chemokine activation in acute pancreatitis: enhanced release of monocyte chemoattractant protein-l in patients with local and systemic complications. Intensive Care Med,2003,29:622-629.
[5] DiMagno MJ, DiMagno EP. New advances in acute pancreatitis. Curr Opin Gastroenterol, 2007,23:494-501.
2009-11-23)
(本文编辑:屠振兴)
EffectonblockadeofMCP1inearlycourseofexperimentalacutenecrotizingpancreatitis
CHENGLi,HUGuo-yong,HEHong-lin,HANWei,WANGXing-peng.
DepartmentofGastroenterology,ShanghaiFirstPeople′sHospital,ShanghaiJiaotongUniversity,Shanghai200080,China
WANGXing-peng,Email:xpwcn@public7.sta.net.cn
ObjectiveTo investigate the potential role of MCP-1/CCL2 in experimental acute necrotizing pancreatitis (ANP) and complications.Methods60 SD male rats were randomly divided into 3 groups: sham operation group(n=20),ANP group(n=20)and MCP-1 group(n=20). ANP model was induced by retrograde infusion of 3.5% sodium taurocholate, MCP-1 group
subcutaneous injection of MCP-1 antibody 0 h and 6 h after ANP induction. The serum levels of amylase, MCP-1, D-lactic acid, histological changes and the expression of MCP-1 mRNA of lung, small intestine and pancreas, the expression of MCP-1 protein in pancreas, MPO levels of small intestine MPO were determined.ResultsThe serum levels of amylase, MCP-1, D-lactic acid in MCP-1 group at 12 h were (4666±412)U/L, (39.53±8.25)pg/ml and (6.3±2.2)mg/L, which were significantly lower than those in ANP group [(9611±363)U/L, (63.42±9.32)pg/ml, (9.3±2.1)mg/L,P<0.05)]; the expression of MCP-1 mRNA in pancreas, small intestine and lung were 0.431±0.009, 0.211±0.018 and 0.442±0.017, which were significantly lower than those in ANP group [(0.624±0.010, 0.523±0.019 and 0.569±0.024,P<0.05)]; the expression of MCP-1 protein in pancreas was 2.0±0.1, which was significantly lower than that in ANP group (4.0±0.2,P<0.05). Lung and small intestine MPO were (11.1±3.0)U/g and (19.2±2.0)U/g, which were significantly lower than those in ANP group [(39.2±3.1)U/g and (13.1±2.1)U/g,P<0.05].ConclusionsEarly blockade of MCP-1 not only attenuates the severity of ANP, but also decreases the degree of acute lung injury and intestine barrier dysfunction.
Pancreatitis, acute necrotizing; Chemotactic factors; Monocyte chemotacite protein-1; Lung injuries; Enteral barrier
10.3760/cma.j.issn.1674-1935.2010.05.015
200080 上海,上海交通大学附属第一人民医院消化科(程礼、胡国勇);上海交通大学农学院(何鸿霖);上海交通大学药学院(韩伟);同济大学附属第十人民医院(王兴鹏)
王兴鹏,Email:xpwcn@public7.sta.net.cn
