胰管内乳头状黏液性肿瘤的术前良、恶性与浸润性预测因子
2010-11-23王雷金刚王莉郑建明金震东邹多武张华高蔡全才李兆申
王雷 金刚 王莉 郑建明 金震东 邹多武 张华高 蔡全才 李兆申
·论著·
胰管内乳头状黏液性肿瘤的术前良、恶性与浸润性预测因子
王雷 金刚 王莉 郑建明 金震东 邹多武 张华高 蔡全才 李兆申
目的分析术前预测胰管内乳头状黏液性肿瘤(IPMN)良、恶性与浸润性的因子,及不同病理类型IPMN的手术后生存率。方法回顾性分析长海医院1993年1月至2009年9月间手术切除的78例IPMN病例资料,采用单因素与多因素分析的方法分析病史、临床表现、肝功能、CEA、CA19-9、影像学征象等在术前判断IPMN良、恶性与浸润性的价值,分析患者术后生存率。结果单因素分析结果显示,黄疸、急性胰腺炎、血CA19-9>37 U/ml、AKP、肿块边界不清为恶性及浸润性预测因子;主胰管扩张、分支胰管直径>30 mm、出现壁节结等为恶性预测因子;CEA>6 ng/ml为浸润性预测因子。多因素分析显示,肿块边界不清为恶性及浸润性预测因子;急性胰腺炎为浸润性预测因子。良性IPMN患者的5年生存率为100%;恶性IPMN的2年生存率为78.9%、5年生存率为68.5%,其中浸润性IPMN的2年生存率为64.6%、5年生存率为43.1%。结论肿块边界不清为IPMN恶性预测因子,急性胰腺炎、肿块边界不清是IPMN的浸润性预测因子。
胰腺肿瘤; 乳头状黏液性肿瘤; 诊断; 治疗; 存活率
胰腺导管内乳头状黏液性肿瘤(IPMN)一般经历腺瘤-交界性-原位癌-浸润性癌的过程。恶性IPMN需要手术治疗,而良性IPMN可以随访观察。由于IPMNs患者的发病年龄较大,常伴全身合并症,手术耐受性差,而胰腺切除手术本身可导致内、外分泌功能的下降或完全丧失,所以需要权衡手术的风险和术后患者的生活质量。此外,IPMN进展较胰腺癌慢,预后相对较好。即使恶性IPMN,手术治疗效果也较胰腺癌好,而浸润性IPMN的预后则较差,所以术前判断IPMN良、恶性以及浸润性对指导治疗意义重大。本文回顾我院手术治疗的78例IPMN资料,分析临床特征,探讨其良、恶性及浸润性术前预测因子。
资料与方法
一、资料
收集1993年1月至2009年9月间上海长海医院行手术治疗的78例IPMN患者的病例资料。术前行CT 48例(61.5%);MR或MRCP 35例(44.9%);内镜下逆行胰胆管造影(ERCP) 35例(44.9%);内镜超声(EUS) 31例(39.7%)。术前实验室检查包括血清总蛋白(TP)、白蛋白(Alb)、总胆红素(T-Bil)、ALT、AST、AKP、γ-GTP、淀粉酶、CEA和CA19-9。
病理切片经两位病理专家诊断,并按WHO标准进行分级。本文将交界性肿瘤归为良性病变;恶性病变分为原位癌与浸润性癌。本组良性IPMN 35例(44.9%),包括腺瘤20例和交界性瘤15例;恶性IPMN 43例(55.1%),包括原位癌22例和浸润性癌21例。
出院后采用门诊随访与电话随访两种方式获得随访64例,失访14例,随访率达82.0%。中位随访时间为34.6个月(3~244个月)。
二、统计分析
计数资料采用χ2检验或Fisher确切概率法;计量资料采用独立样本t检验,不符合正态分布的采用非参数检验。单因素分析中P<0.1的指标进行Logistic回归多因素分析,P<0.05有统计学意义。生存曲线采用Kaplan-Meier方法计算。统计软件为SPAW(SPSS18.0)。
结 果
一、人口学特征
长海医院IPMN的手术病例数从1989年至2009年间逐年增加(图1)。患者来自上海市28例,江苏省21例,浙江省13例,安徽省4例,江西省3例,北京市、天津市、辽宁省、河南省、山东省、湖北省、广东省、四川省和宁夏回族自治区各1例。

图1 1989年至2009年间长海医院手术的IPMN患者例数
二、性别、年龄与IPMN组织类型的关系
78例IPMN中男57例,女21例,男女比为2.7∶1。良性IPMN中男28例,女7例,恶性IPMN中男30例,女13例,性别与IPMN良、恶性无关(χ2=0.533,P=0.465);浸润性IPMN中男13例,女8例,非浸润性IPMN中男44例,女13例,性别与IPMN浸润性无关(χ2=10823,P=0.177)。患者年龄从24岁到77岁,平均59岁。良性IPMN患者年龄(59±9)岁,恶性IPMN患者年龄(61±13)岁,年龄与IPMN良、恶性无关(t=-0.830,P=0.409);浸润性IPMN患者年龄(61±16)岁,非浸润性(60±9)岁,年龄与IPMN浸润性无关(t=-0.281,P=0.781)。
三、病史、症状与IPMN组织类型的关系
只有黄疸、急性胰腺炎(AP)与良、恶性及浸润性有关(表1)。
四、实验室指标与IPMN组织类型的关系
AKP在良、恶性组间有差异,ALT、AST、AKP在非浸润组与浸润组间有差异。以CA19-9>37 U/ml为标准,其与IPMN良、恶性组及浸润性均有关;以CEA>6 ng/ml为标准,其与IPMN浸润性有关(表2)。
五、影像学征象与IPMN组织类型的关系
主胰管扩张与IPMN良、恶性有关,但主胰管直径>20 mm在良、恶性组及非浸润性组与浸润性组间不存在差异。在有分支胰管病变的病例中,肿块直径、肿块边界不清、壁结节在良、恶性组中有差异;肿块边界不清在浸润性组与非浸润性组中有差异(表3)。
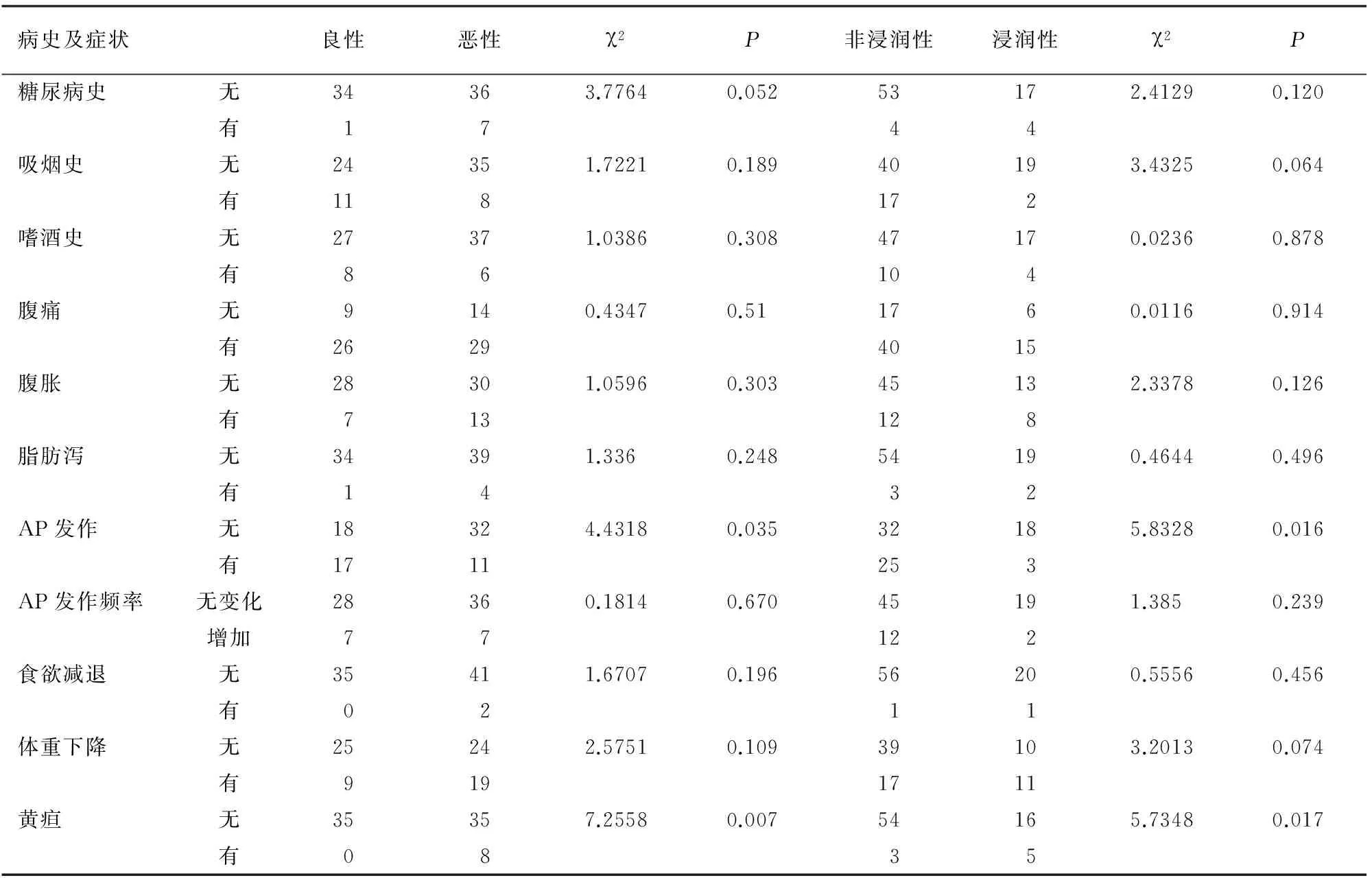
表1 病史、症状与IPMN良、恶性及浸润性的关系(例数)
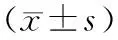
表2 实验室指标与IPMN组织类型的关系
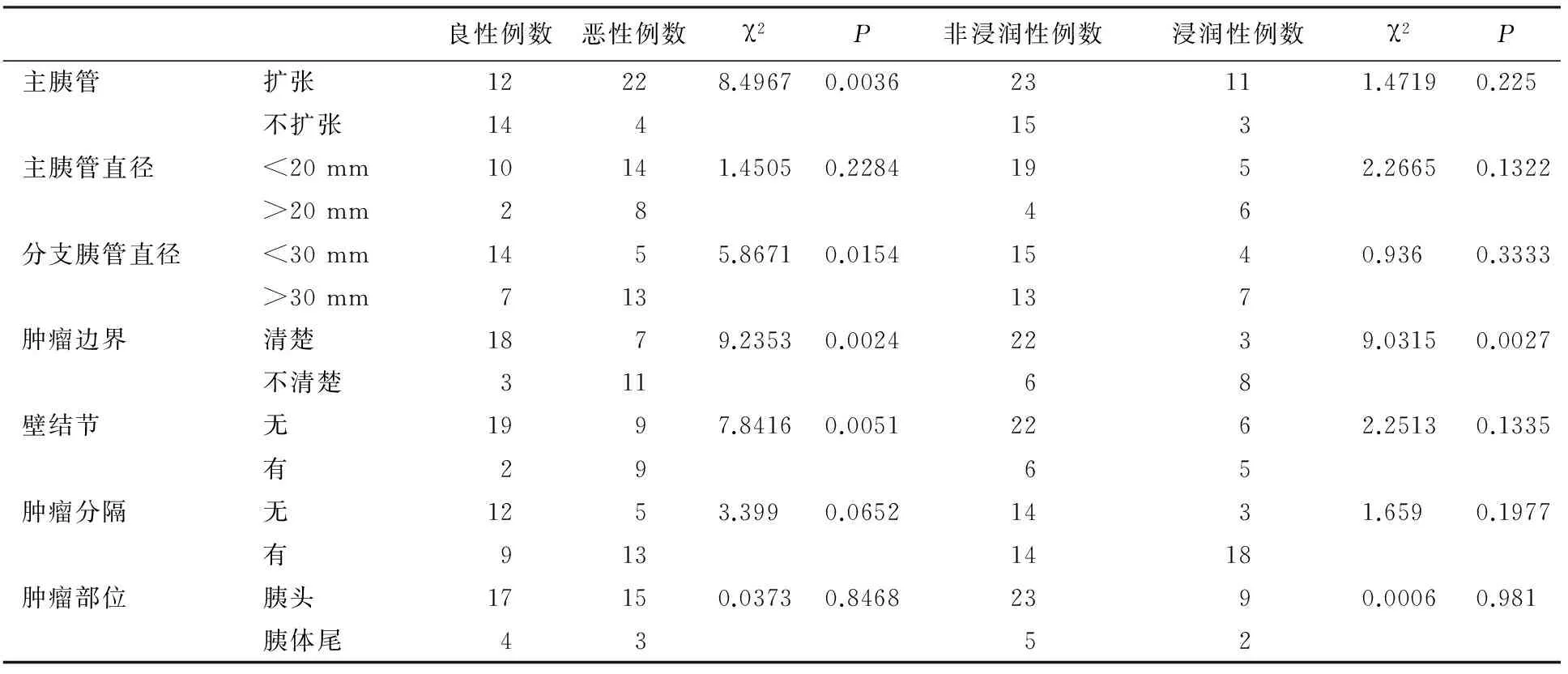
表3 影像学征象与IPMN组织类型的关系
六、多因素分析
只有病灶边界不清是恶性IPMN的预测因子,P=0.0053,点估计值为0.082,95%可信区间0.014,0.476;急性胰腺炎、病灶边界不清是浸润性IPMN的预测因子,P=0.0064、P=0.0231,点估计值为11.426、0.224,95%可信区间为1.987,65.718和0.061,0.814。
七、术后生存曲线
总共病死10例,3例为原位癌,7例为浸润性IPMN;8例于两年之内病死,2例在术后第3年病死。各组织学类型的IPMN患者的生存曲线见图2。良性IPMN患者的5年生存率为100%;恶性IPMN的2年生存率为78.9%、5年生存率为68.5%,其中浸润性IPMN的2年生存率64.6%、5年生存率为43.1%。患者生存率在良恶性间、浸润性与非浸润性间均存在差异。
讨 论
IPMN是一种特殊类型的胰腺肿瘤,自从1982年后关于IPMN的报道逐渐增多。通常认为IPMN的预后较好。有报道,非浸润性IPMN完全切除后的5年生存率达85%~100%,明显优于浸润性的24%~65%[1-3]。因此,术前对良、恶性与浸润性的判断至关重要。
本组结果显示,IPMN以男性略占多数,与日本韩国的文献报道相近[1, 4-6]。但美国报道的男女比例为1∶1[7-9],提示IPMN男女发病率在亚洲与欧美地区存在差异。

图2 不同病理类型IPMN生存函数
本组患者年龄在不同组织类型IPMN间没有差异,与Murakami等[10]的结果一致。但本组良性肿瘤组患者的平均年龄为56岁,较交界性瘤、原位癌、浸润性癌60~61岁的平均年龄要轻,似乎支持IPMN从良性进展到恶性需要4~6年时间的观点[11]。
本组烟酒史在良、恶性与浸润性、非浸润性间无统计学差异,与国外文献报道相一致[12],这与胰腺导管腺癌容易在嗜烟酒人群中发生不同,提示IPMN与胰腺导管腺癌的易感因素不同。
许多IPMN病例以AP发病。本组结果显示,AP是恶性与浸润性IPMN的预测因子,与国外报道一致[13-14]。但AP发作频率的增加在恶性与浸润性IPMN中并无差异,提示AP频繁发作不代表肿瘤的进展。也有文献报道[8, 15-16],AP与IPMN组织类型无关,这需要更多的病例数证实。
本组实验室指标中AKP及AST是浸润性IPMN的预测因子,与Wiesenauer等[17]的报道一致;但血总胆红素指标却不是浸润性IPMN的预测因子,与文献报道不同。究其原因可能是由于黏液梗阻减轻或IPMN病灶坏死脱落导致胆胰管压力降低导致总胆红素下降所致[15,17]。提示ALT、AST、AKP这些指标比总胆红素能更加准确地预测病变的性质。
IPMN分为主胰管型(MD)、分支胰管型(BD)和混合型(CO)三种。有报道,侵犯主胰管(MD+CO)的比不侵犯主胰管的(BD)预后较差[18]。Lubezky等[19]报道,病灶边界不清是浸润性IPMN的预测因子。本组结果显示,主胰管扩张与IPMN良、恶性有关,但主胰管直径是否超过20mm对良、恶性与浸润性均不具有判断价值;而在分支胰管扩张型中,分支胰管直径>30 mm、病灶边界不清、壁结节均是恶性预测因子,更加细化了影像学的观察指标。多因素分析亦提示AP是浸润性IPMN的预测因子,这可能与浸润性病灶体积更大、更容易发生胰管梗阻有关。
[1] Jang JY,Kim SW,Ahn YJ,et al.Multicenter analysis of clinicopathologic features of intraductal papillary mucinous tumor of the pancreas:is it possible to predict the malignancy before surgery?Ann Surg Oncol,2005,12:124-132.
[2] Nakagohri T,Kinoshita T,Konishi M,et al.Surgical outcome of intraductal papillary mucinous neoplasms of the pancreas.Ann Surg Oncol,2007,14:3174-3180.
[3] Niedergethmann M,Grutzmann R,Hildenbrand R,et al.Outcome of invasive and noninvasive intraductal papillary-mucinous neoplasms of the pancreas (IPMN):a 10-year experience.World J Surg,2008,32:2253-2260.
[4] Nara S,Onaya H,Hiraoka N,et al.Preoperative evaluation of invasive and noninvasive intraductal papillary-mucinous neoplasms of the pancreas:clinical,radiological,and pathological analysis of 123 cases.Pancreas,2009,38:8-16.
[5] Abe T,Fukushima N,Brune K,et al.Genome-wide allelotypes of familial pancreatic adenocarcinomas and familial and sporadic intraductal papillary mucinous neoplasms.Clin Cancer Res,2007,13:6019-6025.
[6] Shin SH,Han DJ,Park KT,et al.Validating a simple scoring system to predict malignancy and invasiveness of intraductal papillary mucinous neoplasms of the pancreas.World J Surg,2010,34:776-783.
[7] D′Angelica M,Brennan MF,Suriawinata AA,et al.Intraductal papillary mucinous neoplasms of the pancreas:an analysis of clinicopathologic features and outcome.Ann Surg,2004,239:400-408.
[8] Sohn TA,Yeo CJ,Cameron JL,et al.Intraductal papillary mucinous neoplasms of the pancreas:an updated experience.Ann Surg,2004,239:788-797.
[9] Salvia R,Fernandez-del Castillo C,Bassi C,et al.Main-duct intraductal papillary mucinous neoplasms of the pancreas:clinical predictors of malignancy and long-term survival following resection.Ann Surg,2004,239:678-685.
[10] Murakami Y,Uemura K,Hayashidani Y,et al.Predictive factors of malignant or invasive intraductal papillary-mucinous neoplasms of the pancreas.J Gastrointest Surg,2007,11:338-344.
[11] Levy P,Jouannaud V,O′Toole D,et al.Natural history of intraductal papillary mucinous tumors of the pancreas:actuarial risk of malignancy.Clin Gastroenterol Hepatol,2006,4:460-468.
[12] Nagai K,Doi R,Kida A,et al.Intraductal papillary mucinous neoplasms of the pancreas:clinicopathologic characteristics and long-term follow-up after resection.World J Surg,2008,32:271-278.
[13] Sohn TA,Yeo CJ,Cameron JL,et al.Intraductal papillary mucinous neoplasms of the pancreas:an increasingly recognized clinicopathologic entity.Ann Surg,2001,234:313-321.
[14] Kim SC,Park KT,Lee YJ,et al.Intraductal papillary mucinous neoplasm of the pancreas:clinical characteristics and treatment outcomes of 118 consecutive patients from a single center.J Hepatobiliary Pancreat Surg,2008,15:183-188.
[15] Sugiyama M,Izumisato Y,Abe N,et al.Predictive factors for malignancy in intraductal papillary-mucinous tumours of the pancreas.Br J Surg,2003,90:1244-1249.
[16] Fujino Y,Matsumoto I,Ueda T,et al.Proposed new score predicting malignancy of intraductal papillary mucinous neoplasms of the pancreas.Am J Surg,2007,194:304-307.
[17] Wiesenauer CA,Schmidt CM,Cummings OW,et al.Preoperative predictors of malignancy in pancreatic intraductal papillary mucinous neoplasms.Arch Surg,2003,138:610-617.
[18] Mimura T,Masuda A,Matsumoto I, et al.Predictors of malignant intraductal papillary mucinous neoplasm of the pancreas.J Clin Gastroenterol,2010,44:e224-e229.
[19] Lubezky N,Ben-Haim M,Nakache R,et al.Clinical presentation can predict disease course in patients with intraductal papillary mucinous neoplasm of the pancreas. World J Surg,2010,34:126-132.
2010-04-12)
(本文编辑:吕芳萍)
Preoperativepredictorsofmalignancyandinvasivecarcinomainintraductalpapillarymucinousneoplasms
WANGLei,JINGang,WANGLi,ZHENGJian-ming,JINZhen-dong,ZOUDuo-wu,ZHANGHua-gao,CAIQuan-cai,LIZhao-shen.
DepartmentofGastroenterology,ChanghaiHospital,TheSecondMilitaryMedicalUniversity,Shanghai200433,China
LIZhao-shen,Email:zhsli@81890.net
ObjectiveTo investigate the predictive factors for malignancy and invasive carcinoma of IPMN, and the survival rates of different pathological type of IPMN were compared.MethodsSeventy-eight patients with IPMN admitted to Changhai Hospital from January 1993 to September 2009, who underwent surgery with histological evidence were retrospectively analyzed. The univariate and multivariate analysis of potential predictive factors, including medical history, clinical presentations, liver function, CEA, CA19-9, and imaging findings was conducted to identify the predictive factors for malignancy and invasive carcinoma of IPMN.ResultsUnivariate analysis identified jaundice, acute pancreatitis history, CA19-9 Level>37U/ml, AKP, unclear border of tumour as independent predictive factors for malignancy and invesiveness, main pancreatic duct dilation, branch pancreatic duct diameter >30 mm, presence of mural modules were identified as malignancy predictor. CEA>6 ng/ml was identified as invasive carcinoma predictor. Multivariate analysis identified one independent predictive factor for malignancy or invasive carcinoma: unclear border of tumour. Another factor of invasive IPMN was acute pancreatitis. The 5 year survival rate for benign IPMN was 100%, while 2 year survival rate for malignant IPMN was 78.9%, 5 year survival rate was 68.5%. The 2 year survival rate for invasive IPMN was 64.6%, 5 year survival rate was 43.1%.ConclusionsUnclear border of tumour was predictive factors for malignancy; acute pancreatitis and unclear border of tumour were predictive factors for invasive carcinoma.
Pancreatic neoplasms; Intraductal papillary mucinous neoplasm; Diagnosis; Therapy; Survive rate
10.3760/cma.j.issn.1674-1935.2010.05.006
200433 上海,第二军医大学长海医院消化内科
李兆申,Email:zhsli@81890.net
