胰腺细针穿刺活检组织K-ras突变检测的诊断价值
2010-11-23王小玮高军任艳顾俊骏金震东杜奕奇湛先保陈洁黄浩杰李兆申
王小玮 高军 任艳 顾俊骏 金震东 杜奕奇 湛先保 陈洁 黄浩杰 李兆申
·论著·
胰腺细针穿刺活检组织K-ras突变检测的诊断价值
王小玮 高军 任艳 顾俊骏 金震东 杜奕奇 湛先保 陈洁 黄浩杰 李兆申
目的检测内镜超声引导下细针穿刺穿刺物中K-ras基因的突变,探讨其对胰腺癌早期诊断的价值。方法收集27例胰腺癌、9例其他恶性肿瘤及14例良性胰腺占位患者的细针穿刺物,应用肽核酸(PNA)钳制PCR法检测K-ras突变。结果胰腺癌患者K-ras突变阳性率为88.9%,其他恶性肿瘤为44.4%,良性胰腺占位为35.7%,胰腺癌与其他两种病变差异显著(P=0.013,P=0.001)。胰腺癌与其他恶性肿瘤比较,K-ras基因突变的敏感性、特异性、阳性预测率、阴性预测率、准确率分别为88.9%、55.6%、85.7%、62.5%、80.6%,差异显著(P=0.013);与良性胰腺占位病变比较,分别为88.9%、64.3%、82.8%、75.0%、80.5%,差异亦显著(P=0.001)。联合穿刺物细胞学检查和K-ras基因突变检测,胰腺癌的阳性率高达96.3%。结论胰腺组织穿刺物的K-ras基因突变检测可提高胰腺癌诊断的阳性率。
胰腺肿瘤; K-ras基因; 肽核酸类; 基因诊断
超声内镜引导下细针穿刺术(EUS-FNA)可简单、安全地获得胰腺组织的细胞标本。但由于不易操作等多个因素,使EUS-FNA对胰腺癌诊断的敏感性、特异性及准确性存在较大差异[1-2]。 K-ras基因突变与胰腺癌的发生、发展密切相关[3],在手术切除的胰腺癌组织中突变率可达95%[4],且几乎都集中于第1外显子的12密码子,以CGT、GTT和GAT三种突变类型最为常见[5]。本文建立一种新的K-ras基因突变的肽核酸(PNA)钳制PCR检测方法,提高了检测灵敏度,现报道如下。
资料与方法
一、一般资料
收集我院2008年9月至2009年6月对胰腺及邻近脏器占位性病变进行EUS-FNA检查的50例患者,其中男26例,女24例,平均年龄59岁。所有患者均检测血CA19-9和CEA,并行其他影像学检查。最后确诊胰腺癌27例,其他恶性肿瘤9例(肝癌1例,恶性胃间质瘤3例,后腹膜腺癌2例,壶腹癌3例),良性胰腺占位14例(导管内乳头状黏液性肿瘤5例,胰腺囊腺瘤3例,非慢性胰腺炎的炎性改变4例,慢性胰腺炎2例)。
二、 FNA标本的收集及DNA的抽提
EUS-FNA由专职医师完成。当EUS在胃内清楚显示病灶后,按与病灶最近的距离确定穿刺路径。用探头靠近并紧压病灶相对应的胃壁,经活检钳道插入穿刺套针,用19G或22G穿刺针刺破胃壁至病灶内,在10 ml注射器负压下对肿块来回抽吸5~10次。细针穿刺所得大部分组织置于10%多聚甲醛中固定,常规行病理检查,剩余组织置液氮中保存备用。未能获得组织时,用0.5~1 ml的生理盐水将穿刺物冲入20 ml的液积溶液(安必平,中国),混匀后取5 ml,离心,沉淀置-80℃冰箱冻存备用。剩余液积溶液离心,取沉淀涂片行细胞学检查。术后给予患者口服抗生素,无1例出现穿刺并发症。
采用QIAamp DNA Micro Kit试剂盒(德国QIAGEN公司)抽提冻存组织或液积沉淀细胞的DNA。应用分光光度计测A260和A280值,计算DNA浓度,-20℃冰箱中冻存备用。
三、K-ras基因突变检测
采用肽核酸钳制(PNA)PCR方法。由韩国PNAGENE公司设计、合成与野生型K-ras基因12、13密码子完全匹配的PNA。根据人K-ras基因序列用Primer5.0软件自行设计引物序列,P1:ATAGTGTATTAACCTTATGTGTGA,P2:CCTTATGTGTGACATGTTCTAATATAGTC, P3:TTAGCTGTATCGTCAAGGCACTC,由Invitrogen公司合成。第一轮行钳制PCR,反应体系中含引物P1、P3和PNA。扩增条件:95℃ 3 min,94℃ 20 s、70℃PNA结合15 s、58℃ 20 s、72℃ 30 s,40个循环,最后72℃ 5 min。取第一轮产物作为模板进行第二轮PCR,反应体系中含引物P3和P2。扩增条件:95℃ 3 min,94℃ 20 s、58℃ 20 s、72℃ 30 s, 35个循环,最后72℃ 5 min。扩增产物经琼脂糖凝胶电泳、自动成像系统摄影。并将扩增条带送Invitrogen公司测序。
四、统计学方法
采用统计软件SPSS16.0进行数据分析,采用Fisher′s Exact Test方法检验各自率之间的差异,显著性差异水准为P<0.05。
结 果
一、细针穿刺物K-ras基因突变率
胰腺癌的K-ras突变阳性率为88.9%(24/27),其中GGT→GAT 12例,GGT→GTT 10例,GGT→GCT 1例,GGT→CGT 1例,测序图见图1。其他恶性肿瘤的突变阳性率为44.4%(4/9),其中GGT→GAT 2例,GGT→GTT 1例,GGT→GCT 1例。良性胰腺占位的突变阳性率为35.7%(5/14),GGT→GAT 3例,GGT→GTT 2例。
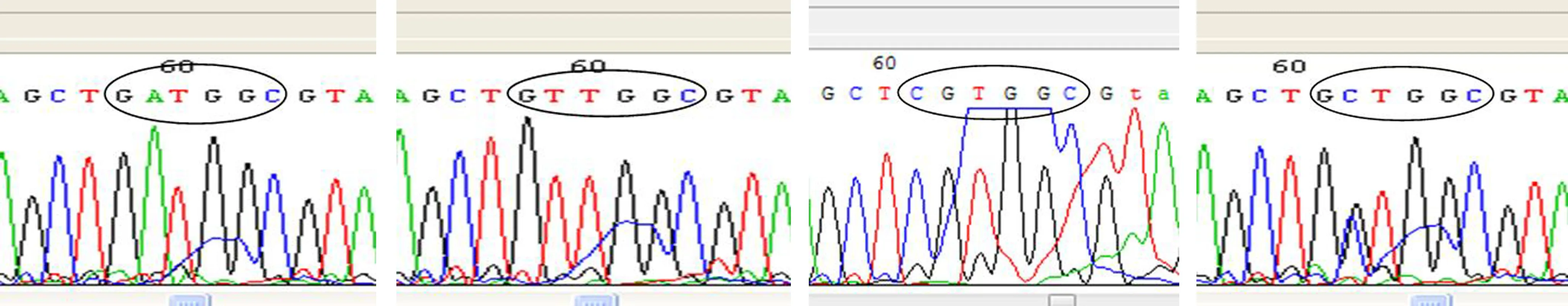
图1 检测到的4种代表性K-ras 12密码子突变的测序图
二、K-ras突变对胰腺占位的诊断价值
本组胰腺癌、其他恶性肿瘤、良性胰腺占位患者的CA19-9的阳性率(≥37 U/L)分别为55.6%(15/27)、22.2%(2/9)、28.6%(4/14),CEA阳性率(≥10 U/L)分别为25.9%(7/27)、44.4%(4/9)、7.1%(1/14);其他影像学检查诊断准确率分别为55.6%(15/27)、22.2%(2/9)、28.6%(4/14);FNA穿刺物组织细胞学诊断阳性率分别为59.3%(16/27)、22.2%(2/9)、0。联合细胞学检查和K-ras基因突变检测,胰腺癌的阳性率高达96.3%。胰腺癌与其他恶性肿瘤比较,穿刺物K-ras突变的敏感性、特异性、阳性预测率、阴性预测率、准确率分别为88.9%、55.6%、85.7%、62.5%、80.6%,相差显著(P=0.013);与良性胰腺占位病变比较,分别为88.9%、64.3%、82.8%、75.0%、80.5%,差异亦显著(P=0.001)。而其他恶性肿瘤与良性胰腺占位的K-ras突变无显著差异(P=1.00)。
讨 论
由于胰腺癌缺乏特异性症状,约有85%的患者失去手术机会,故如何提高胰腺癌的诊断水平成为改善胰腺癌患者预后的主要环节。肿瘤相关基因的分子生物学检测与内镜影像学检查联合诊断方法可能是目前发现早期胰腺癌的有效方法之一。既往报道[6],胰腺癌K-ras基因突变率在75%~95%,癌前病变PanIN-1a、1b及2-3标本中K-ras的突变率分别为 36%、44%和87%,所以检测胰腺组织K-ras突变有助于早期胰腺癌的发现。
检测K-ras突变的方法较多,对于EUS-FNA穿刺物主要采用PCR-SSCP和PCR-RELP方法。PCR-RELP仅可检测12密码子的突变,需要两次PCR和两次酶切,步骤繁琐[7-8];PCR-SSCP对于混有大量正常组织的检测标本易出现假阴性[9]。本研究采用肽核酸钳制PCR技术[10],利用PNA与完全匹配的DNA结合的稳定性远远高于不能完全匹配的DNA这一特性[11],在第一轮PCR引物退火之前引入PNA,使PNA与野生型模板结合,从而在退火期和延伸期抑制野生型模板的扩增。通过设计套式扩增引物,在第二轮PCR时将第一轮扩增产物有效放大,且同时检测K-ras12、13密码子的突变。应用该法,本组胰腺癌的检测灵敏度为88.9%,明显高于以往文献报道,联合组织细胞学结果,灵敏度高达96.3%。在EUS-FNA活检物检测K-ras突变对以下患者具有潜在的诊断价值:(1)当找到可疑细胞时,K-ras突变阳性几乎可确定为恶性肿瘤; (2)当细胞学样品不足或未找到恶性细胞时,K-ras突变阳性可高度提示恶性肿瘤的诊断,但必须联合其他临床检测进行综合诊断。
本组2例未获得影像学、血清学或组织细胞学的明确诊断,通过检测穿刺物的K-ras突变而明确诊断,提高了胰腺癌的诊断率。
[1] Harewood GC,Wiersema MJ.Endosonography-guided fine needle aspiration biopsy in the evaluation of pancreatic masses.Am J Gastroenterol,2002,97:1386-1391.
[2] Ylagan LR,Edmundowicz S,Kasal K,et al.Endoscopic ultrasound guided fine-needle aspiration cytology of pancreatic carcinoma:a 3-year experience and review of the literature.Cancer,2002,96:362-369.
[3] Hruban RH,Wilentz RE,Kern SE.Genetic progression in the pancreatic ducts.Am J Pathol,2000,156:1821-1825.
[4] Almoguera C,Shibata D,Forrester K,et al.Most human carcinomas of the exocrine pancreas contain mutant c-K-ras genes.Cell,1988,53:549-554.
[5] Mizumoto K,Tanaka M.Genetic diagnosis of pancreatic cancer.J Hepato-biliary-pancreat Surg,2002,9:39-44.
[6] Kimura W,Zhao B,Futakawa N,et al.Significance of K-ras codon 12 point mutation in pancreatic juice in the diagnosis of carcinoma of the pancreas. Hepatogastroenterology,1999,46:532-539.
[7] Pellise M,Castells A,Gines A,et al.Clinical usefulness of KRAS mutational analysis in the diagnosis of pancreatic adenocarcinoma by means of endosonography-guided fine-needle aspiration biopsy.Aliment Pharmacol Ther,2003,17:1299-1307.
[8] Tada M,Komatsu Y,Kawabe T,et al.Quantitative analysis of K-ras gene mutation in pancreatic tissue obtained by endoscopic ultrasonography-guided fine needle aspiration: clinical utility for diagnosis of pancreatic tumor.Am J Gastroenterol,2002,97:2263-2270.
[9] Takahashi K,Yamao K,Okubo K,et al.Differential diagnosis of pancreatic cancer and focal pancreatitis by using EUS-guided FNA.Gastrointest Endosc,2005,61:76-79.
[10] Taback B,Bilchik AJ,Saha S,et al.Peptide nucleic acid clamp PCR: a novel K-ras mutation detection assay for colorectal cancer micrometastases in lymph nodes.Int J Cancer,2004,111:409-414.
[11] Brandstetter H,Kim JS,Groll M,et al.Crystal structure of the tricorn protease reveals a protein disassembly line.Nature,2001,414:466-470.
2009-10-23)
(本文编辑:吕芳萍)
ThevalueoftheK-rasmutationsinFNAsamplesofpancreasonthediagnosisofpancreaticcancer
WANGXiao-wei,GAOJun,RENYan,GUJun-jun,JINZhen-dong,DUYi-qi,ZHANXian-bao,CHENJie,HUANGHao-jie,LIZhao-shen.
DepartmentofGastroenterology,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai200433,China
LIZhao-shen,Email:lizhaoshen111@yahoo.com.cn
ObjectiveTo investigate the diagnostic value of the K-ras mutations in FNA samples for early detection of pancreatic cancer.MethodsFNA samples of 27 patients with pancreatic cancers, 9 patients with other malignant tumors and 14 patients with non malignant pancreatic mass (NMPM) were collected. DNA was extracted, and K-ras gene was amplified through PNA-mediated PCR clamping, the products were sequenced to determine the mutation type.ResultsThe positive rate of K-ras mutations in pancreatic cancers, other malignant tumors and NMPM were 88.9%, 44.4%, 35.7%. There was significant difference in K-ras gene mutations in FNA samples between pancreatic cancer and other malignant tumors (P=0.013) and NMPM (P=0.001). The sensitivity, specificity, positive predictive value, negative predictive value, accuracy of K-ras mutations in FNA samples of pancreatic cancers were 88.9%, 55.6%, 85.7%, 62.5%, 80.6% when compared with other malignant tumors, and the difference between the two groups was significant (P=0.013);Those were 88.9%, 64.3%, 82.8%, 75.0%, 80.5% when compared with NMPM, and the difference between the two groups was significant (P=0.001). When cytology of FNA samples and K-ras mutations was combined, the positive rate of pancreatic cancer was up to 96.3%.ConclusionsThe detection of K-ras mutations in EUS-FNA samples helped improve the positive diagnostic rate of pancreatic cancer.
Pancreatic neoplasms; K-ras gene; Peptide nucleic acids; Gene diagnosis
10.3760/cma.j.issn.1674-1935.2010.05.008
国家自然科学基金(2006BAI02A12)
200433 上海,第二军医大学长海医院消化内科
李兆申,Email:lizhaoshen111@yahoo.com.cn
