一氧化氮在顺铂耳、肾毒性中的作用△
2010-11-22河北医科大学第二医院麻醉科石家庄050000
河北医科大学第二医院麻醉科(石家庄 050000)
戚 翔 刘砚星* 路 虹# 张惠军 王 娜* 连易水*
顺氯胺铂(Cis-platium diamminedichloride,DDP或 PDD)是铂的无机螯合物,简称顺铂(Cis platin),主要用于治疗泌尿生殖系的膀胱、睾丸、卵巢等处的恶性肿瘤及头颈部癌。其主要的毒副作用有消化道反应、内耳中毒、肾脏损害及骨髓抑制,其中以内耳中毒和肾脏损害最为严重。
一氧化氮(Nitric oxide,NO)是 L-精氨酸在一氧化氮合酶(Nitric oxide synthase,NOS)的催化下生成的。NOS分为两种亚型:结构型(cNOS)和诱导型(iNOS),前者催化生成的NO量少,主要在生理情况下起作用,例如介导内皮细胞舒张和传导神经信息。而iNOS催化下生成的NO量多,主要在病理条件下起作用,造成组织细胞的损害[1~4]。NO的病理损伤作用可能是因为它能和氧自由基反应,生成氮的过氧化物,后者的氧化性很强,通过阻滞线粒体的呼吸等作用,发挥其细胞毒性。
本研究通过建立顺铂中毒的动物模型,应用免疫组织化学的研究方法观察内耳及肾脏中iNOS表达活性的改变,探讨顺铂的耳毒性、肾毒性的机制,为临床工作中预防和治疗其毒副作用提供理论依据。
材料与方法
1 材料选择 选择成熟健康、耳廓反应灵敏的白毛红目豚鼠 20只,体重为350~450g,雌雄不限,随机平均分为两组,分别为实验组和对照组。
2 方 法 实验组的豚鼠连续 5d腹腔注射顺2mg/(kg· d),用生理盐水稀释成 0.5ml;而对照组的豚鼠连续 5 d腹腔注射生理盐水 0.5 ml/(kg· d)。
实验过程中严密观察豚鼠的一般情况变化,对照组与实验组于第 6天,以断头法处死动物,快速取出听泡,暴露耳蜗,将其浸于4% 多聚甲醛中固定,并在解剖显微镜下取出镫骨,挑破卵圆窗、圆窗,蜗顶钻孔,用吸管以固定液缓慢灌流耳蜗,每个标本灌流5遍。同时快速取出肾脏,浸于4% 多聚甲醛中。次日取出耳蜗标本,以0.01 M PBS液清洗,置于10%EDTA中脱钙10 d,PBS液清洗,石蜡包埋,平行蜗轴切片,一部分切片HE染色,另一部分脱蜡至水,按顺序滴加复合消化液、正常山羊血清封闭液、一抗(兔抗鼠iNOS的抗体)、二抗(生物素化山羊抗兔 IgG)、SABC(链酶亲和素-生物素-过氧化物酶复合物),DAB显色。蒸馏水洗涤,苏木素轻度复染。脱水,透明,封片,显微镜观察。肾脏标本亦于次日取出,PBS液清洗,石蜡包埋,切片,行免疫组化流程处理(同耳蜗标本)。
结 果
对照组豚鼠在给药前后,无异常表现。实验组动物在给药期间均出现活动减少,食欲减退,毛发疏松脱落,体重减轻,耳廓反应迟钝。
对照组的耳蜗各转螺旋器的细胞结构正常,iNOS免疫组化示,内、外毛细胞的胞浆中未见棕黄色颗粒,呈阴性染色(图1)。实验组的耳蜗螺旋器中,外毛细胞明显变性,轮廓不清,细胞核融合消失;内毛细胞呈退行性变。支持细胞轻度变性。各转耳蜗螺旋器的外毛细胞和内毛细胞的胞浆中可见棕黄色颗粒,呈iNOS免疫组化阳性染色(图2,3)。支持细胞的染色不一致,盖膜非特异性着色。
对照组的肾脏的皮质、髓质细胞结构正常,肾小球、近曲小管、远曲小管及间质的细胞胞浆中均未见棕黄色颗粒,呈iNOS免疫组化阴性染色(图4,5)。实验组的肾脏皮质的近曲小管上皮细胞的胞浆中可见棕黄色颗粒,髓质的远曲小管上皮细胞的胞浆中可见棕黄色颗粒,呈免疫组化阳性染色(图6),肾小球及间质的细胞胞浆中未见棕黄色颗粒。
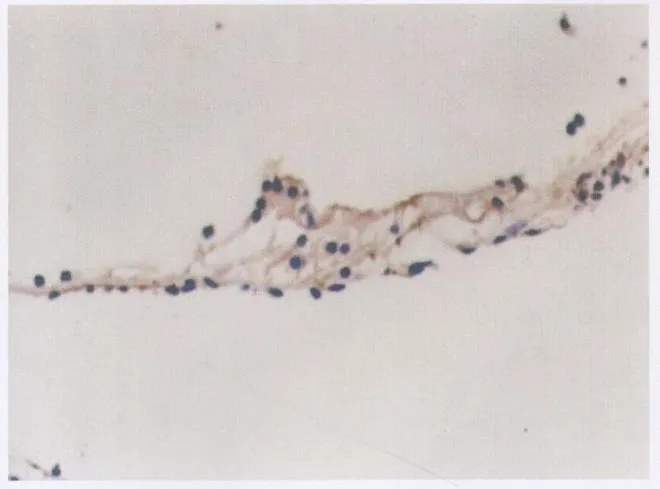
图1 对照组耳蜗螺旋器呈阴性染色(×400)

图2,3 实验组耳蜗螺旋器呈阳性染色(×400)

图4,5 对照组肾小球、肾小管呈阴性染色(×200)

图6,7 实验组肾近曲小管、远曲小管上皮细胞呈阳性染色(×400)
讨 论
豚鼠耳蜗螺旋器的免疫组化显示,对照组的螺旋器呈iNOS阴性染色,而实验组的螺旋器,内毛细胞和外毛细胞呈iNOS阳性染色。豚鼠肾脏的免疫组化显示,对照组的皮质、髓质各细胞呈iNOS阴性染色,而实验组的肾脏,近曲小管、远曲小管的上皮细胞呈iNOS阳性染色。以往研究表明,在生理情况下,内耳和肾脏的iNOS不表现生物活性,NO的量少,主要发挥其生理调节作用,如通过影响内耳血管纹和外毛细胞来改变听觉生物电和外毛细胞的机械特性[5]。而顺铂作用于机体后,耳蜗内的iNOS被激活,被激活的iNOS催化L-精氨酸生成大量的NO,而过量的NO会产生病理性损伤作用,造成内耳螺旋器上的内毛细胞、外毛细胞及肾脏的近曲、远曲小管的上皮细胞的损害,从而影响耳蜗的感音功能和肾小管的重吸收及排泌功能。NO造成组织细胞损害的具体机制如下:NO为不稳定气体,遇超氧阴离子(O2-)反应生成过氧亚硝基阴离子(ONOO-),ONOO-很容易分解成羟基自由基(·OH)和二氧化氮(NO2),ONOO-,· OH和NO2的氧化性质都很强,具有很大的细胞毒性,可造成细胞膜、线粒体,蛋白质、核酸、酶类的损伤[6]。NO的另一生物毒性作用是从三个不同环节来干扰细胞的能量代谢:抑制三磷酸甘油醛脱氢酶的活性,影响复合物Ⅰ、Ⅱ的形成,抑制氧化磷酸化[7,8]。此外,可与细胞 DNA发生硝基化反应,造成DNA的损伤[9]。
研究结果显示,NO在顺铂耳毒性、肾毒性的作用中占有重要的地位:顺铂通过激活iNOS引起NO的过量生成,NO与超氧阴离子反应,生成有强氧化性的分子,后者损伤耳蜗及肾脏的超微结构,从而影响内、外毛细胞及肾小管上皮细胞的代谢和功能,这可能是顺铂造成耳毒性、肾毒性的重要途径之一。根据此项研究,临床医生可以考虑应用 NOS的竞争性拮抗剂(如L-NAME,L-NNA,L-NMMA)来预防、治疗顺铂所造成的耳蜗及肾脏的超微结构的损伤。
[1] Xie QW,Cho HJ,Calaycay J,etal.Cloning and characterization of inducible nitric oxide synthase from mouse macrophages.Science,1992,256:225.
[2] Wood ER,Berger H Jr,Sherman PA,etal.Hepatocytes and macrophages express an identical cytokine inducible nitric oxide synthasegene.Biochem Biophys Res Commun,1993,191:767.
[3] Li Y,Ito N,Suzuki T,etal.Dexamethasone inhibits nitric oxide-mediated cytotoxicity via effects on both macrophages and target cells.Immunopharmacology,1995,30:177-186.
[4] 杨志江,李桂红,蒲红伟,等.食管癌组织中 bcl-2、c-myc、iNOS表达及其意义.陕西医学杂志,2008,37(6):686-688.
[5] Fesenden JD,Schacht J.The nitric oxide/cyclic GMP pathway: a potential major regulator of cochlear physiology.Hear Res,1998,118(1-2):168-176.
[6] Lancaster JR,Hibbs JB Jr.EPRdemonstration of ironnitrosyl complex formation by cytotoxic activated macrophages.Proc Nalt Acad Sci USA,1990,87:1223.
[7] Lepoivre M,Fieschi F,Coves J,etal.Inactivation of ribonucleotide reductase by nitric oxide.Biochem Biophs Res Commun,1991,179:442.
[8] Kwon NS,Stuehr DJ,Nathan CF.Inhibition of tumor cell ribonucleotide reductase by macrophage-derived nitric oxide.J Exp M ed,1991,174:761.
[9] Kaplan SS,Billiar T,Curran RD,etal.Inhibition of chemotaxis Ng-monomethyl-L-arginine: a role for cyclic GMP.Blood,1989,74:1885.
