黄芪甲甙干预小鼠骨髓间充质干细胞凋亡的研究△
2010-11-22南华大学附属第一医院衡阳421001
南华大学附属第一医院(衡阳 421001)
刘丹莉 杨云华 于小华 李双杰
组织工程和基因工程技术发展而来的细胞替代治疗和基因治疗是近年来医学领域乃至整个生命科学领域中的研究热点和前沿,为人类征服多种疾病提供了新的途径和希望。近年来,细胞心肌移植术作为一种新的治疗心衰的方法显示出其重要性,其理论基础就是通过新的细胞修复受损区域来改善心功能[1]。近 10年来,骨髓间充质干细胞作为组织工程细胞成为研究的热点,但研究大多集中于对骨髓间充质干细胞的诱导分化上,而对移植后细胞的存活情况的研究很少,由于移植后细胞生存率的高低直接影响到治疗效果,故如何提高骨髓间充质干细胞的存活率,是目前亟待解决的问题。本试验通过研究黄芪甲甙对骨髓间充质干细胞增殖与凋亡的影响,以求进—步提高移植后 BMSCs的存活率,从而提高治疗效果。
材料与方法
1 材料选择
1.1 动物:纯种近系 Balb/c小鼠(批号:SCYK沪2002-0002),4周龄,雄性,SPF级,体重12~16g,购买于复旦大学动物实验科学部。
1.2 试剂:L-DMEM培养基、胰酶(GIBICO);胎牛血清(天津颢洋公司产品);MTT、DMSO(Sigma公司);一抗 CD34、CD44、淋巴细胞分离液(Santa cruz公司);二抗 FITC-Goat Anti-Mouse IgG(武汉博士德公司);TUNEL试剂盒为美国 Rouse公司)。
1.3 倒置相差显微镜(日本 Olympus公司),荧光显微镜(美国 Nikon公司),流式细胞仪(COULTER EPICS ALTRA Hyper Sert TM System,美国)。
1.4 黄芪甲甙(批号:0781-9706)由国家药物和生物制品检定研究所(NICPBP)提供,为白色干粉剂,不溶于水,用助溶剂羧甲基纤维素钠制成均匀混悬液。
2 方 法
2.1 骨髓间充质干细胞的分离与培养及鉴定
2.1.1 选健康 4周龄雄性 Balb/c小鼠,体重12~16g,断颈法处死后75%乙醇浸泡杀菌 5min;无菌取股骨和胫骨(必须把肌肉剔除干净),用骨剪剪断两端关节处,注意保留骨端部分不受损伤。用一次性5号注射器吸取无血清 DMEM向无菌培养皿中冲洗出骨髓腔干细胞。用10ml离心管收集冲出的细胞,离心1000转/min、5min,弃上清液。向沉淀中加含15%胎牛血清的DMEM培养液4ml,用吸管轻轻吹打吹散细胞,把细胞移入50ml培养瓶中,并用吸管轻轻吹散细胞,轻轻摇匀,标记为原代细胞,置 37℃,5%CO2恒温培养箱中进行原代细胞培养,并于接种细胞后 48h时倒掉细胞悬浮液,再加入4m1培养液继续培养。于接种细胞5d时首次换液,以后每周换液两次,待细胞接近融合时,胰蛋白酶消化,1∶2传代,标记为第一代(Passage l,P1),倒置显微镜逐日观察,待细胞铺满瓶底时,重复上述操作,反复传代扩增,并标记为P2~P5等。由于细胞贴壁性能不同,每次换液传代0.25%胰蛋白酶(1~2ml)消化2~3min,严格控制酶的量和消化时间,将 BMSCs与可能混杂的淋巴细胞、单核细胞分开,从而使 BMSCs得到纯化。
2.2 骨髓间充质干细胞的鉴定
2.2.1 免疫荧光法鉴定:取生长良好的P8代细胞,消化,以1×104/ml接种细胞于预置三个盖玻片的6孔板中使细胞爬片,放入恒温培养箱中培养,逐日观察,待细胞长满玻片时,取出玻片,80%冷丙酮固定,0.5%Tri 2tor 2×100破膜,3%过氧化氢消除内源性过氧化物酶,正常山羊血清封闭,分别加一抗(小鼠抗大鼠 CD44、CD34,PBS作为阴性对照组),室温孵育过夜后,PBS冲 3遍,以洗去未结合的一抗,加荧光标记二抗,避光置于37℃恒温培养箱中反应1h后置荧光显微镜下观察。
2.2.2 流式细胞仪分析:取三瓶生长良好的P9代骨髓间充质干细胞,0.25g%的胰酶消化后,收集细胞离心1000转 /min、7min,弃去上清液,加入PBS冲洗再离心同上,弃去上清液,分别加入加入稀释的CD34、CD44一抗,PBS作为阴性对照,4℃孵育 30min,流式仪检测细胞表面抗原 CD34、CD44。
2.3 细胞增殖分析采用M TT法:0.25%胰酶消化体外增殖 BMSCs并计数,再将 200μl密度为1×107~108个/L BMSCs均匀接种到包被有明胶的96孔培养板,共分三个时间点(12h,24h,48h)和6个浓度组:空白对照组,10μg/L阿霉素组(ADR),ADR+AST(4μg/L,40μg/L,400μg/L)组,400μg/L黄芪甲甙组(AST组)(n=3)。分别培养 12h、24h、48h后每孔加10μl MTT(5μg/ml),37℃、5%CO2培养箱继续培养 4h后,吸弃上清液,再加入二甲基亚砜(150μl/孔),于微量振荡器充分振荡10min,置酶标仪于波长490nm处测吸光度(Optical density,OD)值。
2.4 骨髓间充质干细胞凋亡检测
2.4.1 流式细胞仪:FITC单染色法检测早期凋亡细胞:取生长良好的P9代BMSCs细胞,实验分6组,空白组、阿霉素组(10μg/L),阿霉素(10μg/L)加低(4μg/L)、中(40μg/L)、高(400μg/L)浓度黄芪甲甙组,黄芪甲甙(400μg/L)组,分别向培养瓶中加入上述不同浓度的药物,作用 24h后收集细胞,上机检测。同样操作重复 3次。
2.4.2 TUNEL法检测:光镜下细胞被染成棕褐色者为阳性细胞,即凋亡细胞。
结 果
1 骨髓间充质干细胞的分离与培养及鉴定:原代细胞于接种后约24h,大部分细胞贴壁,倒掉悬浮生长的细胞,贴壁细胞继而分裂增殖,呈集落式生长,集落不断增多、扩大、互相融合,约 10~14d铺满瓶底,有漂浮不贴壁细胞呈囚形或椭圆形,随传代次数增多,夹杂至原代末期的非BMSC会逐渐被洗去。传代细胞很快贴壁,增殖迅速,约 6~7d长满瓶底,呈梭形均匀分布。多次传代,细胞有更均匀有序的成纤维细胞样分布。连续传 5代,细胞形态无明显变化,无衰老征象,传代周期 6~7d,说明 BMSCs得到了进一步的纯化。
2 流式细胞术鉴定:流式细胞术鉴定 CD44阳性率为(78±5.34)%,CD34阳性率约为(29±3.13)%,说明P3代细胞还不是很纯。
3 细胞凋亡的检测
3.1 流式细胞术检测早期细胞凋亡:流式细胞仪检测不同浓度、不同时间细胞凋亡率,见图1。
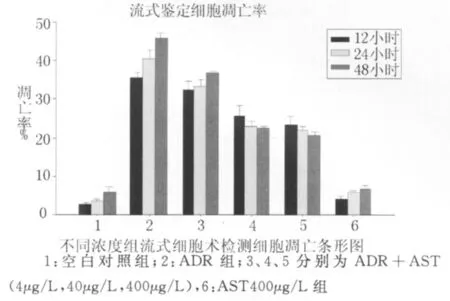
图1 不同浓度组流式细胞术检测细胞凋亡条形图
图中 48h组通过流式细胞术检测阿霉素组明显的凋亡峰,黄芪甲甙组凋亡峰明显下降。通过统计学方法分析,48h组,阿霉素组与ADR+AST40μg/L、ADR+AST400μg/L组凋亡率比较均有显著性差异(P<0.01),与ADR+AST4μg/L组比较无显著性差异。对于ADR+AST40μg/L组,48h组 OD值与12h、24h组比较均有显著性差异(P<0.01或0.05),12h和24h组无显著性差异,随着黄芪甲甙浓度的增大,作用时间的延长,对骨髓间充质干细胞凋亡的抑制作用越强。
3.2 TUNEL法检测:TUNEL法检测不同浓度、不同时间细胞凋亡率值,见表1及TUNEL检测细胞凋亡曲线图。
表1 TUNEL法检测不同浓度、不同时间细胞凋亡率值(±s)
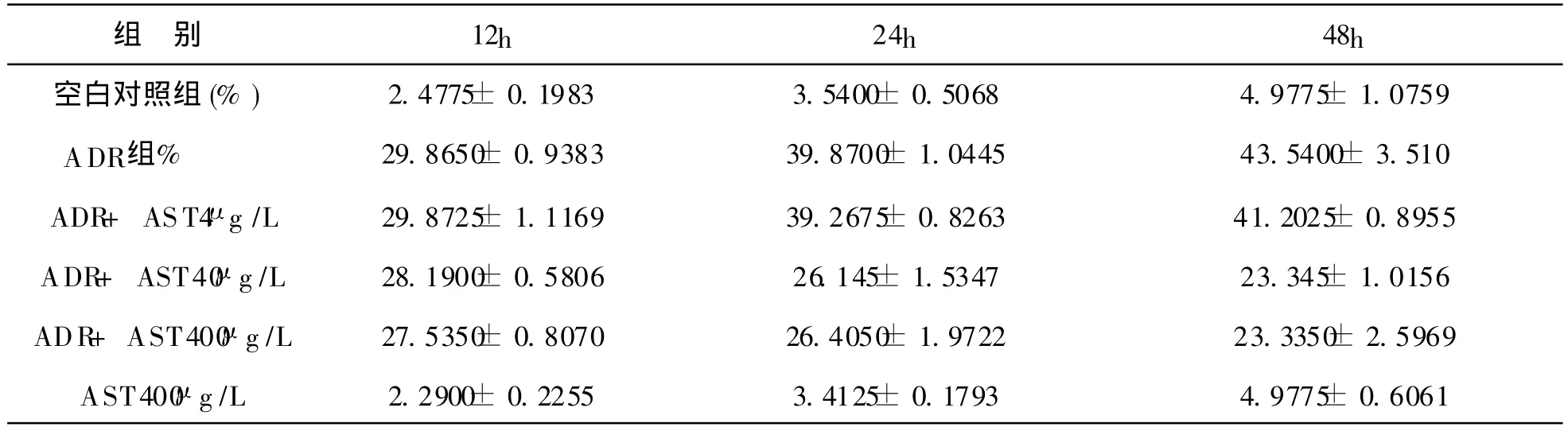
表1 TUNEL法检测不同浓度、不同时间细胞凋亡率值(±s)
ADR+AST40μg/L 28.1900±0.5806 26.145±1.5347 23.345±1.0156 ADR+AST400μg/L 27.5350±0.8070 26.4050±1.9722 23.3350±2.5969 AST400μg/L 2.2900±0.2255 3.4125±0.1793 4.9775±0.6061
表1中 48h组,阿霉素组与ADR+AST40μg/L、ADR+AST400μg/L组凋亡率比较均有显著性差异(P<0.01),与ADR+AST4μg/L组无显著性差异。对于ADR+AST40μg/L组,48h组 OD值与12h、24h组比较均有显著性差异(P<0.01或 0.05),而 12h组与24h组差异无显著性,随着黄芪甲甙浓度的增大,作用时间的延长,对骨髓间充质干细胞凋亡的抑制作用越强。
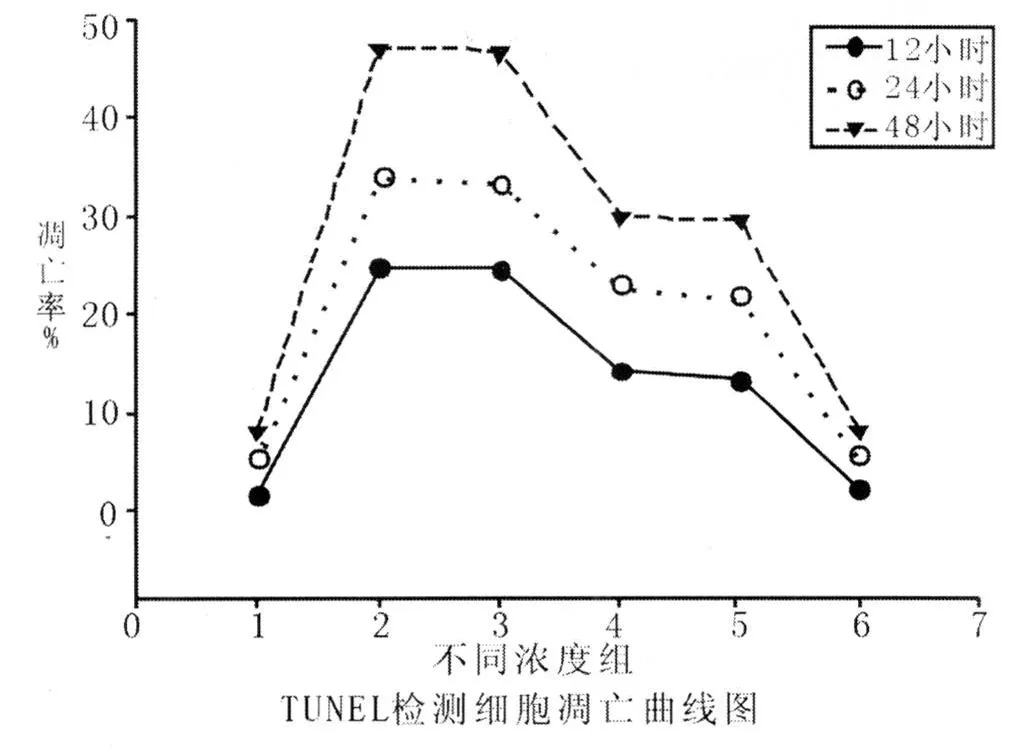
图2 TUNEL检测细胞凋亡曲线图
图2中 1、2、3、4、5、6代表含义同图1,由图可看出,随着黄芪甲甙浓度的增加及药物作用时间的延长,细胞凋亡率呈逐渐下降的趋势。
讨 论
细胞心肌移植术是通过向受损心肌补充肌源性细胞,从而改善心功能的细胞治疗方法。异基因造血干细胞移植是许多疾病目前治疗的有效手段,目前靶细胞选择从具有免疫排斥和伦理问题的胚胎心肌细胞转向成体自身组织来源,如骨骼肌卫星细胞,但后者不能形成有效闰盘连接且取材繁琐使其应用受限。间充质干细胞(Mesenchymal stem cells,MSCs)是中胚层的干细胞,理论上可以分化发育成中胚层所有组织类型的细胞,也可以存在于所有中胚层来源的组织中[2]。具有多向分化潜能的干细胞。骨髓间充质干细胞(Bone mesenchymal stem cells,BMSCs)是各种间质细胞的前体细胞,具有很强的增殖能力和多向分化潜能。它可以向多种结缔组织分化,形成骨、软骨、骨骼肌腱、真皮及神经细胞、心肌细胞等[3,4]。BMSCs是已知成体内分布范围最广,分化方向最多的干细胞,还具有取材方便、扩增容易,进入机体后可全身分布,应用自体细胞没有免疫排斥和伦理问题,外源基因表达稳定,是细胞治疗和基因治疗的良好种子 /载体细胞。已经成为继造血干细胞后第 2个用于临床的干细胞,具有很重要的临床应用价值[5,6]。BMSCs离体实验在 5-氮杂胞苷类(5-Azacytidine,5-aza-CR)物质诱导下,能向心肌细胞分化[2,3]。在体实验也显示在心肌局部微环境诱导下,BMSCs能向心肌细胞分化,并改善受损心脏功能[7]。实验证实BM SCs移植入心脏后,可在移植部位检测到标记的BMSCs细胞,其c TnT染色阳性,从而证实了BMSCs能在这种非缺血微环境中向心肌细胞分化。干细胞心肌移植时,心肌内每点注射的细胞数量有限,并且移植细胞的存活率不高;增加移植细胞的数量和提高其存活率对心功能的改善更有利。如何提高移植后干细胞的存活率是当前干细胞移植治疗心血管疾病的丞待解决的问题。由于干细胞本身以及其分化的子代细胞的存活、生长需要合适的微环境,当干细胞或培养干细胞植入损伤的心脏后,由于周围组织缺血缺氧,环境恶劣,移植的大部分干细胞并不能够存活,大约有99%左右的细胞会死亡,这—问题大大降低了干细胞在心肌损伤修复中的效果。因此,提高移植后细胞的存活率是干细胞用于心肌修复治疗的一个关键。目前已有研究证实通过基因对细胞进行修饰可以提高其移植后的生存率,如Margi等将akt基因导入骨髓间质干细胞后移植损伤心脏,该策略能够明显提高干细胞存活率,并使心功能获得明显的改善[8]。那么选择有效的能抑制干细胞凋亡促进其增殖的药物对干细胞进行干预,可能也是提高细胞的移植存活率和治疗效果的—条有效途径。
研究表明,黄芪甲甙对病毒性心肌炎有良好的治疗作用[9,10]。近年来有研究表明,黄芪甲甙制剂可刺激造血干细胞由静止期进入增殖期,刺激其分化,还可刺激基质细胞分泌某些细胞生长因子,从而促进造血干细胞的增殖。促进增殖的机理可能是通过保护和改善骨髓造血微环境,并通过促进基质细胞的生长和增殖,进而促进造血干细胞的增殖[11]。ADR是临床上常用的抗肿瘤化疗药,其最严重的副作用是导致心衰和心肌病的产生,通过这种药物,目前已经建立了多种动物心肌病和心衰模型[12]。本试验通过阿霉素对BMSC诱导凋亡,再加入黄芪甲甙进行干预,观察不同组别间细胞增殖与凋亡的情况,结果显示黄芪甲甙 40μg/L组凋亡率为(23.04±1.12)%,和单纯 ADR组凋亡率(40.42±2.28)%相比,差异有显著性,说明黄芪甲甙具有抑制 BMSC凋亡的作用,和400μg/L组凋亡率(21.85±1.21)%比,差异无显著性,说明黄芪甲甙对 BMSC的凋亡作用不是剂量依赖性,而是具有最适浓度,本试验显示为40μg/L具有较强的抑制凋亡的作用。实验结果为中药黄芪甲甙应用于BMSCs移植治疗心血管疾病提供动物实验依据。
[1] Niesler CU.Old dogmas and new hearts:a role for adult stem cells in cardiac repair[J].Cardiovasc JS Af r,2004,15(4):184-189.
[2] Wollert KC,Meyer GP,Lotz J,etal.Intracoronary autologous bone-marrow cell transfer after myocardial infarction:the boost randomized controlled clinical trial[J].Lancet,2004,10;364(9429):141-148.
[3] Pallante BA,Duμgnan I,Okin D,etal.Bone marrow oct3/4+cells differentiate into cardiac myocytes via agedependent paracrine mechanisms[J].Circ Res,2007,100(1):e1-e11.
[4] Oh H,Bradfute SB,Gallardo TD.Cardiac progenitor cells f rom adult myocardium: homing,differentiation,and fusion after in farction[J].Proc Natl Acad Sci USA,2005,100(21)∶12313-12318.
[5] Maitra B,Szekely E,Gjini K,etal.Human mesenchymal stem cells support unrelated donor hematopoietic stem cells and suppress T-cell activation[J].Bone marrow Transplantion,2004,33:597-604.
[6] Kutschka T,Kofidis I Y,Chen G,etal.Adenoviral human Bcl-2 transgeneexpression attenuates early donor cell death after cardiomyoblast transplantation into ischemic rat hearts circulation,2006,4;114(1-suppl):I-174-I-180.
[7] 胡 煜,陈维信.骨髓间充质干细胞在现代细胞治疗中的潜在作用[J].国际移植与血液净化杂志,2006,4(3):35-37.
[8] Schweizer PA,Krause U,Becker R,etal.Atrialradiofrequency catheter ablation mediated argeting of mesenchymal stromal cells[J].Stem Cells,2007,25(6):1546-1551.
[9] 李小鸣,田 红,李双杰.黄芪甲甙治疗 Balb/c小鼠慢性柯萨奇 B3病毒性心肌炎的疗效 [J].实用儿科临床杂志,2008,23(18):1454-1456.
[10] 刘 晓,武正炎,范 萍.黄芪与粒细胞-集落刺激因子对外周血干细胞移植术后早期造血功能重建影响的观察.南京医科大学学报[J],2000,20(4):281-284.
[11] Van Vlasselaer P,Falla N.Snoeck H1 characterization and purification of osteogenic cells from murine bone marrow by two-color cell sorting using anti-sca-1 monoclonalantibody and wheat germ agglutinin1 Blood,1994,84:753.
[12] 张 静,李庚山,李国草.骨髓问充质干细胞自体移植治疗阿霉素心肌病[J].微循环杂志,2005,15(3):8-10.
