α-苯乙醇的酶法拆分工艺优化
2010-11-22卢小春赖敦岳裴曾飞陈振明
卢小春,赖敦岳,裴曾飞,陈振明*
(1.眼力健(杭州)制药有限公司,浙江 杭州 310018;2.杭州师范大学 生物和可持续技术中心,浙江 杭州 310012)
苯乙醇是一种芳香醇,在香料、涂料、纺织工业、医药、感光材料等方面具有广泛的用途[1].近年来,随着相关行业的发展,国内外对手性苯乙醇的需求不断增加.手性苯乙醇是许多手性药物合成的关键手性砌块和平台化合物[2-3],在手性合成中占有重要的地位,它可以被用来从一些非常简单的起始原料去制备一些重要的手性中间体,也能够在一些复杂天然产物的不对称合成中被用作最初的手性中心.
习惯上称为苯乙醇的有两种,即α-苯乙醇和β-苯乙醇,其中α-苯乙醇存在R-和S-两种光学异构体.手性α-苯乙醇的不对称合成方法很多,其中酶催化不对称合成手性α-苯乙醇具有反应条件温和、区域选择性和立体选择性较高等优点.随着制药工业对手性化合物需求的日益增长和人类环保意识的增加,酶催化工艺作为一种绿色的手性技术,已成为目前化学制药领域中研究和应用的热点之一.酶法拆分主要是通过酶有选择地催化R-α-苯乙醇与酞基供体发生醋化反应或转醋化反应得到R-苯乙酯,留下未反应的S-α-苯乙醇,再把R-苯乙酯水解得到R-苯乙醇[4-6].此外Jacques Drouin[7]采用Novozym435脂肪酶,催化戊酸α-苯乙酯和正丁醇的转酯化获得R-α-苯乙醇;而Tadashi Ema[6]在二异丙醚作溶剂,乙酸乙烯酯作酰基供体,以枯草杆菌蛋白酶(subtilisin)作催化剂时,则优先转酷化S-对映体.
该研究中,使用实验室已有的一种脂肪酶[8]对α-苯乙醇进行手性拆分,并对其产物进行了分离.为进一步的实验脂肪酶拆分苯乙醇以及工业化生产手性苯乙醇提供了翔实的实验数据.
1 实验部分
1.1 仪器和试剂
脂肪酶由该实验室已有的一工程菌发酵得到[8],按1.2.1中方法检测出比酶活为519.6 U/mg;恒温摇床,上海精弘实验设备有限公司;高效液相色谱仪,Varian ProStar 410.乙酸苯乙酯、苯乙醇为西格玛奥德里奇(SAFC)公司产品;正己烷、异丙醇为色谱纯,天津科密欧试剂有限公司的产品.其他试剂均为国产分析纯.
1.2 方 法
1.2.1 酶活测定方法[9]
1.2.1.1 原理
对硝基苯酚棕搁酸酷(PNPP)在脂肪酶的作用下水解,生成的对硝基苯酚(pNP)呈黄色,在405 nm处有吸收值,通过测定OD405来确定pNP浓度,进而计算脂肪酶活力.
1.2.1.2 底物溶液和缓冲液的配制
底物:用异丙醇配制10 mM的对硝基苯酚棕桐酸醋.
pNp标准溶液:称取20 mg pNp溶于100 mL 0.1 MTris-HCI(pH8.0)缓冲液中.
缓冲液:苏润生缓冲液(50 mMTris-HCI,pH8.0,0.1%阿拉伯胶,0.2%脱氧胆酸钠盐)
酶液:取4 mg酶粉加1 mL 50 mM Tris-HCI,pH8.0缓冲液,混匀置于冰上.
1.2.1.3 标准曲线的绘制
分别取10、20、30、40、50、60、70和80 μL 1.437 7 mM的pNp,用pH8.0 Tris-HCI补足至10 mL,每个浓度做3组平行样品,测OD405后取平均值绘制标准曲线.
1.2.1.4 酶反应的进行
将4个洁净的EP管置于板上,取880 μL苏润生缓冲液于EP管中,加入100 μL底物溶液,混匀后置于55 ℃水浴中预热3 min,其中3管加入20 μL稀释过的酶液,另一管加20 μL双蒸水作为负对照.迅速混匀后置于水浴中,反应3 min后加入0.5 mL 3 M HCI终止反应,离心(16 000 r/m,2 min).取上清0.5 mL置于另一EP管中(取上清的时候注意尽量不要吸取悬浮的颗粒物质),加入1 mL 0.6 M NaOH,混匀后测OD405.最后取3管读数的平均值.
酶活力单位(U)定义:一定条件下,每分钟水解底物生成1 μmol对硝基苯酚所需要的酶量.
1.2.2 拆分反应
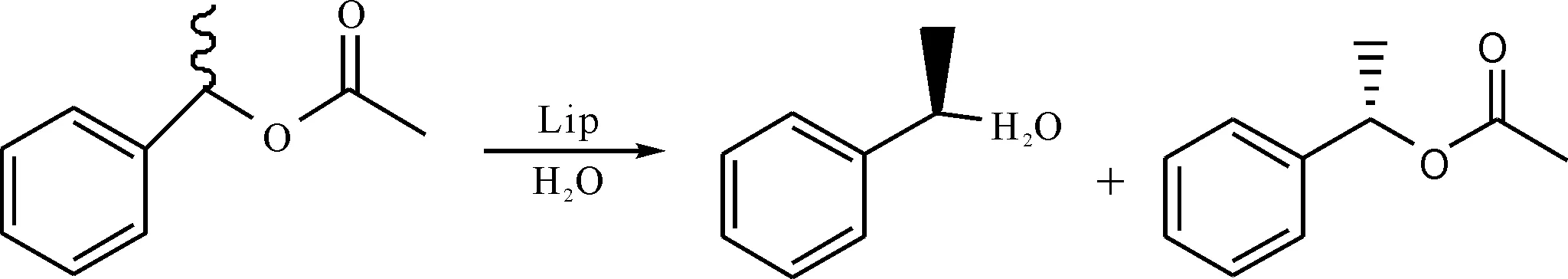
图1 重组脂肪酶选择性地水解(RS)-乙酸苯乙酯Fig. 1 Hydrolysis of (RS)-1-phenylethyl acetate by the recombinant LipJC
以外消旋的乙酸苯乙酯为底物,在重组脂肪酶的作用下,R-乙酸苯乙酯分解成R-苯乙醇和乙酸,留下未反应的S-乙酸苯乙酯(如图1).然后可根据化学性质的不同将它们分离,得到光学纯的R-苯乙醇.
反应器为50 mL细口瓶,初始反应条件:反应体系0.5 M pH8.0磷酸钾缓冲溶液2 mL,温度20 ℃,摇床转速120 r/min,酶粉量0.01 g(5 196 U),底物乙酸苯乙酯的量2.0 M,反应16 h后.加入5 mL正己烷,剧烈振荡30 s,放置10 min.从上层(有机层)取样0.6 mL,用正己烷稀释至1.2 mL,过滤后进行HPLC分析.
设计阳性对照:相同的磷酸缓冲液,称取等量酶粉用缓冲液溶解,用等摩尔的产物(苯乙醇)代替底物(乙酸苯乙酯).取样进行高效液相色谱测定.
1.2.3 分析方法
高效液相色谱法可以精确地测定拆分反应后样品溶液中S-苯乙醇和R-苯乙醇的含量,R-苯乙醇出峰时间为9.5 min,S-苯乙醇为12.09 min.因此用高效液相色谱法定量地测定其拆分能力:转化率和产物的ee值.
测定的色谱条件:
1)色谱柱:手性色谱柱(Chiralcel OD,Japan, Daicel chemical,0.46φ×25);
2)流动相:正己烷/异丙醇(95/5,v/v,1 mL/min);
3)柱温:25 ℃;检测波长:UV254 nm.
1.2.4 反应过程中的一些参数
苯乙醇的拆分条件研究通常衡量手性拆分能力高低的参数有:转化率,产物的ee值.实验利用高效液相色谱检测出反应体系中底物和产物的各种手性物质含量进行计算,各参数的计算公式参见文[10].
1.2.5 产品分离
反应液用5 mL乙酸乙酯萃取2次,合并有机层并减压浓缩.用硅胶柱层析分离,首先用n(石油醚)∶n(乙酸乙酯)=100∶1的混合溶液为展开剂,10 mL/管分步收集.再换用n(石油醚)∶n(乙酸乙酯)=10∶1的混合溶液为展开剂10 mL/管分步收集.点板检测每一管,成分一致的旋转浓缩.最后对浓缩后的物质用1.2.2中方法进行检测.再对分离出来的S-乙酸苯乙酯进行碱水解得到S-苯乙醇,液相色谱检测.
2 结果及讨论
2.1 底物浓度对拆分的影响
底物与溶剂共同组成了反应体系,其中底物浓度的高低直接影响了反应的拆分效果.底物浓度过高时,磷酸缓冲液无法调节生成的大量乙酸对体系pH值的冲击,转化率就愈低;另一方面,该酯与磷酸缓冲液的体系也是个两相体系,酯的浓度过高不利于酯在磷酸缓冲液中的分散,不利于底物与酶的接触,对拆分也会有影响.而浓度太低却不利于酶的利用,拆分效果不好.图2显示了底物浓度对拆分效果的具体影响,综合考虑转化率和产物苯乙醇的ee值,选择2.08 M作为底物浓度进行下一步的条件优化分析,以提高其反应转化率和苯乙醇的ee值.
2.2 酶量对拆分的影响
图3表明了酶用量对酶促反应拆分效果的影响.实验发现:酶用量在0.05 g以下时,转化率随酶用量增加而增大;大于0.05 g后,酶量的增加对转化率的提高影响不大.所以选择0.05 g酶作为反应时的酶量.
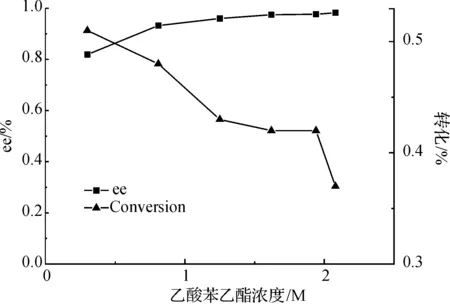
图2 不同底物浓度对反应的影响Fig. 2 Effect of substrate concentrations on the reaction
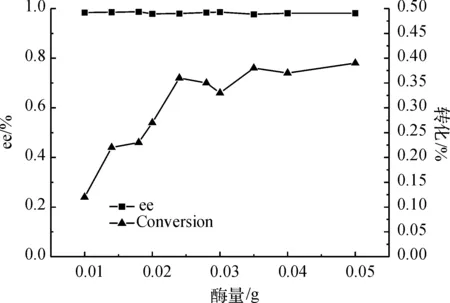
图3 不同酶量对反应的影响Fig. 3 Effect of enzyme concentrations on the reaction
2.3 缓冲液pH对拆分的影响
图4表明,在苯乙醇拆分反应中,酶催化不对称反应的活性受其所在环境pH的影响较为显著.在pH7.5的环境中,对底物的转化达到最佳效果,转化率可达36%.pH值大于或小于7.5,反应的转化率都会下降,但ee值的变化不明显.
2.4 缓冲液浓度对拆分的影响
实验结果表明,缓冲液浓度1.0 M以下时,磷酸缓冲液浓度低时无法调节生成的乙酸对体系pH值的冲击,转化率较低,转化率随缓冲液浓度增加而增大;而当缓冲液浓度大于1.0 M后,缓冲液浓度增加对转化率的提高影响不大.所以选择1.0 M作为反应缓冲液的浓度(图5).
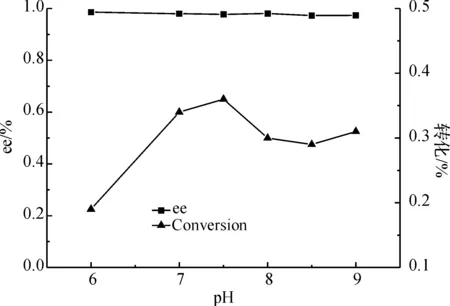
图4 不同pH对反应的影响Fig. 4 Effect of pH of enzyme microenvironment on the reaction
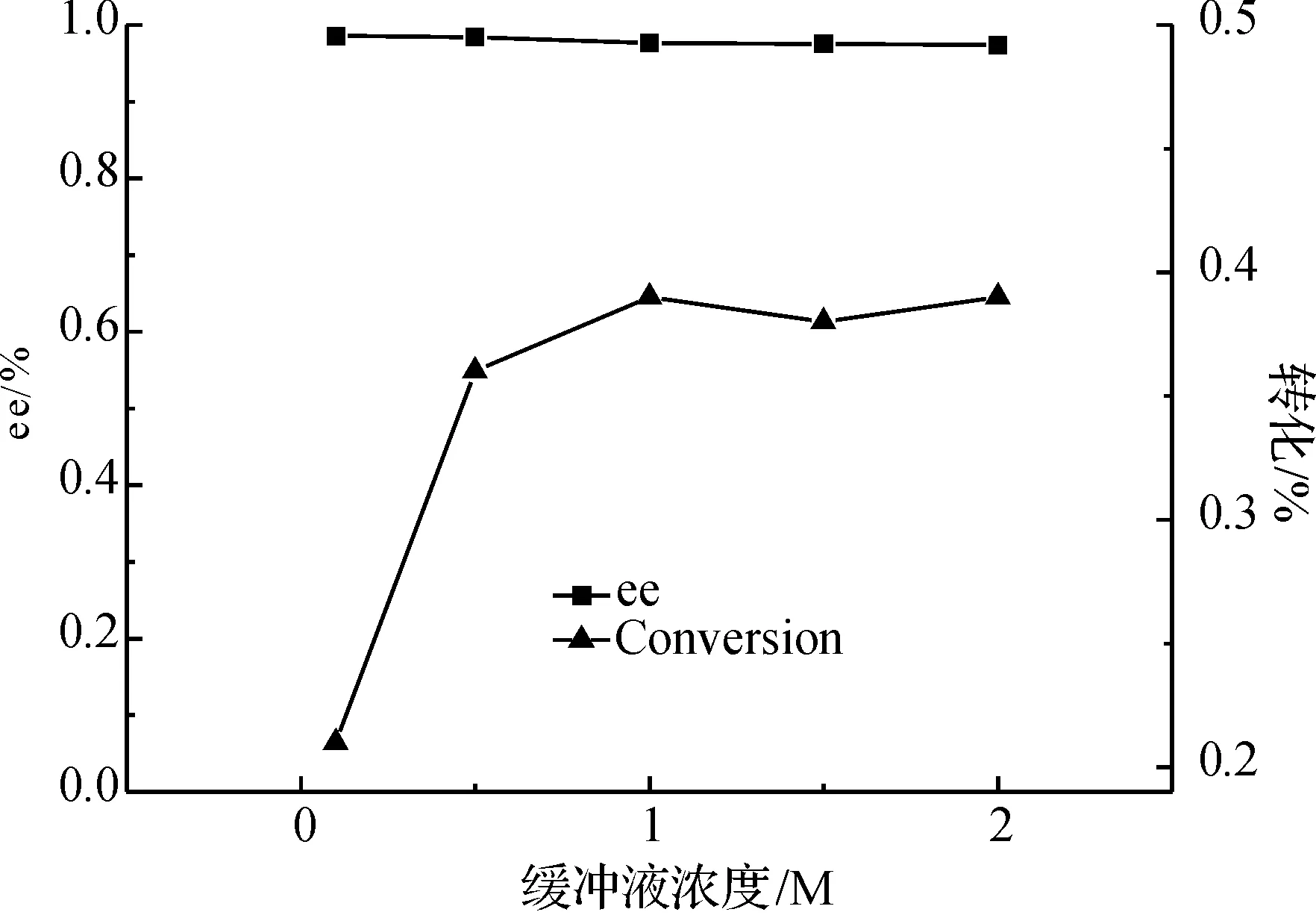
图5 缓冲液浓度对反应的影响Fig. 5 Effect of the potassium phosphate buffer concentration on the reaction
2.5 温度对拆分反应的影响
实验发现,温度在20 ℃左右时效果最好.总体来说,温度不能过高,20 ℃时转化率相当、拆分效果也好;但温度过高虽是酶活最适温度,但不能达到良好的拆分效果,这也说明了最高的酶活温度并不是酶拆分的最适温度.实验表明,酶促反应的最适温度应在20~30 ℃范围内.
2.6 转速对拆分反应的影响
低转速时,反应瓶中的酶大都沉积在瓶底,没有很好地分散在整个体系中,酶与底物没有充分地接触;当转速提高时,酶在体系中的分配状态得到改善,能够均匀地分散在整个体系中,可以增加酯和水相中酶的接触.图7显示了振荡频率对反应的影响,反应在180 r/min的条件下效果最佳.
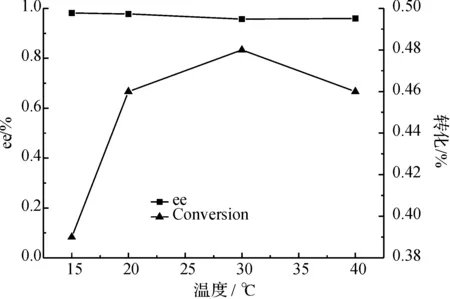
图6 温度对反应的影响Fig. 6 Effect of the temperature in the reaction
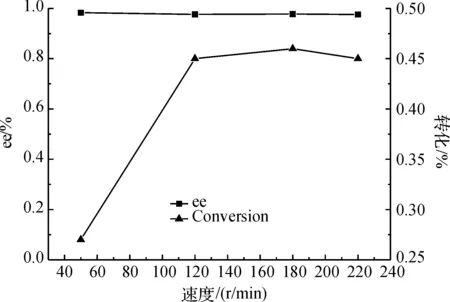
图7 转速度对反应的影响Fig. 7 Effect of the shaker rpm on the reaction
2.7 时间对拆分的影响
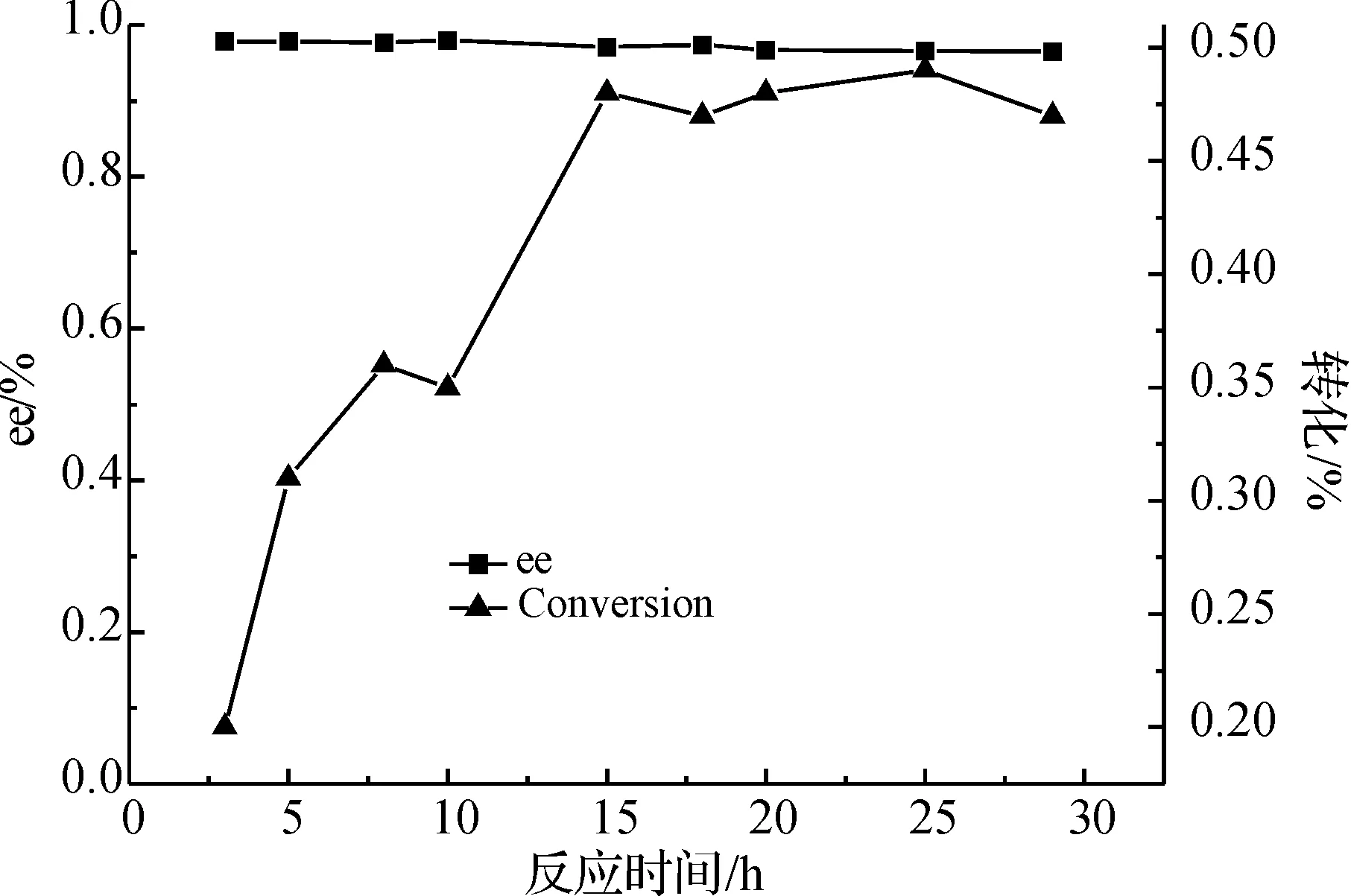
图8 反应时间对反应的影响Fig. 8 Effect of the reaction time
由图8看出,随着反应的进行,产物的ee值变化不大,都维持在一个较高的水平;而反应的转化率在前15 h随着时间的延长而增加;15 h后,随着时间的增加转化率的趋势不变,所以反应时间选定为15 h.
2.8 苯乙醇的分离
使用1.2.5中的方法对反应液进行分离,得到R-苯乙醇0.6 mL、产率30%和S-苯乙醇0.8 mL、产率40%.并使用1.2.3中的方法进行液相检测,液相分析图谱如图8所示,根据1.2.4中方法计算得到:R-苯乙醇纯度99%、ee值98%;S-苯乙醇纯度98%、ee值85%.
3 结 论
在2 mL 1.0 M pH7.5的磷酸钾缓冲液中,加入0.05 g(2 598 U)酶粉,加入1 mL乙酸苯乙酯(2.08 M),20 ℃,180 r/min反应15 h,得到R-苯乙醇ee达到97.2%,转化率48%.分离得到纯品R-苯乙醇0.6 mL、产率30%,纯度99%、ee值98%;S-乙酸苯乙酯0.95 mL,并让其在碱性条件下水解得到S-苯乙醇0.8 mL、产率40%,纯度98%、ee值85%.
由以上实验结果,得到了较佳的脂肪酶拆分制备手性苯乙醇的基本工艺参数,为进一步的实验脂肪酶拆分苯乙醇以及放大生产提供了翔实的实验数据.
[1] 魏文德.有机化工原料大全[M].北京:化学工业出版社,1990:555.
[2] Shimizu S, Kataoka M, Kita K. Chiral alcohol synthesis with yeast carbonyl reductases[J]. J Mol Catal B: Enzym,1998,5(1):321-325.
[3] Xie Qin, Wu Jianping, Lin Li. Purification and characterization of a carbonyl reductase from Candidapseudotropicalis[J]. J Chem Eng of Chinese Univ,2009,23(1):92-98.
[4] Frings K, Koeh M, Hartmeier W. Resolution of 1-Phenyl ethanol with high enantioseleetivity with native and inunobilized lipase in organic solvents[J]. Enzyme and Microbial Technology,1999(25):303-309.
[5] 郭旺明.无溶剂体系酶催化拆分α-苯乙醇[D].杭州:浙江大学,2002.
[6] Tadashi Ema, Ryoichi Okada, Minoru,etal. Transition-state model for subtilisin-catalyzed transesterification of secondary aleohols[J]. Tetrahedron Letters,1999,40:4367-4370.
[7] Jacques Drouin, Jeanne Costante. A thermostable microbial enzyme for fast preparative organic chemistry preparation of (R)-(+)-phenylethanol from (±)-1-phenylethyl pentanoate and n-butanol[J]. Journal of Chemieal Education,1997,74(8):992-995.
[8] Jiang Yu, Zhou Xiaoyun, Chen Zhenming. Cloning, expression, and biochemical characterization of a thermostable lipase fromGeobacillusstearothermophilusJC[J]. World J Microbiol Biotechnol,2010,26(4):747-751.
[9] Salsuburamanlyan N, Krithika L, Dlleena K P,etal. Lipase assay in soils by copper soap colorimetry[J]. Analytical Bioehemistry,2004,330(1):70-73.
[10] 孙志皓,许建和.生物催化工艺学[M].北京:化学工业出版社,2005:123-127.
