利用蛋白质微阵列筛选抗胸腺瘤优势抗原表位
2010-11-22王轶雄罗陈启闻树群
方 序,王轶雄,罗陈启,闻树群,陈 敏
(1.浙江省微生物研究所,浙江 杭州 310012;2.浙江大学医学院附属二院,浙江 杭州 310009;3.杭州师范大学 生命与环境科学学院,浙江 杭州 310036)
重症肌无力(myasthenia gravis,MG)发病率近年在我国呈明显上升趋势,重症肌无力是一类自身免疫病,是由于机体免疫抑制性T细胞功能减弱,在自身反应性Th细胞协同作用下,以神经肌肉接头处的N型乙酰胆碱受体(Nicotinic acetylcholine receptor, AChR)等分子作为抗原诱发自身抗体,通过抗体依赖的补体溶解作用参与对突触后膜运动终板的破坏,导致神经肌肉传递功能障碍,从而引发了一系列临床症状[1-3].目前发现MG除了产生抗乙酰胆碱受体抗体外,还产生针对胸腺瘤相关抗原Titin等多种抗原成分的自身抗体.Titin是个大分子蛋白,是维持横纹肌功能的关键组分.以前的自身抗体检测集中在它的一个多肽片段(MGT30)上[4],除了MGT30,MG血清是否还存在Titin其他表位自身抗体呢?探明抗Titin抗体识别抗原表位,特别是优势抗原线性表位对进一步的免疫干预有重要意义.但迄今为止尚缺少相应文献报道.在此通过设计了多个针对Titin蛋白胞外区的多肽序列,用蛋白质微阵列的方法筛选抗Titin抗体识别的优势抗原表位,结果报告如下.
1 材料与方法
1.1 样 本
共收集重症肌无力患者新鲜血清84例,由浙江大学医学院附属第二医院神经内科实验室提供.重症肌无力诊断均由浙江大学医学院附属第二医院神经内科确认.所有样本经ELISA法检测为抗AchR自身抗体阳性.
1.2 多肽设计和蛋白质偶联
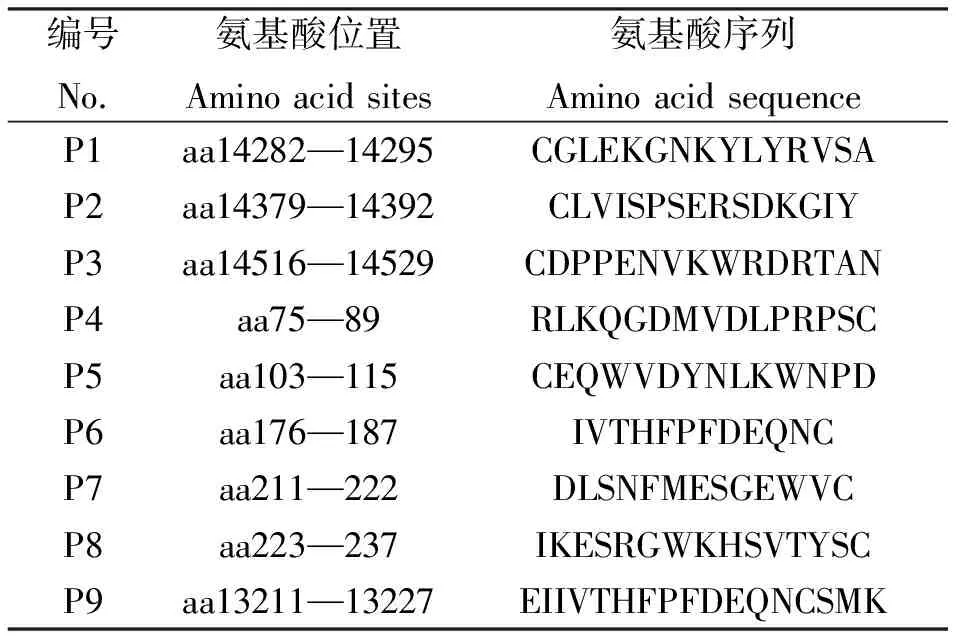
表1 合成多肽序列
根据生物信息学方法设计9条针对Titin蛋白胞外区多肽序列见表1.多肽合成采用固相合成法(SPPS),合成后的多肽再采用琥珀酰亚胺4-[N-甲基马来酸]-1-羧环己烷(SMCC)双功能交联剂在多肽巯基端与牛血清白蛋白(BSA)的氨基端偶联.
1.3 蛋白质微阵列点制
用BCD法调整各蛋白浓度后,用蛋白点样仪按8×12的方式将各多肽-BSA偶联蛋白点样于硝酸纤维膜(100 ng/点),每个多肽检测重复6次,同时设立β-肌动蛋白(β-actin)和甘油醛-3-磷酸脱氢酶(GAPDH)内参照,待干燥后,用5%小牛血清封闭后,备用.
1.4 蛋白质微阵列检测
将待检稀释血清(1∶100,用5%小牛血清稀释)与微阵列芯片反应室温2 h,用含0.5%Tween 20的0.01 mol/L,pH7.4的磷酸盐缓冲液(PBS)洗涤5次,再加入碱性磷酸酶标记的二抗室温1 h,用含0.5%Tween 20的0.01 mol/L,pH7.4的PBS洗涤4次和无Tween 20的0.01 mol/L,pH7.4 PBS洗涤1次,最后加入CDP-star发光底物,曝光显色1 min.将微阵列检测结果转换成TIFF图片格式后,用Array2.0 version软件分析,凡反应信号与对照比较相差1.5倍以上者,为阳性,否则为阴性.
1.5 微阵列结果验证
对微阵列检测阳性结果分别用酶联免疫吸附(ELISA)法进行验证.将各多肽-BSA偶联蛋白以1 μg/mL浓度包被微孔,过夜,次日取出,用含0.5%Tween 20的0.01 mol/L,pH7.4 PBS洗涤3次,用5%小牛血清封闭后,加入100 μL用5%小牛血清1∶100稀释的待检稀释血清,37 ℃反应2 h,洗涤5次,再加入辣根过氧化物酶(HRP)标记的二抗室温1 h,洗涤5次,最后加入邻苯二胺底物100 μL/孔,室温避光显色5~10 min.加入50 μL/孔硫酸终止反应,在490 nm处测各孔吸光度(A).凡A值≥对照1.5倍者,判为阳性,否则为阴性.
2 结 果
2.1 重症肌无力患者血清针对各多肽自身抗体阳性例数
在84例MG血清中,51例抗多肽自身抗体阳性,阳性率为60.71%.经蛋白质微阵列方法筛选,结果表明,在设计的9条多肽抗原中,针对多肽P5、P6和P9的阳性例数高于其他各多肽(见图1).经卡方检验,P<0.05.说明P5、P6和P9是优势识别表位.
2.2 P5、P6和P9识别表位交叉性鉴定
为鉴定P5、P6和P9识别表位有无交叉性,笔者分析了各样本之间的共同阳性情况.发现P5与P9多肽共同阳性有8例(44.4%),而P5与P6多肽、P6与P9多肽间共同阳性例数明显低于P5与P9多肽间(见图2),P<0.05.P5、P6和P9均阳性的血清仅2例.结果表明,自身抗体识别的P5与P9多肽表位存在交叉性.
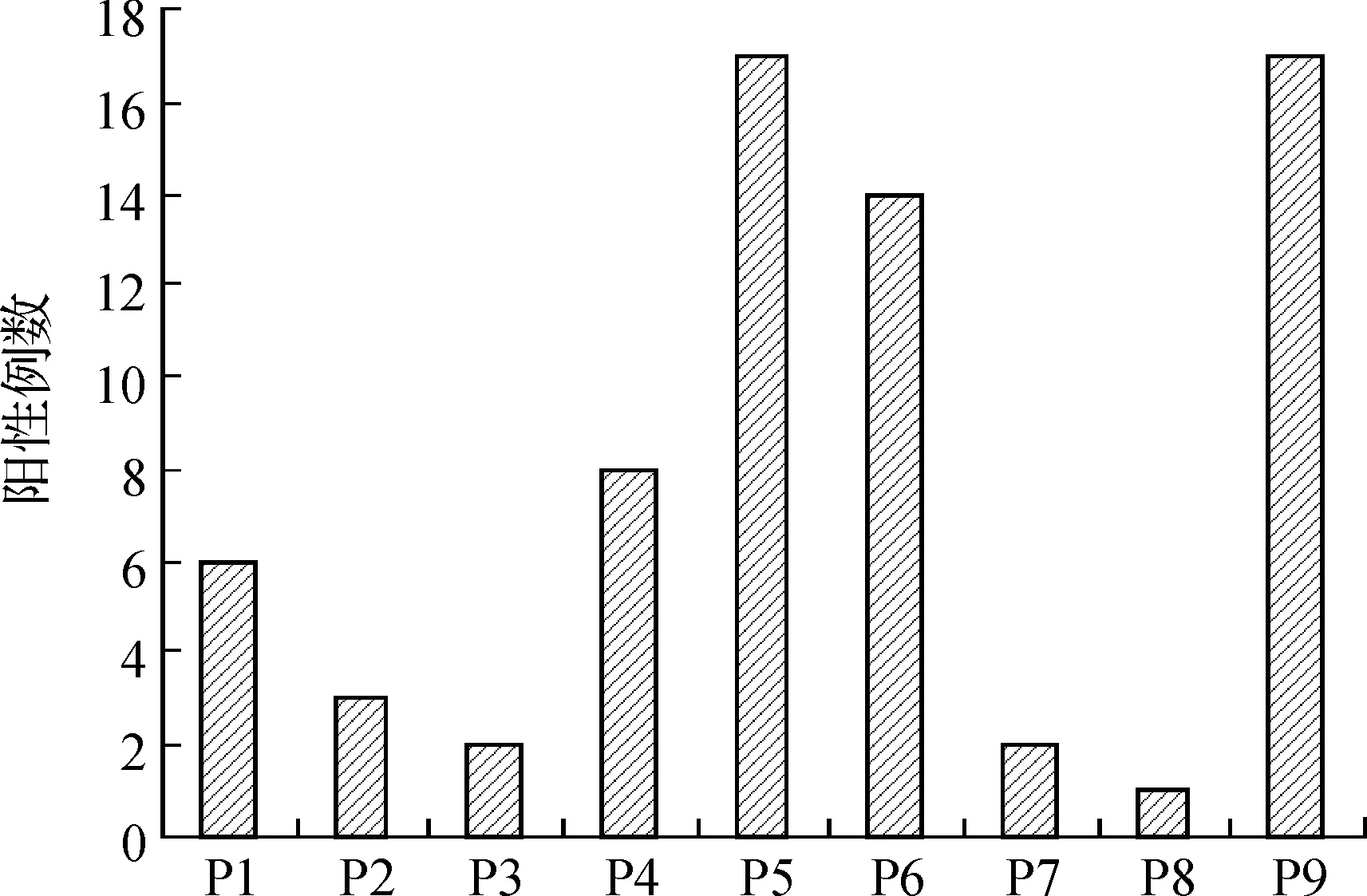
图1 重症肌无力患者血清针对各多肽自身抗体阳性例数Fig. 1 Positive rate of autoantibodies to designed peptides of Titin in myasthenia gravis
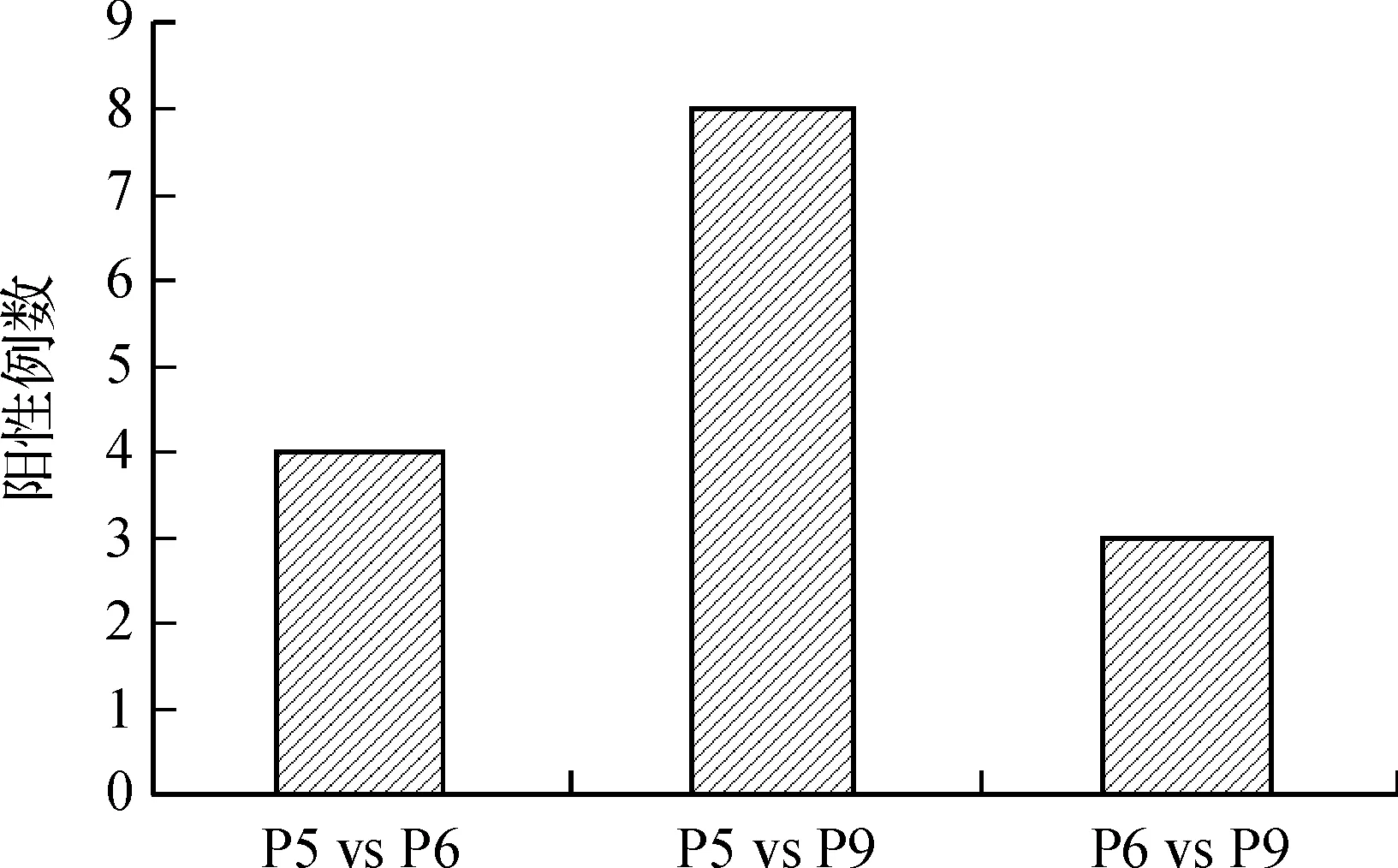
图2 P5、P6和P9识别表位交叉性鉴定Fig. 2 Validation of overlapped epitopes recognized by P5, P6, P9
2.3 ELISA验证试验
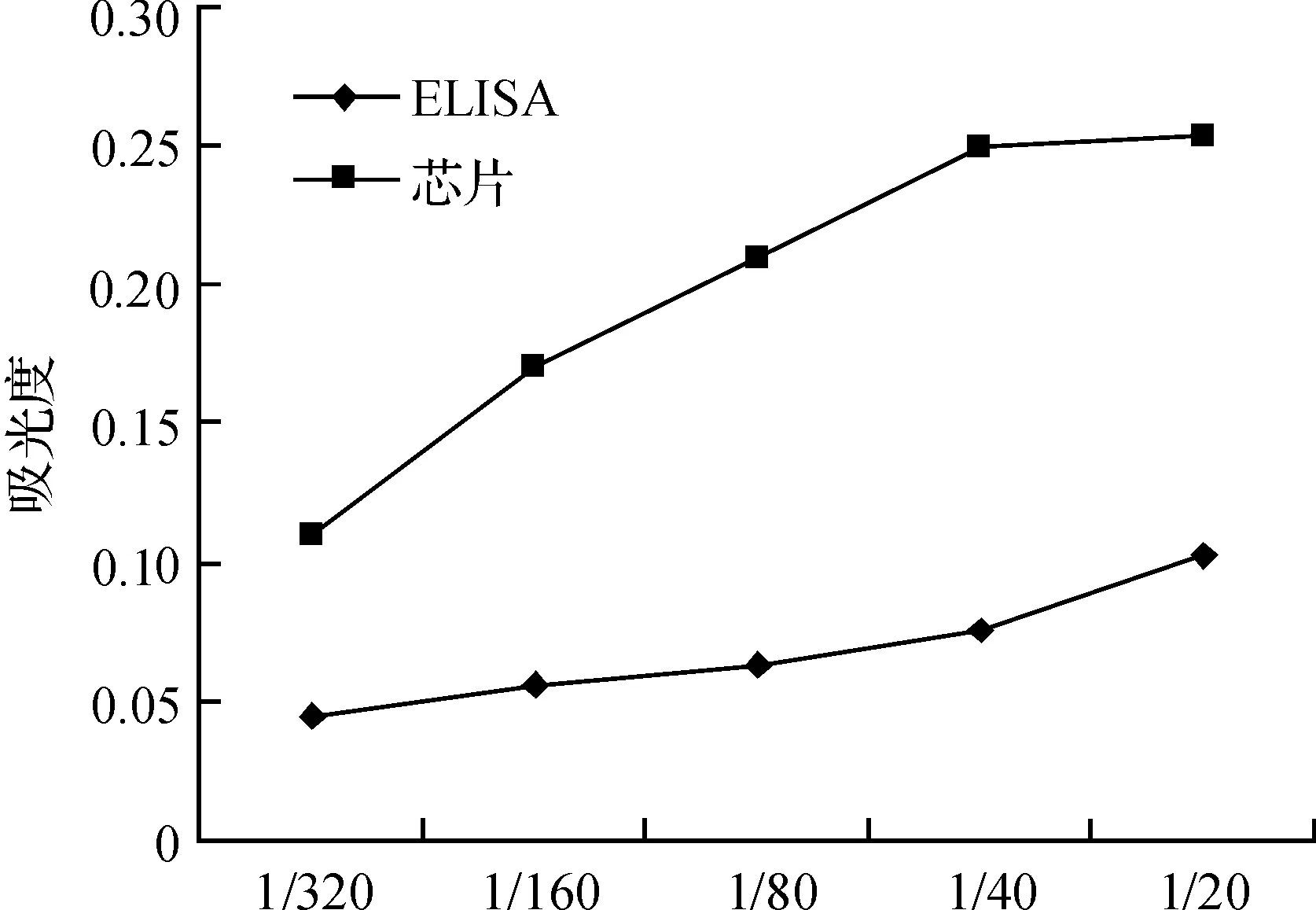
图3 ELISA验证试验Fig. 3 Identification by ELISA assay
将微阵列检测阳性结果分别用ELISA法进行验证,结果100%重复;并且均能被多肽抗原阻断,说明自身抗体与多肽结合呈特异性,蛋白质微阵列方法筛选有效性好,如图3所示.
3 讨 论
重症肌无力个体中,约85%的患者体内存在针对AChR分子的自身抗体,致病性自身抗体的主要结合靶点位于AChR分子亚单位上的主要免疫原性区(main immunogenic region,MIR).依赖抗体的补体溶解作用是AChR分子破坏的主要原因;同时抗体介导的抗原调变作用也加速了AChR分子的内化和溶酶体的降解作用,使得AChR分子的半衰期由7 d降至2 d,体内神经突触后膜上功能性AChR分子的数量急剧减少.在单纯眼外肌型患者体内,仅有50%的血清学阳性率,而这些患者自身性抗体的主要结合靶点是胎儿型AChR分子.胎儿型AChR分子与成人型AChR分子最大的区别是AChR五聚体分子中的亚单位替代了t亚单位.胎儿型AChR分子主要分布于眼外肌,因此这类自身抗体导致了患者单纯眼外肌受累,而无其它相关临床症状出现.重症肌无力患者血清中除乙酰胆碱受体抗体(AchRab)外,还可以检测到其他自身抗体.如抗肌动蛋白(actin)抗体、肌球蛋白(myosin)抗体、辅肌动蛋白(α-actinin)抗体、肌联蛋白(titin)抗体、AChR分子相关瞄定蛋白(mpsyn)抗体和肌肉特异性酪氨酸激酶(muscle specific tyrosine kinase Musk)抗体等.在这些自身抗体中,尤其是Titin在重症肌无力伴胸腺瘤患者和重症肌无力晚期中与疾病进展密切相关[5-7].
调节性T(Treg)细胞在自身免疫性疾病和肿瘤发生发展中起重要作用.现有研究已证实肿瘤组织局部表现为Treg细胞免疫功能抑制,激活Treg细胞可导致动物移植肿瘤消退;而在自身免疫性疾病中Treg细胞免疫功能过度激活.因而抑制Treg细胞功能可能是自身免疫性疾病治疗的新方法.筛选和鉴定抗原特异性Treg细胞是免疫治疗的前提和基础.重症肌无力中95%的患者外周血可检测到抗Titin抗体,表明Titin在重症肌无力患者中是优势识别抗原,提示重症肌无力患者中存在Titin特异性Treg细胞,可从Titin蛋白分子中筛选和鉴定抗原特异性Treg细胞识别的抗原线性表位.Titin是个巨大的微丝状蛋白质,在横纹肌中单一的Titin跨越半个肌小节.Titin从Z-盘状转变为M-线状在肌肉结构、功能和发育过程中起重要作用.尽管Titin分子量巨大,但自身抗体识别的表位主要集中在主要免疫原性区(MIR),MGT30(30 kD).除了MGT30外是否还存在其他识别的表位呢?目前并不清楚.
微阵列和芯片诊断技术具有同时对几十个,乃至数万个基因或蛋白质进行分析,不仅大大减少了分别检测的人力和物力,而且同时分析时克服了实验室的检测误差[8-9].该研究采用生物信息学的手段,在微阵列检测的基础上,分别对单个表位抗体的诊断有效性进行评估,通过对其有效性的不断拟合,克服了单个检测的不足.用该方法从中发现了3个多肽表位在重症肌无力患者中呈优势表达,但其是否为对抗原特异性Treg细胞识别表位需进一步研究.
[1] Skeie G O, Aarli J A, Gilhus N E. Titin and ryanodine receptor antibodies in myasthenia gravis[J]. Acta Neurol Scand Suppl,2006,183:19-23.
[2] Bennett D L, Mills K R, Riordan-Eva P,etal. Anti-MuSK antibodies in a case of ocular myasthenia gravis[J]. J Neurol Neurosurg Psychiatry,2006,77(4):564-565.
[3] Mygland A, Tysnes O B, Matre R,etal. Anti-cardiac ryanodine receptor antibodies in thymoma-associated myasthenia gravis[J]. Autoimmunity,1994,17(4):327-331.
[4] Xu Tonghui, Jun Ding, Shi Yuliang,etal. Effects of myasthenia gravis patients’ sera with different autoantibodies on slow K+current at mouse motor nerve terminals[J]. Neurol Res,2003,25(1):58-62.
[5] Evoli A, Tonali P A, Padua L,etal. Clinical correlates with anti-MuSK antibodies in generalized seronegative myasthenia gravis[J]. Brain,2003,126(10):2304-2311.
[6] Yamamoto A M, Gajdos P, Eymard B,etal. Anti-Titin antibodies in myasthenia gravis: tight association with thymoma and heterogeneity of nonthymoma patients[J]. Arch Neurol,2001,58(6):869-870.
[7] Chen Xiangjun, Jian Qiao, Xiao Baoguo,etal. The significance of Titin antibodies in myasthenia gravis: correlation with thymoma and severity of myasthenia gravis[J]. J Neurol,2004,251(8):1006-1011.
[8] De Wildt R M, Mundy C R, Gorick B D,etal. Antibody arrays for high-throughput screening of antibody-antigen interactions[J]. Nat Biotechnol,2000,18(9):989-994.
[9] Elshal M F, McCoy J P. Multiplex bead array assays: performance evaluation and comparison of sensitivity to ELISA[J]. Methods,2006,38(4):317-323.
