五种血清型柯萨奇病毒的实时荧光RT-PCR检测方法研究
2010-11-22潘良文黄一李想卢钟山吕蓉刘月明高琴张舒亚
潘良文 黄一,2 李想 卢钟山 吕蓉 刘月明 高琴 张舒亚
(1.上海出入境检验检疫局上海200135;2.华东理工大学生物工程学院)
五种血清型柯萨奇病毒的实时荧光RT-PCR检测方法研究
潘良文1黄一1,2李想1卢钟山1吕蓉1刘月明1高琴1张舒亚1
(1.上海出入境检验检疫局上海200135;2.华东理工大学生物工程学院)
在柯萨奇病毒基因组VP1区设计引物和探针,分别建立了特异性检测5种血清型(A9、A16、B2、B3和B5型)柯萨奇病毒(Coxsackievirus)基于MGB探针的实时荧光RT-PCR方法。通过构建的分别适于5种血清型病毒检测的质粒标准分子对建立的检测体系进行了灵敏度分析,确定5种血清型柯萨奇病毒检测体系的检测下限均为2拷贝质粒标准分子DNA。
柯萨奇病毒;实时荧光RT-PCR;质粒标准分子;Taqman-MGB探针
1 前言
柯萨奇病毒(Coxsackievirus)属于微小核糖核酸病毒科(Picornaviridae)肠道病毒属,据其生物学特点分为A组和B组两类。人类感染柯萨奇病毒后分别引起疱疹性咽峡炎(A组)和非麻痹性类脊髓灰质炎(B组)。据调查伴有口咽部疱疹和皮疹的急性热病病例中,79%为柯萨克病毒A组所致,其中较常见的柯萨奇病毒A16型是引起手足口病的主要病原体之一。柯萨奇病毒B组是引发人类病毒性心肌炎的主要病原微生物[1]。
近年来,在北京、河南、沈阳等地先后发生多起柯萨奇病毒感染事件[2~4]。2005年5月河南发生一起柯萨奇病毒B5型疫情,历时34d发病49例,14岁以下儿童罹患率达13.57%[2]。2006年我国卫生部门统计,全国各地共报告手足口病达13637例[4],有相当一部分病例是感染A16型柯萨奇病毒所致。目前尚未研制出有效预防柯萨奇病毒的疫苗,因此加强柯萨奇病毒防控工作尤为重要。为了及时有效地发现病毒感染源,建立高效的柯萨奇病毒检测方法是预防病毒感染和流行的关键技术手段之一。
国内外研究者近几年相继报道了柯萨奇病毒的ELISA方法、普通PCR和实时荧光PCR等方法[5~8]。虽然EL ISA方法能检测早期病人血清中柯萨奇病毒的Ig M和IgG抗体,但该法因抗体制备困难、检测灵敏度不高使应用受到限制。基于核酸的PCR检测技术成本低且快速,已广泛应用于病毒检测。前人的研究多基于Taqma-FAM-TAMRA探针,例如Tana(2008)等建立柯萨奇病毒A16型与肠道病毒71型的多重实时荧光PCR方法[5],但是针对单一血清型柯萨奇病毒实时荧光检测体系的研究相对较少。近来逐渐发展的Taqman-MGB探针实时荧光PCR技术具有特异性好、灵敏度高、稳定性好、结果精确、分辨率高等优点,适用于建立针对单一血清型病毒的检测体系。因此,本研究根据实验室已备柯萨奇病毒株(A 9、A 16、B2、B3和B5型),设计高特异性的引物与M GB探针,建立了分别检测以上5种血清型柯萨奇病毒的快速、高灵敏度实时荧光RT-PCR方法。
2 材料与方法
2.1 供试病毒
灭活柯萨奇病毒A 9、A 16、B2、B3和B5型及含GⅡ型诺如病毒粪便样品均购自中国疾病预防控制中心病毒预防控制研究所,血清Ⅰ、Ⅱ和Ⅲ型脊髓灰质炎病毒灭活疫苗毒株悬浮液由美国加州大学学者惠赠。
2.2 引物与探针设计
在GenBank数据库中分别查找柯萨奇病毒A 9、A 16、B2、B3和B5型cDNA序列,并进行比对和分析,寻找各血清型内相对保守,但与其他血清型柯萨奇病毒以及肠道病毒同源性较低的区域。选择柯萨奇病毒基因组外壳蛋白VP1编码区分别设计引物和探针CoxA 9-F/R/P、CoxA 16-F/R/P、QCoxB 2-F/R/P、QCoxB 3-F/R/P和QCoxB 5-F/R/P,分别适于柯萨奇病毒A 9、A 16、B2、B3和B5型的检测,引物和探针序列信息见表1。
2.3 病毒灭活疫苗、粪便样品中病毒RNA提取
灭活柯萨奇病毒A 9、A 16、B2、B3和B5型,含GⅡ型诺如病毒的粪便样品和血清Ⅰ、Ⅱ和Ⅲ型脊髓灰质炎病毒灭活疫苗样品,使用T IANamp病毒RNA提取试剂盒(天根生物科技<北京>有限公司,Cat.No.:SD 101)进行病毒RNA提取和纯化。
2.4 反转录反应
采用Prime ScriptTM反转录试剂盒(宝生物工程<大连>有限公司,Cat.No.:DRR037A)进行反转录反应。反应体系为10μL,包括1×Buffer,0.5 μL RT Enzym e M ix,0.5μLO ligo(dT)(0.125μM),5μL RNA溶液。反应条件为:37℃,15 m in;85℃,5s。
2.5 PCR反应
2.5.1 普通PCR反应
使用普通PCR试剂盒(东洋纺<上海>生物科技有限公司,Cat.No.:BTQ-201)。PCR反应体系为25μL,其中包括1×PCR Buffer,1.25 U B lend Taq-PlusDNA聚合酶,0.4μM上游引物,0.4μM下游引物,0.2 mM dNTPs,2μL cDNA溶液。引物EV 1/2[10]反应条件为:94℃,2 m in;94℃,30s,60℃,1 m in,72℃,1 m in;45个循环。引物GⅡ-SKF/R[11]反应条件为:94℃,2 m in;94℃,30 s,50℃,30 s,72℃,1 m in;45个循环。
分别取PCR产物15μL,加1.5μL 10×上样缓冲液点样,并加DNA分子量标记DL 2000(宝生物工程<大连>有限公司,D 501A)点样以判断PCR产物的片段大小。电泳检测结果用凝胶分析成像系统记录。
2.5.2 实时荧光PCR反应
使用Prem ix Ex TaqT M试剂盒(宝生物工程(大连)有限公司,Cat.No.:DRR039A)进行实时荧光PCR反应,反应体系见表2。反应条件为:94℃,10 s;94℃,5 s,60℃,31 s,45个循环。所有反应均重复3次。以柯萨奇病毒RNA或其cDNA作为阳性对照,以不含有柯萨奇病毒的RNA或cDNA作为阴性对照,以水代替模板作为空白对照。

表2 柯萨奇病毒实时荧光RT-PCR检测的反应体系
2.6 质粒标准分子构建
分别采用引物QCoxA 9-F/R、QCoxA 16-F/R、QCoxB2-F/R、QCoxB3-F/R和QCoxB5-F/R以表1中目标血清型病毒cDNA为模板进行普通PCR扩增(如:引物CoxA 9-F/R以柯萨奇病毒A 9型cDNA为模板),目的片段大小分别为91bp、174bp、76bp、80bp和145bp。回收纯化以上片段,克隆至pMD-18T载体中(宝生物工程<大连>有限公司),经酶切和测序鉴定确定阳性克隆。得到分别含有柯萨奇病毒A 9、A 16、B2、B 3和B 5型VP1区特异性片段的质粒标准分子pMD-A 9、pMD-A 16、pMD 18-B2、pMD 18-B3和pMD 18-B5。为了建立标准曲线,将构建的五种质粒标准分子分别稀释至106、105、104、103、102、101拷贝/μL,并进一步稀释至5、1拷贝/μL用于检测下限分析。
3 结果
3.1 建立的柯萨奇病毒RT-PCR检测体系特异性测试
为了测试建立的柯萨奇病毒实时荧光RTPCR检测体系特异性,以A 9、A 16、B2、B 3和B 5型柯萨奇病毒及Ⅰ、Ⅱ和Ⅲ型脊髓灰质炎病毒及GⅡ型诺如病毒cDNA为模板,分别采用引物和探针QCoxA 9-F/R/P、QCoxA 16-F/R/P、QCoxB2-F/R/P、QCoxB 3-F/R/P、QCoxB 5-F/R/P,对以上模板进行实时荧光PCR扩增。结果表明,柯萨奇病毒A 9型检测体系只以柯萨奇病毒A 9型cDNA为模板时出现扩增曲线,以其他清型柯萨奇病毒、脊髓灰质炎病毒及诺如病毒cDNA为模板时均未见扩增信号;同样,其他4种血清型柯萨奇病毒RT-PCR检测体系仅在扩增目标血清型病毒cDNA的反应中出现荧光幅增,以其他毒cDNA为模板时均未见扩增信号(表3)。为避免假阴性,用肠道病毒检测引物EV 1/2[10]对柯萨奇病毒和脊髓灰质炎病毒cDNA样品进行检测,均可扩增得到435 bp的目的片段。对GⅡ型诺如病毒cDNA样品使用引物GⅡ-SKF/R[11]进行扩增,得到344 bp的目的片段(数据未在此呈现),表明上述病毒RNA均已成功分离并被反转录为cDNA,可用于PCR扩增。因此,引物和探针QCoxA 9-F/R/P高度特异于A 9型柯萨奇病毒实时荧光RT-PCR检测;引物和探针QCoxA 16-F/R/P、QCoxB2-F/R/P、QCoxB3-F/R/P、QCoxB5-F/R/P也同样地分别特异于目标血清型柯萨奇病毒的检测。
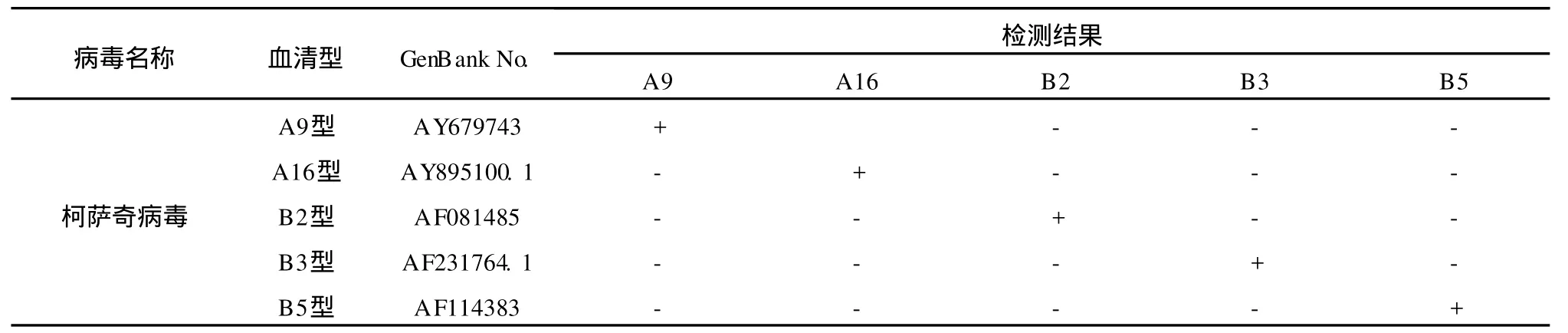
表3 实时荧光RT-PCR检测体系的特异性试验

续表3
3.2 柯萨奇病毒实时荧光RT-PCR检测体系标准曲线制作
分别将质粒标准分子pMD 18-A 9、pMD 18-A 16、pMD 18-B2、pMD 18-B3和pMD 18-B5稀释至106、105、104、103、102、101拷贝/μL,进行实时荧光PCR反应,每一梯度模板重复3次反应,分别制备A 9、A 16、B2、B3、B5型柯萨奇病毒RT-PCR检测体系标准曲线(图1),各梯度平均Ct值及其对应的标准偏差见表4。
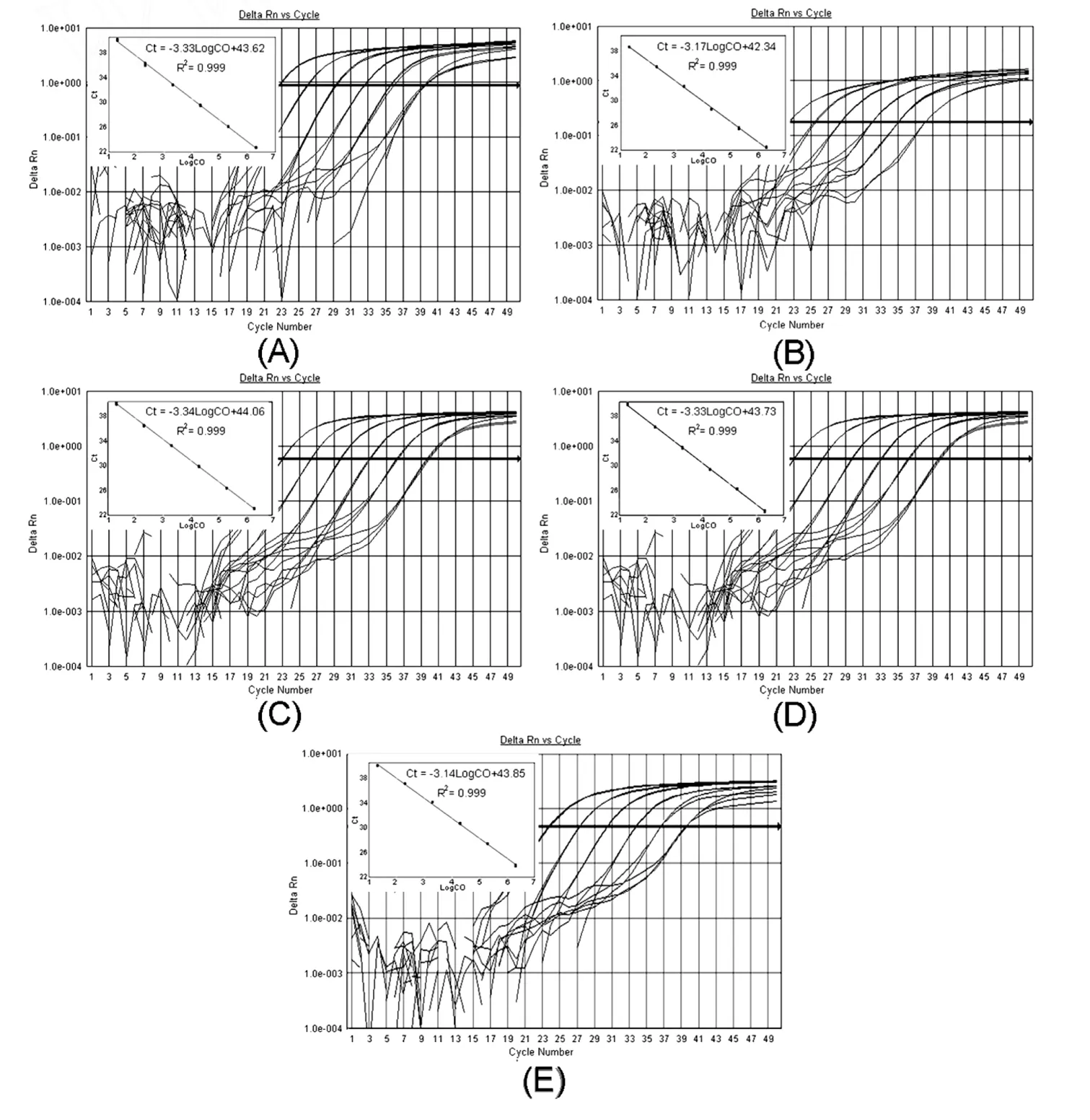
图1 五种血清型柯萨奇病毒实时荧光RT-PCR检测体系的扩增曲线和标准曲线
由图1、表4可以看出,5种血清型病毒检测体系的标准曲线线性关系良好(R2>0.999)。5种血清型柯萨奇病毒回归方程斜率分别为-3.33、-3.17、-3.34、-3.33和-3.14,根据PCR反应效率公式(E=10-1/slope-1,slope为斜率)计算,得反应效率分别为:99.25%、99.66%、107.97%、99.66%和106.54%,各梯度模板的C t值间隔均匀,标准偏差(SD)均低于0.218,可重复性良好,符合PCR反应的动力学要求。因此,以上结果表明本研究建立的检测体系适用于样品定量分析。

表4 柯萨奇病毒五种血清型质粒标准分子检测体系可重复性测试
3.3 建立的柯萨奇病毒实时荧光RT-PCR检测体系灵敏度分析
为了分析建立的检测体系灵敏度,以5、1拷贝/μL质粒标准分子pMD18-A 9为模板,每个浓度各重复10次,均出现荧光幅增,结果1拷贝/μL以上质粒标准分子DNA浓度模板均检测到明显的扩增。以质粒标准分子pMD-B 3、pMD-B 5、pMD-A 9和pMD-A 16的10倍梯度稀释液为模板时,得到相似结果,即1拷贝/μL以上浓度为模板时均可检测出明显的荧光幅增。因此,建立的适于五种血清型柯萨奇病毒检测的实时荧光RT-PCR检测体系的检测下限均可达到2拷贝(模板量为2μL)。
4 讨论
柯萨奇病毒血清型多达30种,且型与型之间基因组变异度较大,因此设计适于柯萨奇病毒所有血清型的通用检测引物非常困难,目前国内外相关的研究报道也较少。为了对柯萨奇病毒实施有效监控,建立快速有效的柯萨奇病毒检测方法至关重要,根据柯萨奇病毒各血清型内相对保守的特点,本研究针对柯萨奇病毒A 9、A 16、B2、B3和B5型分别设计了一套引物和探针。为了保证检测的高特异性和灵敏度,选择了Taqm an-MGB探针用于检测。经测试,5套引物和探针QCoxA 9-F/R/P、QCoxA 16-F/R/P、QCoxB2-F/R/P、QCoxB3-F/R/P和QCoxB5-F/R/P均特异于对应血清型柯萨奇病毒的检测。
基于已构建的柯萨奇病毒A 9、A 16、B2、B3和B5型质粒标准分子,本研究对5种血清型病毒检测体系进行灵敏度分析,得到了5种血清型病毒检测体系灵敏度均为2拷贝质粒DNA,制作的标准曲线线性关系良好(R2>0.999)。Kageyam a T等(2003)[12]建立的诺如病毒实时荧光RT-PCR检测体系灵敏度为10拷贝质粒DNA,标准曲线判定系数R2=0.995/0.998;潘良文等(2004)[13]对贝类产品中诺如病毒检测建立的实时荧光RT-PCR体系检测下限约为6拷贝质粒DNA,标准曲线判定系数R2=0.9944。从以上结果分析表明本研究建立的检测体系灵敏度以及标准曲线结果与以上报道相当。
因此,本研究建立的分别针对柯萨奇病毒A 9、A 16、B2、B3和B5型实时荧光RT-PCR检测方法具有特异性好和灵敏度高的特点,能够满足日常检验检疫的要求。
[1] 陈曙霞,谢龙山,梅尚文,等.柯萨奇病毒BRNA与中和抗体检测在病毒性心肌炎诊断中的意义[J].中华检验医学杂志,2003,26(3):166~168.
[2] 胡宝文,洪玲,雷显英,等.一起柯萨奇病毒B5型暴发的流行病学调查[J].中华流行病学杂志,2008,29(5):112~113,116.
[3] 施弦,刘克红.一起柯萨奇病毒爆发流行的诊治分析[J].浙江实用医学,2004,02:126~127.
[4] www.ggwsj.gov.cn/UploadFile/200805/12/1036166845.doc,2008,5.
[5] Tana E L,Chowa V T K,Quakc S H.Development of multiplex real-time hybridization p robe reverse transcriptase polymerase chain reaction for specific detection and differentiation of Enterovirus 71 and Coxsackievirus A 16[J].Diagnostic Microbio logy and Infectious Disease,2008,61:294~301.
[6] JustinW A B,Patrick SO,et a1.Serotype-specific detection of Coxsackievirus A 16 in clinical specimens by reverse transcrip tion-nested PCR[J].J C linM icro,2001,39(10):3690~3692.
[7] 史雯,卢亦愚,严菊英,等.浙江省2006年柯萨奇B3病毒VP1区基因分析[J].中国卫生检验杂志,2008,18(4):599~601.
[8] Swanink CM,VeenstralL,Poort YA,et al.Coxsackievirus B1-based antibody-capture enzyme-linked immunosorbent assay for detection of immunoglobulin G(IgG),Ig M,and Ig A with broad specificity for enteroviruses[J].J Clin Microbiol,1993,31(12):?3240~3246.
[9] Kutyavin L V,A fonina IA,M ills A.3’Minor groove Binder-DNA p robes increase sequence specificity at PCR extension temperatures[J].Nucleic Acids Research,2000,28(2):655~661.
[10] And reolettiL,Hober D,Belaich S,et al.Rapid detection of enterovirus in clinical specimens using PCR and micro well capture hybridization assay[J].J Virol Methods,1996,62(1):1~10.
[11] Kojima S,Kageyam a T,Fukushi S,et al.Genogroup-specific PCR primers for detection of Nor walk-like virus[J].J Virol Methods,2002,100(1-2):107~114.
[12] Kageyama T,Kojima S,Shinohara M.,et al.Broadly reactive and highly sensitive assay for Norwalk-Like viruses based on real-time quantitative reverse transcription-PCR[J].J Clin Micro,2003,41(4):1548~1557.
[13] 潘良文,张舒亚,李晓虹,等.贝类产品中诺沃克病毒的实时荧光RT-PCR检测方法研究[J].检验检疫科学,2004,14(5):1~3.
Research on Detection of Five Serotypes of Coxsackie Viruses with Real-Time RT-PCR
Pan Liangwen1,Huang Yi1,2,Li Xiang1,Lu Zhongshan1,Lv Rong1,Liu Yueming1,Gao Qin1,Zhang Shuya1
(1.Shanghai Entry-Exit Inspection and Quarantine Bureau,Shanghai,200135;2.School of Bioengineering,East China University of Science and Technology)
Based on the VP1 region of Coxsackivirus genome,primer and probe sets have been designed to detect five serotypes of Coxsackieviruses(A9,A16,B2,B3 and B5)separately by real-time RT-PCR.Plas mid standard molecules suitable for coxsackieviruse A9,A16,B2,B3 and B5 detection were constructed respectively.Limits of detection(LODs)of the developed detection systems for five serotypes of Coxsackieviruse were all 2 copies of plasmid standard molecule DNA.
Coxsackievirus;Plasmid Standard Molecule;Rea1-Time RT-PCR;Taqman-MGB Probe
TS245.7
上海技术标准专项(07DZ05026);国家质检总局科研项目(2007B150);科技部世博科技专项(2009BAK 43B31);上海市科委创新平台服务项目项目(10DZ2294102)
