前列地尔注射液对犬肝脏缺血再灌注损伤的保护作用
2010-11-20贾红燕李辉宇赵浩亮
贾红燕, 李辉宇, 赵浩亮
(山西医科大学第一临床医学院普外科, 太原 030001; *通讯作者,E-mail:haoliangzhao@hotmail.com)
肝缺血再灌注损伤(hepatic ischemia reperfusion injury,HIRI),可引起全身多脏器功能不全,重者导致死亡,是影响疾病预后及病人生存率的重要因素之一[1]。因此,防治肝缺血再灌注损伤是处理各种严重肝脏疾病、提高肝移植成功率的重要措施。近年来,人们尝试多种药物来预防或减轻 HIRI,如心房利钠多肽、FK506等[2],因其价格昂贵,临床上难以推广应用。因此寻找一种价格适中、疗效满意的药物,以预防、减轻 HIRI。前列地尔注射液是由脂微球包裹前列地尔制成的一种稳定剂型。本实验通过建立犬肝缺血再灌注损伤模型,观察了凯时对犬肝脏缺血再灌注损伤的保护作用并进一步探讨其可能机制,为扩展其临床用途提供实验依据。
1 材料与方法
1.1 实验材料 健康雄性杂交犬,12-15月龄,体重20-25kg,由山西医科大学动物中心提供。动物购入后常规喂养,饲养在 YX型实验动物洁净柜中。实验室温度(22±2)℃,湿度 40%-60%,饲喂全价灭菌饲料,自由采食饮水。喂养3d,充分适应环境,然后进入实验。血清 TNF-α检测试剂盒由南京建成生物工程研究所提供,凯时注射液由北京泰德制药有限公司提供。
1.2 动物分组 24只健康杂交犬按数字顺序编码随机分为3组:假手术组,缺血再灌注损伤组(IR组)和前列地尔预处理组(前列地尔组),每组 8只。
1.3 模型制备 参照 Hafez等[3]在犬肝缺血再灌注实验研究中的模型制作方法,建立肝缺血再灌注模型。实验前所有动物禁食8h,自由饮水。6.5%戊巴比妥钠(0.5ml/kg)静脉注射麻醉,腹正中切口入腹,游离肝十二指肠韧带、左右三角韧带,解剖第二肝门;然后经门静脉注射肝素钠(500IU/kg体重)行肝素化后,常温下用无损伤血管钳先阻断第一肝门(包括胆总管),然后阻断第二肝门,肝脏缺血30min后解除阻断,恢复肝脏血流,再灌注60min后关腹。肝缺血再灌注模型建立。假手术组只进行组织解剖、游离,不阻断肝门,IR组和前列地尔组按上述方法制备模型。前列地尔组在肝脏缺血诱导发生前经门静脉持续泵入前列地尔注射液0.5μg/(kg·min),假手术组和IR组静脉注射等量生理盐水。实验中各组犬均完成实验,无死亡病例。
1.4 指标测定 在肝门阻断前、缺血 30 min、再灌注60 min后,分别采集静脉血,以全自动生化分析仪测定血清谷丙转氨酶(ALT)、谷草转氨酶(AST),肿瘤坏死因子(TNF-α)含量测定严格按试剂盒说明书进行。
1.5 统计学分析 实验数据应用 SAS13.0统计软件包对数据进行统计分析,所有数据均以±s表示,三组之间不同时间点测量值采用重复测量的方差分析进行检验,P<0.05为差异有统计学意义。
2 结果
2.1 不同时段各组犬血清 ALT、AST的测定 与假手术组比较,肝门阻断前,IR组及前列地尔组血清ALT、AST浓度差异无统计学意义(P>0.05);缺血30 min及再灌注 60min,IR组及前列地尔组血清ALT、AST浓度差异有统计学意义(P<0.01)。肝门阻断前,IR组与前列地尔组血清 ALT、AST浓度比较差异无统计学意义(P>0.05);缺血 30 min及再灌注 60 min时,两组血清 ALT、AST浓度差异有统计学意义(P<0.01,见表1)。
表1 不同时段各组犬血清ALT,AST(IU/L)的测定值比较 (±s,IU/L,n=8)Tab 1 Changes of ALT,AST in the serum of canine at different time points in 3groups (±s,IU/L,n=8)

表1 不同时段各组犬血清ALT,AST(IU/L)的测定值比较 (±s,IU/L,n=8)Tab 1 Changes of ALT,AST in the serum of canine at different time points in 3groups (±s,IU/L,n=8)
与假手术组比较,*P<0.01;与 IR组比较,#P<0.01
IR组 33.53±1.42 478.92±13.38 981.85±6.12 38.26±1.17 602.09±7.32 1 042.70±6.12前列地尔组 32.61±2.10 218.79±8.81*# 470.71±7.28*# 39.32±1.51 343.81±8.65*# 623.72±8.28*#
2.2 不同时段各组犬血清 TNF-α的测定 肝门阻断前,3组血清 TNF-α浓度比较差异无统计学意义(P>0.05);缺血 30 min及再灌注 60 min时,3组血清 TNF-α浓度差异有统计学意义(P<0.01)。肝门阻断前,前列地尔组与 IR组血清 TNF-α浓度比较差异无统计学意义(P>0.05);缺血 30 min及再灌注 60 min时,前列地尔组血清 TNF-α浓度显著低于IR组(P<0.01),见表2。
表2 不同时段各组犬血清 TNF-α的测定值比较 (±s,pg/ml,n=8)Tab 2 Changes of TNF-αin the serum of canine at different time points in 3 groups (±s,pg/ml,n=8)
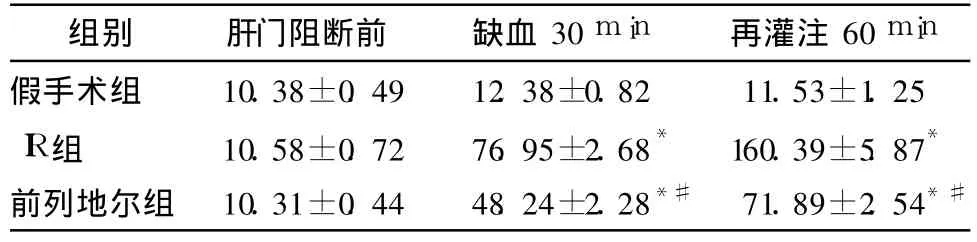
表2 不同时段各组犬血清 TNF-α的测定值比较 (±s,pg/ml,n=8)Tab 2 Changes of TNF-αin the serum of canine at different time points in 3 groups (±s,pg/ml,n=8)
与假手术组比较,*P<0.01;与 IR组比较,#P<0.01
IR组 10.58±0.72 76.95±2.68* 160.39±5.87*前列地尔组 10.31±0.44 48.24±2.28*# 71.89±2.54*#
3 讨论
休克、肝脏重大手术、严重肝外伤的处理、肝移植等常不可避免地引发肝脏缺血再灌注损伤(HIRI),可使肝代谢解毒能力降低、微循环阻力升高,严重者可导致肝功能衰竭、移植器官无功能(primary graft nonfunction,PGNF)和多器官功能不全综合征(multiple organ dysfuction syndrome,MODS)。因此,对HIRI的研究,具有重要的理论意义和临床实用价值。
前列地尔是一种很强的扩张血管和抑制血小板聚集的活性物质,有明显地阻止肝细胞坏死的作用,并通过稳定溶酶体,增加细胞膜的稳定性,还可以缓解平滑肌痉挛,使血管扩张,增加肝血流量,降低肝动脉和门静脉压,改善肝脏循环,抑制活性氧的产生和免疫抑制作用,降低血清 TNF-α活性,有利于促进肝组织的修复和重建[4]。前列地尔脂微球载体制剂是根据药物制剂传递系统理论(DDS)研究开发的具有国际领先地位的脂微球靶向制剂。其优点是跨越生理屏障技术、控制释放技术、靶向技术。脂微球是理想的药物载体,携载前列地尔可以延长循环半衰期,加强前列地尔作用的靶向性,能有效地靶向PMN、血小板及血管内皮细胞,从而提高药效,减少用量,减轻毒副反应,达到更好的治疗效果[5]。
本实验表明:IR组再灌注 60 min后ALT和AST明显增高,说明肝细胞发生严重的损伤,而在肝缺血再灌注期间持续泵入前列地尔注射液,可以有效减少肝细胞 ALT和AST的漏出,减轻肝细胞结构的损伤。因此前列地尔注射液对缺血再灌注肝细胞有良好的保护作用。
近年来,肿瘤坏死因子(tumor necrosis factor,TNF-α)在组织缺血再灌注损伤过程中特别是在细胞凋亡中的作用[6,7],也逐渐引起人们的重视。肝脏富含 TNF-α受体,是 TNF-α作用的主要靶器官[8]。TNF-α可以通过多种机制诱导肝脏缺血再灌注损伤[9,10]。肝脏缺血再灌注后,TNF-α的过度表达可引起大量肝细胞的炎性坏死,引起肝血窦微循环障碍[7]。在我们的实验中,IR组再灌注后60 min TNF-α的过度表达说明 TNF-α直接或间接地造成了犬肝脏的缺血再灌注损伤[11]。而前列地尔组由于应用前列地尔使得 Kuffer细胞释放 TNF-α被抑制。
本实验我们采用了从门静脉给药的方式,这与文献报道的最佳途径是门静脉给药一致[1],因为从门静脉插管给药,经门静脉注入 PGE1,不经过外周循环,不会在肺内失活,并且能直接将药物输达靶细胞,使药物选择性地在需要部位发挥作用,可减少用量,减少副作用。但该给药方式手术操作复杂,可能会加重对犬的创伤,而前列地尔注射液采用了脂微球技术,大大地减少了肺灭活。因此我们认为从外周静脉给药也是可行和有效的。本实验的另一个特点是前列地尔注射液给药时间选择在肝脏缺血诱导发生前,同时使用静脉泵持续给药,保证在肝脏缺血及再灌注期间维持相对恒定的肝内 PGE1血药浓度。总之,前列地尔注射液可以防止肝脏缺血再灌注损伤,较 PGE1更具靶向性、持续性和高效性。前列地尔脂微球这种保护作用,可能为临床缺血预处理提供一个新的药物,具有广阔的临床应用前景,值得进一步研究。
[1] Desai KK,Dikdan GS,Shareef A,etal.Ischemic preconditioning of the liver:a few perspectives from the bench to bedside translation[J].Liver Transpl,2008,14(11):1569-1577.
[2] Bae EA,Hyun YJ,Choo MK,etal.Protective effect of fermented red ginseng on a transient focal ischemic rats[J].Arch Pharm Res,2004,27(11):1136-1140.
[3] Hafez T,Moussa M,Nesim I,etal.Theeffect of intraportal Prostaglandin E1 on adhesion molecule expression,inflammatory modulator function,and histology in canine hepatic ischemia/reperfusion injury[J].J Surg Res,2007,138(4):88-99.
[4] 高太俊.前列地尔治疗重度黄疸型病毒性肝炎的临床疗效观察[J].医学理论与实践,2004,17(3):262.
[5] 白丽娜,周曼,李月红.前列地尔脂微球载体制剂的药理作用机制的研究进展[J].中日友好医院学报,2007,22(1):47-50.
[6] Ma M,Ma ZH.Effect of tumor necrosis factor-alpha in rats with hepatic ischemia reperfusion injury[J].Hepatobiliary Pancreat Dis Int,2008,7(3):296-299.
[7] Teoh N,Leclercq I,Pena AD,etal.Low dose TNF-αprotect s against hepatic ischemiareperfusion injury in mice:implications for preconditioning[J].Hepatology,2003,37(1):118-128.
[8] 张娜,张连元.肿瘤坏死因子-α在缺血再灌注肝损伤中的作用[J].中国综合临床 2006,22(4):380-382.
[9] López-Neblina F,Toledo-Pereyra LH,Toledo AH,etal.Ryanodine receptor antagonism protects the ischemic liver and modulates TNF-alpha and IL-10[J].J Surg Res,2007,140(1):121-128.
[10] 王志忠,鲁华玉,崔玉芬.活性氧在 TNF信号传导中的作用[J].科学技术与工程,2004,4(1):49-54.
[11] Wilasrusmee C,Siritheptawee S,Kanchanapanjapon S,etal.Ultrastructural changes in cirrhotic and noncirrhotic patients due to hepatectomy[J].J Hepatobiliary Pancreat Surg,2004,11:266.
