丁苯酞对缺氧/复氧诱导大鼠皮层神经元损伤的保护作用
2010-11-20魏光宇
李 静, 魏光宇
(1山西医科大学微生物与免疫教研室, 太原 030001; 2山西省儿童医院急救中心)
缺血性脑卒中的病理生理机制十分复杂,神经细胞凋亡在缺血性脑损伤级联反应过程中起着十分重要的作用[1]。细胞内 Ca2+超载是缺血性脑损伤的发病机制之一,是凋亡过程中的关键因素,也是各种有害因素致神经元死亡的最后共同通路。
丁苯酞(3-n-butylphthalide)是一类新型抗脑缺血药物,研究结果表明,丁苯酞能缩小大鼠大脑中动脉阻断后脑梗死面积,减轻脑水肿[2],维持血脑屏障的完整性[3],增加缺血区局部脑血流[4]。本研究通过观察丁苯酞对低氧-复氧大鼠皮层神经元的干预作用,进一步研究丁苯酞抗脑缺血损伤的作用机制。
1 材料与方法
1.1 材料
1.1.1 动物 出生24h内的Wistar大鼠,由山西医科大学动物实验中心提供。
1.1.2 主要器材和试剂 超净工作台 SW-CJ-1F(苏净集团苏州安泰空气技术有限公司);CO2恒温培养箱 (Forma Series 2,USA);光学显微镜(Olympus,日本);台式离心机 LDZ5-2(北京医用离心机厂);电热恒温水浴箱(北京医疗设备厂);酶标仪(美国 Molecular Devices公司);激光扫描共聚焦显微镜(SP5 Leica,德国);丁基苯酞(dl-NBP)(石家庄制药厂),纯度>98%,临用前用聚乙二醇 400(polyethylene glycol 400)溶解至 0.01-1.0μmol/L备用,胆囊收缩素八肽CCK-8(Dojindo),L-多聚赖氨酸、胰蛋白酶、阿糖胞苷、二甲基亚砜(均为Sigma公司),DMEM/F12培养基、胎牛血清(均为Gibco公司),钙离子荧光染料 Fluo-3/AM(Biotium)、PBS、DHank液、无镁-BSS(平衡盐溶液),Fluo-3/AM用二甲基亚砜溶解配制成 1 mmol/L贮备溶液,避光-20℃保存待用。实验在室温(20-25℃)下进行。
1.2 方法
1.2.1 乳鼠皮层神经元原代培养 取新生24h内的Wistar大鼠,乙醚麻醉后,酒精浸泡消毒,断颈,无菌条件下取出脑组织置于 0-4℃的D-Hank液中,分离大脑皮层,剥离脑膜,将大脑皮层组织剪碎成1-3mm3大小的组织块,转移至37℃0.125%的胰蛋白酶,用滴管小心吹打后加入神经元完全培养液(15%胎牛血清 +85%DMEM/F12培养基)终止胰酶消化,低温下静置 5-10 min,收集上清液,过200目尼龙网至50ml离心管中,用 D-Hank液重悬沉淀的组织,吹打直至所有组织均形成单细胞悬液,同上静置并收集上清液,重复3次。将收集的细胞悬液经1000r/min离心5min,弃上清,用神经元完全培养液混悬离心后沉淀的细胞,以细胞密度为5×104/ml的浓度,接种于预先用L-多聚赖氨酸包被的96孔板、培养皿中,放入 37℃,含5%(体积分数)CO2培养箱中培养。24h后加入阿糖胞苷(10μmol/L)作用24h,以抑制神经胶质细胞生长。细胞隔天换全量/半量完全培养液,培养至第7天根据细胞生长情况用于试验。
1.2.2 缺氧/复氧大鼠皮层神经元模型的建立及实验分组取培养7d的神经细胞,吸除原培养液,加入无糖 Earles液,置于密封性能好的缺氧盒中,通入95%N2和5%CO2混合气体30 min(流量1.5L/min),随后密闭缺氧盒,置 37℃、5%CO2培养箱中孵育 3 h,在此基础上,再换成正常培养液(作为复氧液)继续放入 37℃、5%CO2培养箱中孵育 12 h,即为缺氧/复氧模型。实验分为:①对照组:用正常培养液孵育,不缺氧;②缺氧/复氧模型组;③0.01μmol/L丁苯酞组:建立缺氧/复氧模型后,加入0.01 μmol/L丁苯酞孵育 24 h;④0.1μmol/L丁苯酞组:建立缺氧/复氧模型后,加入0.1μmol/L丁苯酞孵育24h;⑤1.0μmol/L丁苯酞组:建立缺氧 /复氧模型后,加入 1.0μmol/L丁苯酞孵育 24 h。
1.2.3 CCK-8比色分析将原代培养至第7天的皮层神经元,按上述分组进行药物干预后,将96孔板的培养液换新,避光条件下向 96孔板中间 60个孔加入CCK-810μl/孔,37℃孵育2h后,用酶标检测仪在450nm波长处测各孔的吸光度值 OD,以标准物的浓度为纵坐标,OD值为横坐标,绘出标准曲线。使用软件进行分析,根据样品的OD值由标准曲线查出相应的浓度,再乘以稀释倍数,其中每组设8个孔,同时设不加细胞的空白孔。
1.2.4 皮层神经元游离钙离子浓度的测定 以上各组按要求培养 24 h后,弃上清,用 PBS液洗 3次,最后一次留 1 ml PBS,所有组加入终浓度为5μmol/L Fluo-3/AM,37℃避光负载培养的神经细胞40 min,用 PBS液洗脱多余染液 3次后加入 1 ml无镁-BSS液,置于激光共聚焦荧光显微镜载物台上,用激发波长488 nm、发射波长526 nm,按上述分组进行扫描,观察细胞内静息钙离子水平。每 5 s扫描 1次,共扫描 15次。FluoviewVersion 4.3软件采集分析图像,每组随机选取 12个细胞,以每个细胞得到的15个荧光强度值的均值为此细胞的平均荧光强度值。用相对荧光强度代表细胞内钙水平,荧光强度高即表示细胞内钙浓度高。
2 结果
2.1 CCK-8检测原代培养大鼠神经皮层神经元细胞活力 CCK-8法检测显示,对照组、模型组、0.01 μmol/L丁苯酞组、0.1μmol/L丁苯酞组、1.0μmol/L丁苯酞组大鼠皮层神经元相对细胞活力分别为99.6,55.6,69.6,73.2,79.7。随着丁苯酞浓度的增高,细胞活力逐渐升高。
2.2 激光共聚焦显微镜检测原代培养大鼠神经皮层神经元钙离子浓度 对照组中神经元胞质中游离Ca2+荧光强度较低;模型组神经元胞质中游离Ca2+荧光强度明显增高,与对照组相比差异有统计学意义(P<0.01);丁苯酞 0.01,0.1,1μmol/L组神经元胞质中游离Ca2+荧光强度与模型组相比明显降低,差异有统计学意义(P<0.01),丁苯酞 0.01,0.1,1μmol/L组神经元胞质中游离 Ca2+荧光强度与对照组相比增高,差异有统计学意义(P<0.01,见表1)。
3 讨论
缺血性脑血管病是由于复杂的级联过程而导致神经元损伤和血管活性改变。在损伤过程中所发生的级联反应包括能量衰竭、磷脂酶的活化、钙平衡紊乱、氧化应激反应和花生四烯酸的释放等。以往多采用在体急性缺血损伤模型来观察细胞形态改变,研究损伤机制,本研究通过采用大鼠皮层神经元原代离体培养,研究丁苯酞是否对神经元有直接保护作用及其发挥作用的具体机制。正常状态下,Ca2+参与细胞膜生物电活动和细胞生化过程,对细胞的正常功能起着重要的作用。正常神经元内游离Ca2+浓度非常低,仅为10-8-10-7mol/L。近年来有研究表明,脑缺血发生时,细胞膜去极化引起胞质内钙增高,Ca2+达到一定浓度后,可启动一系列病理生理机制损伤神经细胞,严重影响神经细胞的结构和功能,并可导致细胞凋亡,甚至坏死。因此细胞内钙超载在缺血后神经元凋亡发生中起着关键作用,抑制钙离子浓度可阻止或减弱细胞凋亡的发生[5-7]。
丁苯酞作为抗脑缺血一类新药,对其作用机制的研究已经比较深入,它不仅能够扩张受损脑部微血管,还能改善能量供应和自由基损伤,并且可以对抗迟发性损伤中的炎性反应[8]。改善微循环、改善能量代谢,以及对抗炎症反应被认为是其产生良好抗脑缺血作用的三大主要途径。由于扩张微血管可以改善神经细胞糖氧供应,从而间接提高线粒体功能,本研究采用体外培养神经细胞,排除药物在微循环方面的作用可能带来的影响。
表1 激光共聚焦显微镜检测大鼠皮层神经元细胞内Ca2+紫外激发比值 R (±s)Tab 1 Ultraviolet burst ratio of intra-cellular calcium ion in rat cortical neurons detected by confocal laser scanning microscope
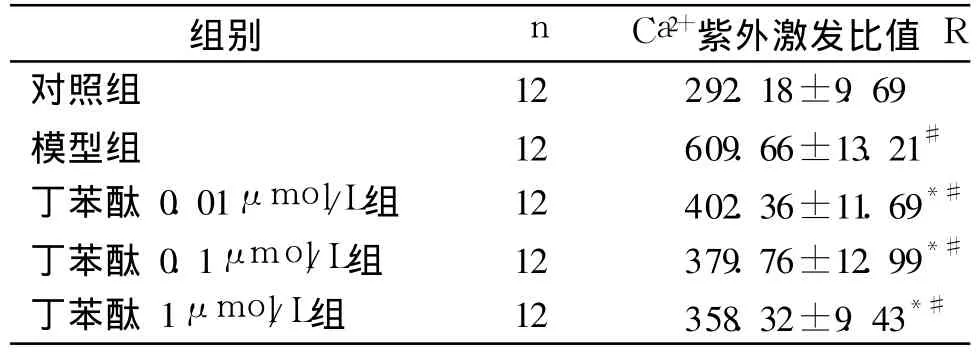
表1 激光共聚焦显微镜检测大鼠皮层神经元细胞内Ca2+紫外激发比值 R (±s)Tab 1 Ultraviolet burst ratio of intra-cellular calcium ion in rat cortical neurons detected by confocal laser scanning microscope
与对照组相比,#P<0.01;与模型组相比,*P<0.01
丁苯酞 0.1μmol/L组 12 379.76±12.99*#丁苯酞 1μmol/L组 12 358.32±9.43*#
本实验结果表明,经缺氧/复氧处理后,神经元活力明显下降,Ca2+浓度随之大幅度增高,给予一定浓度丁苯酞可以明显增高神经元活力,且能明显降低神经元胞质内游离钙离子平均荧光强度。说明丁苯酞可降低由缺氧/复氧诱导的皮层神经元胞质内游离钙浓度过高,减轻细胞损伤,这提示丁苯酞对神经细胞缺血性损伤具有拮抗作用,这种作用机制可能与其抑制细胞内钙超载有关。
[1] Peroulis N,Kourounakis AP,Yiangou M,etal.Effects of the novel non-steroidal anti-inflammatory compound[N-(2-thiolethyl)-2-{2-[N'-(2,6-dichlorophenyl)amino]phenyl}acetamide on cytokines and apoptosis in ischaemic rat brain[J].Arzneimittelforschung,2006,56(10):688-694.
[2] Xu HL,Feng YP.Inhibitory effects of chiral 3-n-butylphthalide on inflammation following focal ischemic brain injury in rats[J].Acta Pharmacol Sin,2000,21(5):433-438.
[3] Chang Q,Wang XL.Effects of chiral 3-n-butylphthalide on apoptosis induced by transient focal cerebral ischemia in rats[J].Acta Pharmacol Sin,2003,24(8):796-804.
[4] Zhang Y,Wang L,Li J,etal.2-(1-Hydroxypentyl)-benzoate increases cerebral blood flow and reduces infarct volume in rats model of transient focal cerebral ischemia[J].J Pharmacol Exp Ther,2006,317(3):973-979.
[5] Sheldon C,Diarra A,Cheng YM,etal.Sodium influx pathways during and after anoxia in rat hippocampal neurons[J].J Neurosci,2004,24(49):11057-11069.
[6] Bano D,Nicotera P.Ca2+signals and neuronal death in brain ischemia[J].Stroke,2007,38(2 Suppl):674-676.
[7] Gong QH,Wang Q,Shi JS,etal.Inhibition of caspases and intracellular free Ca2+concentrations are involved in resveratrol protection against apoptosis in rat primary neuron cultures[J].Acta Pharmacol Sin,2007,28(11):1724-1730.
[8] Peng Y,Xu S,Chen G,etal.Dl-3-n-Butylphthalide improves cognitive impairment induced by chronic cerebral hypoperfusion in rats[J].J Pharmacol Exp Ther,2007,321(3):902-910.
