不同补料发酵方式对重组毕赤酵母高密度培养的影响
2010-11-14洒荣波石贵阳唐瑜菁
洒荣波,石贵阳,唐瑜菁
(1.泰山医学院生物科学系,山东泰安271016;2.江南大学生物工程学院,江苏无锡214036)
不同补料发酵方式对重组毕赤酵母高密度培养的影响
洒荣波1,石贵阳2,唐瑜菁1
(1.泰山医学院生物科学系,山东泰安271016;2.江南大学生物工程学院,江苏无锡214036)
目的:研究5L发酵罐中葡萄糖补料方式对重组毕赤酵母高密度培养的影响,为大规模工业化生产奠定基础。方法:葡萄糖分批发酵阶段结束以后,以不同的流加策略流加补料培养基。结果:分批发酵初始葡萄糖最佳浓度为10g/L;采用间歇补料和恒速流加补料方式培养毕赤酵母,发酵结束后菌体细胞干重分别为33.2g/L和41.5g/L,而采用指数流加补料方式,发酵前期和发酵后期控制比生长速率分别为0.20h-1和0.15h-1,发酵结束后菌体细胞干重可达53.4g/L。结论:采用分阶段控制比生长速率的发酵策略,发酵结束后菌体细胞干重远远大于间歇补料和恒速流加补料发酵策略。
重组毕赤酵母,高密度培养,补料方式
甲醇营养型巴斯德毕赤酵母是一种具有表达率高、遗传稳定、产物可分泌等优点的外源分泌蛋白和胞内蛋白表达的一种优秀宿主[1]。它能够生长在以甲醇作为唯一碳源和能源的培养基上,拥有一条高效诱导的甲醇利用途径。目前巴斯德毕赤酵母表达系统在国内外的应用非常广泛,到目前为止,已有数百种外源蛋白在该系统中得到表达[2]。按照Invitrogen公司对毕赤酵母的研究,外源蛋白在毕赤酵母中的表达分两步,即菌体生长和蛋白诱导表达。先在以甘油或葡萄糖为碳源的培养基中培养菌体,达到一定OD值后无菌离心,收集菌体后在以甲醇为唯一碳源的培养基中进行诱导表达。高密度发酵是基因工程菌提高外源蛋白表达水平的一种重要策略,迄今已有许多蛋白通过高密度发酵获得高表达量[3-4]。毕赤酵母发酵产物的累积不会对自身产生毒副作用,且毕赤酵母的表达菌株很容易从摇瓶培养扩大到大批量高密度发酵,不影响外源基因的表达水平。这两点注定了毕赤酵母具有可用于高密度发酵的巨大潜力[5]。笔者选取了一种廉价的工业化培养基,并对其进行优化,使得此培养基在最佳培养条件下生产毕赤氏酵母的生物量达到最大。本文报道了在5L发酵罐中以不同补料方式对重组毕赤酵母高密度发酵的影响,为大规模工业化生产奠定了基础。
1 材料与方法
1.1 实验材料
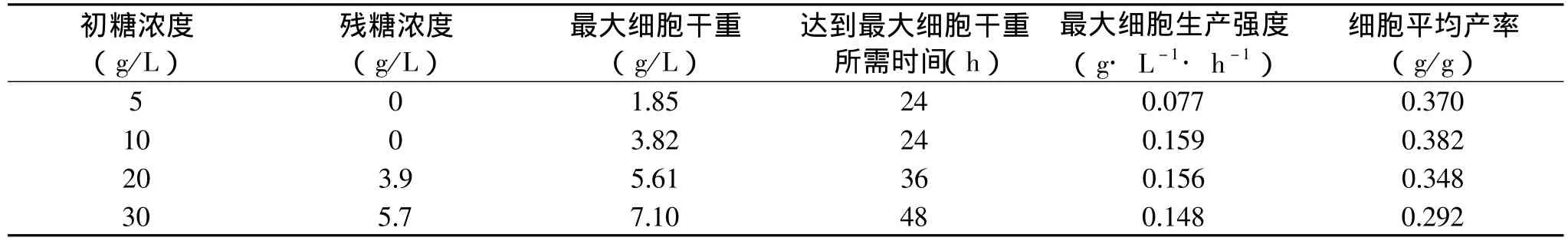
表1 不同葡萄糖初始浓度的动力学参数
巴斯德毕赤氏酵母 pichia pastoris KM71(his4 arg4 aox1∷ARG4) 表达载体pPIC9k为Invitrogen公司产品,外源基因为粗糙脉孢菌(Neurospora crassa)植酸酶基因,载体呈线性整合在染色体上,由江南大学工业生物技术教育部重点实验室课题组构建;平板保存及活化培养基 YPD固体培养基(葡萄糖2%,蛋白胨2%,酵母膏1%,琼脂2%,pH自然);种子培养基 YPD液体培养基(葡萄糖2%,蛋白胨2%,酵母膏1%,pH自然);发酵基础培养基 葡萄糖1%,KH2PO40.7%,MgSO4·7H2O 0.03%、FeSO4· 7H2O 0.05%、MnSO4·H2O 0.05%,用25%氨水调节pH为5.5;发酵补料培养基 葡萄糖40%,MgSO4· 7H2O 10g/L;培养基灭菌条件 0.1MPa,121℃下灭菌20min。
1.2 实验方法
1.2.1 种子活化方法 见参考文献[2]。
1.2.2 种子培养基的摇瓶培养法 见参考文献[2]。
1.2.3 葡萄糖分批发酵培养方法 将摇瓶种子按10%接种量接入装有3L发酵基础培养基的5L发酵罐中进行发酵,通气量为1.5vvm,在碱液瓶中加入25%(V/V)浓氨水,发酵过程中培养液pH控制在5.5。空气流量为1.5vvm,转速为800r/min时,接种前设定溶氧量(DO)为100%,当初始葡萄糖耗尽后开始流加补料液。
1.2.4 葡萄糖流加方法 在葡萄糖分批发酵阶段结束以后,以不同的流加策略流加补料培养基直到菌体培养至所需密度。在此阶段,依旧通过流加25%氨水保持pH恒定在5.5,调节通气量和搅拌转速使溶氧维持在20%以上。
1.3 分析方法
1.3.1 酵母细胞密度测定 见参考文献[2]。
1.3.2 菌体生物量的测定 见参考文献[2]。
1.3.3 葡萄糖浓度的测定 DNS法[6]。
1.3.4 pH的测定 发酵罐pH电极在线检测。
1.3.5 溶氧(DO)的测定 发酵罐溶氧电极在线检测。
2 结果与讨论
2.1 5L发酵罐分批培养初始葡萄糖浓度的确定
为了获得更高的葡萄糖细胞得率,必须使初始培养基中的葡萄糖浓度能使培养菌以较快的速度产生菌体,为此进行了葡萄糖初始浓度的摇瓶实验。实验结果及动力学参数如图1及表1所示。从中可以看出,随着葡萄糖浓度的升高,最终细胞干重(DCW)也随之增加,但最大细胞生产强度及葡萄糖的细胞得率却有所不同,葡萄糖浓度为10g/L时的最大细胞生产强度及细胞平均产率最大,30g/L浓度的葡萄糖最大细胞生产强度及细胞平均产率最低。综合考虑,我们选择5L罐分批培养时的初始葡萄糖浓度为10g/L。

图1 不同葡萄糖初始浓度与菌体生长的关系
2.2 生长期碳源葡萄糖补料方式的探索基因工程菌发酵应在保证基因表达的前提下尽量提高菌体密度,这样才能提高工作效率以利于后期的分离、纯化[7]。在分批培养的生长期进行流加补料可实现毕赤酵母工程菌的高密度培养,为产酶期提高植酸酶表达分泌水平奠定坚实基础。我们实验了生长期葡萄糖的不同流加方式对工程菌生长的影响。
2.2.1 间歇补料发酵 间歇补料是一种常见的流加发酵方式,实验中补料量70mL/次,64h结束发酵,总共补料量为560mL葡萄糖,折合葡萄糖224g,实验过程的动力学曲线如图2所示。从图中可以看出,随着发酵进行,补料开始时剩余葡萄糖量随之增多。考虑到补料量及菌体培养的经济性,我们选择在64h时停止发酵,最终达到的酵母细胞干重为33.2g/L。
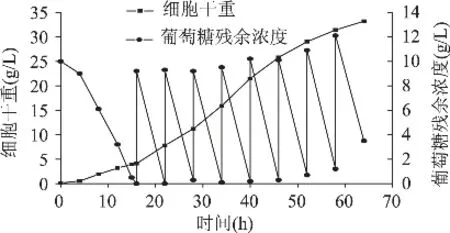
图2 间歇补料发酵的动力学曲线
2.2.2 恒速流加补料发酵 实验中在分批发酵结束后,以5mL·L-1·h-1的恒定速率流加补料液,每4h取样测定发酵液中的残糖浓度及菌体密度,56h时补料结束,共补料600mL,折合葡萄糖240g。实验过程的动力学曲线如图3所示。从图中可以看出,补料开始后的24h内,菌体密度增加较快,细胞干重基本上呈线性增加,补入的葡萄糖也全部耗尽,发酵液中的残糖基本维持在0.2g/L附近;补料24h之后,发酵液中的残糖浓度开始增加,随着补料时间的延长,残糖浓度越来越高,在56h时残糖已高达2.8g/L,因此此时停止补料,发酵结束,最终细胞干重可达41.5g/L。
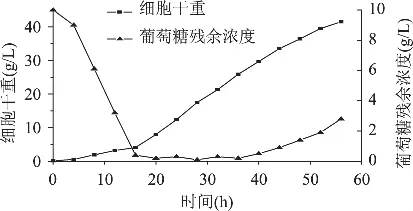
图3 恒速补料发酵的动力学曲线
2.2.3 指数流加发酵 Yee L[8]认为目前最成功的基因工程菌高密度培养的方法是指数流加法。理想的微生物生长是菌体量相对时间以指数函数增加,故可以使流加物料量以时间的指数函数增加。指数流加进料速率与时间的关系为

式(1)中,F(t)为t时刻葡萄糖的流加速率,L·h-1;V0为补料开始时刻的发酵液体积,L;X0为补料开始时的菌体浓度,g·L-1;μset为设定的比生长速率,它要满足的一个条件是:μset<μmax;YX/S为菌体对底物的得率系数;t是发酵时间,h;SF是流加葡萄糖的浓度,g·L-1;S是罐内葡萄糖的浓度,g·L-1。实验中V0=3L,X0=4.1g·L-1,YX/S由分批发酵数据计算为0.41g·g-1,SF=400g·L-1。通过流加发酵动力学模型对毕赤酵母分批发酵的菌体生长曲线进行拟合,得到菌体生长动力学模型为:

式(2)中X为菌体浓度,g·L-1,t是发酵时间,h。该模型能够很好地拟合菌体对数生长期和稳定期的变化趋势,回归的R2值为0.997,结合菌体生长动力学模型计算求得实验最大比生长速率 μmax= 0.385h-1,原则上只要我们所取的μset值小于0.385h-1就可以了,实验中初步设定μset=0.15h-1。指数流加补料的动力学曲线如图4所示。
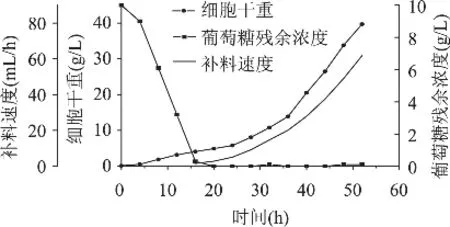
图4 指数流加补料的动力学曲线(μset=0.15h-1)
从图中可以看出,指数流加补料开始之后,发酵液中的葡萄糖浓度一直维持在0水平,说明加入的葡萄糖被完全消耗,DO值也在发酵全过程保持在20%以上,发酵进行到52h时停止补料,此时细胞干重达到最高为39.7g/L。由于实验所设定的μset在较低的0.15h-1,补入的葡萄糖很快被酵母利用,毕赤酵母的生长仍处于葡萄糖限制生长的状态,三羧酸循环的周转能力还没有达到饱和状态。如果毕赤酵母摄入的底物过多,比生长速率大于一定的阈值后很容易积累乙醇,这个阈值一般在0.14~0.5h-1范围内[11],因此本实验所设定的比生长速率是较为保守的。
为了确定最佳的比生长速率,我们又进行了一次μset=0.20h-1的实验,实验结果如图5所示。从图中可以看出,当我们提高了比生长速率后,葡萄糖的流加速率也相应随之增加,52h结束发酵时,最大细胞干重为44.1g/L。整个过程流加了葡萄糖补料液800mL,但所得到的菌体干重却仅为μset=0.15h-1时的1.2倍,没有明显的增加。从图中的DO曲线可以看出:在发酵的前36h,发酵液中的DO值可以保持在20%以上,但36h(此时已补料20h)以后,DO值持续下降,40h已下降到12%,48h的DO值已接近为0,说明此时的细胞生长旺盛,需氧较多,单纯依靠提高搅拌转速与通气量已不能满足DO值大于20%,此时葡萄糖已有一部分进入了厌氧发酵途径,而没有用来生长菌体,从而造成了葡萄糖的浪费。
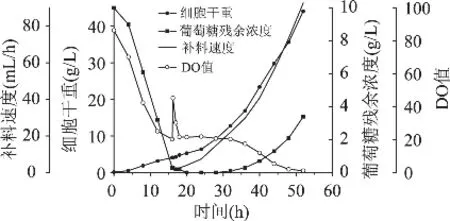
图5 指数流加补料的动力学曲线(μset=0.20h-1)
为了达到更高的菌体密度,实验中我们采取这样一种补料策略:为了让酵母生长更快一些,我们可以采用分阶段设定比生长速率的方法来进行毕赤酵母的上罐发酵。在指数补料阶段的前20h,我们可以设定 μset=0.20h-1;而在 20h以后,设定 μset= 0.15h-1。这样可以在补料前期不影响酵母菌体的生长,而在补料后期又不会造成酵母生长过于旺盛、溶氧太低而进行厌氧发酵。验证实验如图所示。
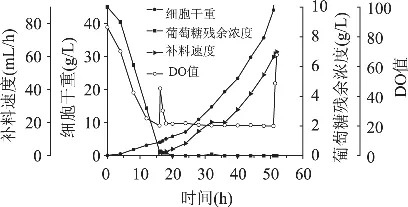
图6 指数流加补料的动力学曲线(分阶段控制比生长速率)
实验结果达到了本实验的预期目的,整个发酵过程的DO值一直控制在20%以上,补料阶段的残糖浓度也一直维持在0水平,最终达到53.4g/L的菌体密度,比前两次指数流加实验都有所提高。
3 讨论
在本文中,我们通过在指数流加过程中分阶段设定不同的比长速率来控制葡萄糖的流加速率,使发酵液中的碳源浓度维持在接近0的水平,可维持较高的溶氧水平,很好地解决了发酵进行到36h时溶氧水平降为0的矛盾。实验中由于上罐次数的限制,仅实验了比生长速率分别为0.15h-1和0.20h-1,旨在发现其中规律。根据所建立的动力学模型,提出了分阶段控制比生长速率的方法,发酵前20h和20h以后控制比生长速率分别为0.20h-1和0.15h-1,最终菌体细胞干重达到53.4g/L,比控制恒定比生长速率时的菌体细胞干重有所提高。
[1]郭美锦,吴康华,杭海峰,等.基因工程菌Pichia pastoris高密度培养条件研究[J].微生物学通报,2001,28(3):6-11.
[2]Romanos M A,Scorer C A,Clare J J.Foreign gene expression in yeast:a review[J].Yeast,1992,8(6):423-488.
[3]林俊涵.毕赤酵母高密度发酵工艺的研究[J].中国生物工程杂志,2009,29(5):120-125.
[4]窦烨,王清路,李俏俏.毕赤酵母工程菌发酵条件的优化[J].食品工业科技,2008,29(6):168-171.
[5]李洪淼,王红宁,许钦坤.毕赤酵母高密度发酵研究进展[J].生物技术通讯,2005,16(2):210-212.
[6]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1994:168-169.
[7]李寅,陈坚,周楠迪,等.环境条件及摇瓶补糖策略对谷胱甘肽发酵的影响[J].生物工程学报,1998,14(2):147-152.
[8]Yee L,Blanch H W.Recombinant trypsin production in high cell density fed-batch cultures in Escherichia coli[J].Biotechnol Bioeng,1993,41(8):781-790.
[9]俞俊棠,顾其丰,叶勤.生物化学工程[M].北京:化学工业出版社,1994:90-91.
[10]Gu M B,Park M H,Kim D I.Growth Rate Control in Fed-Batch Culture of Recombinant Saccharomyces cerevisiae Producing Hepatitis B Surface Antigen(HBs Ag)[J].Appl Microbiol Biotech,1991,35:46-50.
[11]Paalme T,Tiisma K,Kahru A,et al.Glucose-limited fedbatch cultivation of Escherichia coli with computer-controlled fixed growth rate[J].Biotechnology and Bioengineering,1990,35:312-319.
Influence of different feeding strategies on high density culture of recombinant pichia pastoris
SA Rong-bo1,SHI Gui-yang2,TANG Yu-jing1
(1.Bioscience Department,Taishan Medical University,Taian 271016,China;2.School of Biotechnology,Jiangnan University,Wuxi 214036,China)
Objcetive:To develop the influence of three different feeding strategies on high density culture of recombinant pichia pastoris.Method:Medium was fed in different feeding strategies after batch fermentation ended.Results:The optimum concentration for glucose was 10g/L in batch fermentation.The dry cell weight were 33.2g/L and 41.5g/L respectively in intermission and constant velocity fed-batch fermentation.When the specific growth rate was controlled 0.20h-1and 0.15h-1prophase and anaphase of the fermentation,the dry cell weight in exponential fed-batch processes was 53.4g/L.Conclusion:The dry cell weight with different specific growth rate was higher than the other two fermentation strategies.
recombinant pichia pastoris;high density culture;feeding strategy
TS201.3
A
1002-0306(2010)11-0210-04
2009-11-04
洒荣波(1978-),男,讲师,硕士,研究方向:微生物发酵。
泰山医学院青年科学基金项目(2008-2009)。
