两种蛋白水解物的FENTON反应修饰与抗氧化活性变化
2010-11-10赵新淮
高 博,徐 微,赵新淮
(乳品科学教育部重点实验室,东北农业大学,黑龙江哈尔滨150030)
两种蛋白水解物的FENTON反应修饰与抗氧化活性变化
高 博,徐 微,赵新淮*
(乳品科学教育部重点实验室,东北农业大学,黑龙江哈尔滨150030)
利用碱性蛋白酶分别水解大豆分离蛋白、酪蛋白,对两种水解物进行Fenton反应修饰。用紫外吸收及Lowry法评价修饰反应对两种水解物的影响,结果表明,修饰后产物与原水解物显著不同,表明修饰反应对水解物组成产生影响。抗氧化活性分析发现,大豆分离蛋白水解物的修饰产物的IC50从2.92mg/mL降低至1.36~2.28mg/mL,酪蛋白水解物的修饰产物的IC50从2.80mg/mL降低至0.89~2.12mg/mL,表明Fenton反应可提高修饰产物对DPPH自由基的清除能力。
大豆分离蛋白,酪蛋白,水解物,Fenton反应,抗氧化活性
蛋白质是重要的食品成分,具有不可替代的作用。通过蛋白酶水解蛋白质来制备具有各种生物活性的水解物(如抗癌肽、抗病毒肽、抗菌肽、抗氧化肽等),是国内外研究的热点之一。国内外对抗氧化肽的研究工作大多集中在酶水解、分离纯化及氨基酸组成分析上。虽然我们对蛋白质水解物的抗氧化机制还不完全清楚,但是已有的研究结果表明,蛋白质水解物的抗氧化活性与其氨基酸组成有关;氨基酸组成分析发现,肽段中几乎都含有酪氨酸残基[1-3]。氨基酸侧链基团的氧化修饰是蛋白质修饰作用的结果之一[4]。利用氧自由基氧化,可以导致芳香族氨基酸侧链的羟基化[5]。Fenton试剂产生的·OH是最活泼的氧自由基[6]。苯丙氨酸残基被·OH羟基化可以产生三个产物,分别为对-、间-、邻-酪氨酸[7]。因此,蛋白质水解物中苯丙氨酸被·OH修饰,将可能改善水解物的抗氧化活性。为此,利用碱性蛋白酶(Alcalase 2.4L FG)分别水解大豆分离蛋白和酪蛋白,通过Fenton试剂(H2O2+FeSO4系统)产生·OH来修饰这两种蛋白水解物;利用紫外法及Lowry法确认修饰产物中发生的羟基化作用;最后,评价两种蛋白水解物修饰产物的清除DPPH自由基活性,确认Fenton反应对两种蛋白水解物抗氧化活性的影响作用。
1 材料与方法
1.1 材料与设备
大豆蛋白粉 哈尔滨高科技蛋白有限公司;酪蛋白 上海山浦化工有限公司;碱性蛋白酶
Alcalase 2.4L FG,Novo公司,酶活 2.4AU/g,密度1.18g/mL;1,1-二苯基-2-苦基肼(DPPH) Sigma公司;其他所有试剂 均为分析纯。
UV-2401PC型紫外可见分光光度计 岛津公司;AL204型分析天平、DELTA 320型精密pH计
梅特勒-托利多仪器中国有限公司;Kjeltec TM2300型自动凯氏定氮仪 瑞士Foss公司;LGJ-1型空冷冻干燥机 上海医用分析仪器厂;HZQ-F160型全温振荡培养箱 哈尔滨东联电子技术开发有限公司;H -1型微型漩涡混合器 上海精科实业有限公司;YH -4BS型远红外恒温干燥箱 天津市中环实验电炉有限公司;DK-98-1型电热恒温水浴锅 天津市泰斯特仪器有限公司。
1.2 实验方法
1.2.1 大豆分离蛋白的制备 按照文献[8]中的方法进行。取250g脱脂大豆粉,加入10倍(W/V)的蒸馏水,用1mol/L NaOH溶液调pH至8.5。搅拌浸提2h,4000r/min离心 20min,弃去不溶性物质。2mol/L HCl调上清液的pH至4.5,静置1~2h,弃去上清液,下层蛋白质凝乳4000r/min离心20min,弃去上清液。沉淀物加入1.5~2倍(W/V)蒸馏水,搅拌、离心,弃去上清液;重复2次。沉淀物中加入1倍(W/V)蒸馏水,1mol/L NaOH调pH至7.0,冷冻干燥即得大豆分离蛋白。分析结果表明,其蛋白质含量约为96%(干重)。
1.2.2 大豆分离蛋白和酪蛋白的水解物制备 根据文献[9-12]中的方法进行。用蒸馏水配制浓度为5%(W/W)的大豆分离蛋白或酪蛋白溶液,调节pH至8.0,酶添加量为1g蛋白质0.3AU,在50℃恒温水浴中进行酶解。酶解作用2h后,调节水解液的pH至4.5。100℃加热10min使酶灭活,5000r/min离心20min,分离出上清液。测定上清液中蛋白质含量和游离氨基含量,计算水解度。水解液冷冻干燥,固体保存于-20℃冰箱中备用。
1.2.3 水解物的Fenton反应修饰 采用双因素实验,研究反应时间(选择0.5、1、2、3h)、蛋白水解物中苯丙氨酸残基摩尔数与Fenton试剂(FeSO4-EDTA溶液与等浓度的H2O2溶液混合)摩尔数的比例(以Phe∶H2O2比例表示,选择1∶0.5、1∶1和1∶2)对修饰产物的影响。固定水解物浓度为1%(W/W),反应体系为pH 3.5的磷酸盐缓冲体系。
1.2.4 Fenton反应对两种蛋白水解物的影响
1.2.4.1 对水解物紫外吸收的影响 取稀释适当倍数的样品溶液,倒入1cm石英比色皿中,于280nm处测定吸光度[13]。用蒸馏水或各修饰反应使用试剂(与样品溶液稀释倍数)调零点,平行测定三次。
1.2.4.2 对水解物Lowry法评价的影响 1mL稀释适当倍数的样品溶液中加入5mL试剂甲,混匀后37℃水浴中10min;加入0.5mL试剂乙,混匀后37℃水浴中30min,测定750nm的吸光度[14]。以蒸馏水进行空白实验,平行测定三次。
试剂甲:将10g Na2CO3、2g NaOH和0.5g酒石酸钾钠溶于500mL蒸馏水;将0.5g CuSO4·5H2O溶于100mL蒸馏水,使用前将两溶液以50∶1混合。试剂乙:将福林酚试剂用标准NaOH溶液滴定,以酚酞为指示剂,稀释至最终酸浓度为1mol/L。
1.3 测定方法
1.3.1 蛋白质含量、蛋白质水解度的测定
1.3.1.1 蛋白质含量的测定 采用凯氏定氮法[15]。
1.3.1.2 游离氨基含量与蛋白质水解度(DH)测定采用茚三酮法[16]。
大豆分离蛋白水解度计算公式如下:

式中:5.71-大豆蛋白质的换算系数;N1-大豆蛋白水解物的氮含量,mg/mL;0.35mmol/g-大豆分离蛋白的游离氨基含量(测定所得结果);7.8mmol/g-大豆蛋白的肽键含量。
酪蛋白水解度计算公式如下:

式中:6.38-酪蛋白的换算系数;N1-酪蛋白水解物的氮含量,mg/mL;0.44mmol/g-酪蛋白的游离氨基含量(测定所得结果);8.2mmol/g-酪蛋白的肽键含量。
1.3.2 抗氧化活性分析 无水乙醇溶解DPPH,使DPPH最终浓度为20μmol/L。取2mL DPPH乙醇溶液与4mL已稀释适当倍数的样品溶液混合,室温下避光反应30min,测定其在517nm处的吸光度,同时用无水乙醇进行空白实验,平行测定三次[17-18]。以DPPH自由基的清除率和样品浓度作标准曲线,求IC50值。DPPH自由基清除率的计算公式如下:

式中:A517空白-空白样在 517nm处的吸光度;A517样品-样品在517nm处的吸光度。
1.4 数据的统计分析
所有数据均以平均值±标准偏差表示。采用Excel(2003)软件进行可重复双因素方差分析。
2 结果与分析
两种蛋白经碱性蛋白酶(Alcalase 2.4L FG)水解后,测得大豆分离蛋白、酪蛋白水解物的DH分别为9%、10%,其清除 DPPH自由基的 IC50值分别为
2.1 Fenton反应对两种蛋白水解物的修饰
2.1.1 对两种蛋白水解物的紫外吸收的影响 采用分光光度法评价Fenton反应对两种蛋白水解物的紫外影响,结果如表1、表2。
从数据结果中可以看出,随Phe∶H2O2比例的增加(即反应体系中Fenton试剂添加量的增加),两种蛋白水解物的修饰产物在280nm处的吸光度均呈明显增加的趋势,且随反应时间的变化不显著。由于修饰反应中羟自由基进攻肽链中的苯环,使苯丙氨酸残基转化为酪氨酸残基和进一步羟基化的衍生物;羟基是给电子基,当它与苯环的共轭体系相连时,导致大π键电子云流动性增大,分子中电子的跃迁的能级差减少,最大吸收向长波长方向移动,颜色加深,所以修饰产物在280nm处的吸光度会明显增加。此外,由于羟自由基反应速度极快[19],在短时间内(例如0.5h)已完全反应,反应时间的延长对修饰产物在280nm处的吸光度就无明显变化。
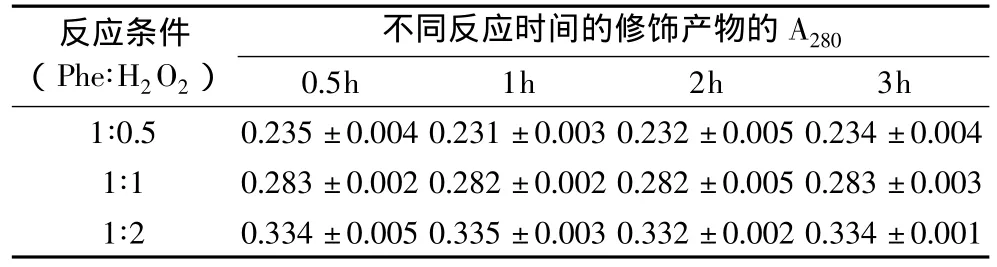
表1 Fenton反应修饰对大豆蛋白水解物的紫外吸收影响
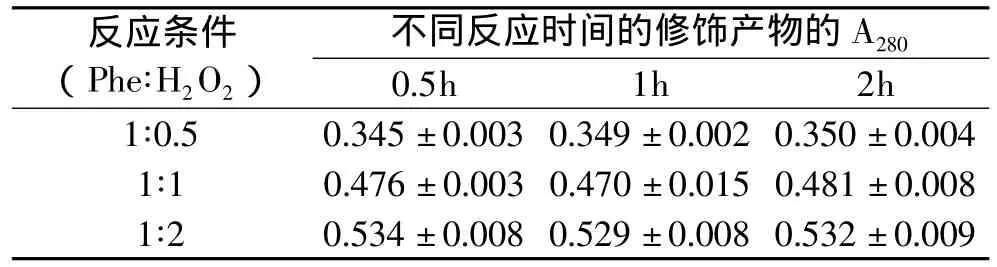
表2 Fenton反应修饰对酪蛋白水解物的紫外吸收影响
2.1.2 Fenton反应对水解物Lowry法测定的影响
采用Lowry法评价Fenton反应对两种蛋白水解物的影响作用,见表3、表4。

表3 Fenton反应修饰对大豆蛋白水解物的Lowry法评价的影响
随Fenton试剂添加量的增加,Lowry法测得蛋白质水解物修饰产物的吸光度增大,说明Fenton反应修饰使两种修饰产物中存在的酪氨酸残基数量增加,且增加幅度随Fenton试剂添加量的增加而增加。同样,在Fenton试剂添加量不变时,随着时间的延长Lowry法测得的吸光度无明显变化,原因同前。

表4 Fenton反应修饰对酪蛋白水解物的Lowry法评价的影响
两种蛋白质水解物的紫外分光光度分析、Lowry法分析结果表明,Fenton反应确实对水解物的组成产生了影响,在肽链中引入了新的羟基。
2.2 Fenton反应对修饰产物的抗氧化活性的影响
对蛋白水解物、Fenton反应修饰产物的抗氧化活性进行分析,选用常用的DPPH自由基清除活性评价方法,见表5、表6。

表5 Fenton反应修饰的大豆分离蛋白水解物的DPPH自由基清除活性
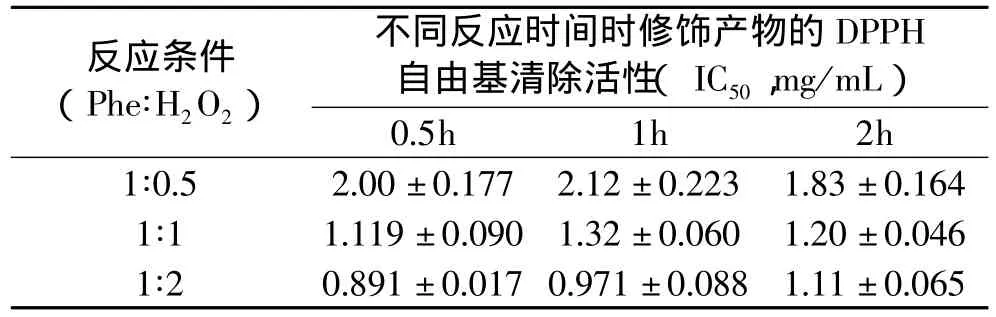
表6 Fenton反应修饰的酪蛋白水解物的DPPH自由基清除活性

表7 Phe∶H2O2比例和反应时间对Fenton反应修饰的影响的显著性
从分析结果中看出,Fenton反应修饰有效地提高了两种蛋白质水解物的抗氧化活性。大豆分离蛋白水解物的修饰产物的IC50为1.36~2.28mg/mL,小于大豆分离蛋白水解物的IC50;同样,酪蛋白水解物的修饰产物的IC50为0.89~2.12mg/mL,也小于酪蛋白水解物的IC50。这些结果表明修饰反应改善了两个蛋白质水解物对DPPH自由基的清除活性。同时,Fenton试剂添加量增加,修饰产物的IC50降低更多,表明其抗氧化活性改善幅度增加,这与肽链中羟基的引入水平有关;但在Fenton试剂添加量相同时,反应时间延长对修饰产物的IC50没有明显变化,原因还是同前所述。
2.3 Phe∶H2O2比例和反应时间对蛋白水解物Fenton反应修饰的显著性分析
采用Excel软件,对Phe:H2O2比例、反应时间两个因素进行方差分析,结果见表7。
分析结果看出,Phe∶H2O2比例对修饰产物的紫外吸收、Lowry法评价和DPPH自由基清除活性的影响极显著(P<0.01),而反应时间影响不显著。这表明,Fenton试剂的添加量是影响两种蛋白质水解物性质的主要因素,即两种蛋白质水解物的抗氧化活性可以通过Fenton试剂的添加量而调控。
3 结论
3.1 利用碱性蛋白酶(Alcalase 2.4L FG)分别对大豆分离蛋白、酪蛋白进行水解,制备出DH分别为9%、10%的两个水解产物,其清除DPPH自由基的IC50值分别为2.92、2.80mg/mL。
3.2 利用Fenton反应修饰两种蛋白质水解物后,发现Fenton反应导致修饰产物在280nm处的吸光度明显增大,Lowry法评价修饰产物也表明其在750nm处的吸光度增大,说明Fenton反应修饰对两种蛋白水解物的组成产生影响。
3.3 对DPPH自由基清除活性评价结果表明,两种蛋白质水解物修饰产物的IC50从2.92mg/mL或2.80mg/mL降低至1.36~2.28mg/mL或0.89~2.12mg/mL,表明修饰反应可以改善蛋白质水解物的DPPH自由基清除活性。
3.4 方差分析结果表明,Phe∶H2O2比例对修饰产物的性质(包括DPPH自由基清除活性)的影响极显著(P<0.01),反应时间的影响不显著(P>0.05),表明Fenton试剂添加量是影响两种蛋白水解物DPPH自由基清除活性的主要因素。
[1]Elias RJ,Bridgewater JD,Vachet RW,et al.Antioxidant mechanisms of enzymatic hydrolysates of beta-lactoglobulin in food lipid dispersions[J].Journal of Agricultural and Food Chemistry,2006,54(25):9565-9572.
[2]Hernandez-Ledesma B,Amigo L,Recio I.ACE-Inhibitory and radical-scavenging activity of peptides derived from betalactoglobulin f(19-25).Interactions with ascorbic acid[J]. Journal of Agricultural and Food Chemistry,2007,55(9):3392-3397.
[3]严群芳.大豆抗氧化肽的分离及生物活性的研究[D].南京农业大学硕士学位论文,2006.
[4]Park D,Xiong YL.Oxidative modification of amino acids in porcine myofibrillar protein isolates exposed to three oxidizing systems[J].Food Chemistry,2007,103(2):607-616.
[5]Amici A,Levine RL,Tsai L,et al.Conversion of amino acid residue in proteins and amino acid homopolymers to carbonyl derivatives by metal-catalyzed oxidation reaction[J].The Journal of Biological Chemistry,1989,264(6):3341-3346.
[6]杨芬,张瑞萍,贺玖明,等.羟自由基的产生、捕集及检测方法[J].药学学报,2007,42(7):692-697.
[7]Roberto B,Xia Y,Ruggero R,et al.Detection of hydroxyl radicals by D-phenylalanine hydroxylation:a specific assay for hydroxyl radical generation in biological systems[J].Analytical Biochemistry,2001,290(1):138-145.
[8]Wang XS,Tang CH,Li BS,et al.Effects of high-pressure treatment on some physicochemical and functional properties of soy protein isolates[J].Food Hydrocolloids,2008,22(4):560-567.
[9]Cumby N,Zhong Y,Naczk M,et al.Antioxidant activity and water-holding capacity of canola protein hydrolysates[J].Food Chemistry,2008,109(1):144-148.
[10]Kexue Z,Zhou HM,Qian HF.Antioxidant and free radicalscavenging activities of wheat germ protein hydrolysates(WGPH)prepared with alcalase[J].Process Biochemistry,2006,41(6):1296-1302.
[11] Meng XJ,ZhangXZ,WangXY.Preparation and Antioxidative Effects of Soybean Peptides[J].Chemical Research in Chinese Universities,1999,15(2):140-145.
[12]Mao XY,Ni JR,Sun WL,et al.Value-added utilization of yak milk casein for the production of angiotensin-I-converting enzyme inhibitory peptides[J].Food Chemistry,2007,103(4):1282-1287.
[13]曹红翠.紫外分光光度法测定蛋白质的含量[J].广东化工,2007,34(8):93-94.
[14]LowryOH,RosebroughNJ,FarrAL,etal.Protein measurement with the Folin phenol reagent[J].Journal of Biochemistry,1951,193(1):265-275.
[15]中华人民共和国国家标准GB5009.5-2003[S].北京:中国标准出版社,2003.
[16]赵新淮,冯志彪.蛋白质水解物水解度的测定[J].食品科学,1994,15(11):65-67.
[17]Shimada K,Fujikawa K,Yahara K,et al.Antioxidative properties of xanthan on the antioxidation of soybean oil in cyclodextrin emulsion[J].Journal of Agricultural and Food Chemistry,1992,40(6):945-948.
[18]Vilailak K,Soottawat B,Duangporn K,et al.Antioxidative activity and functional properties of protein hydrolysate of yellow stripe trevally as influenced by the degree of hydrolysis and enzyme type[J].Food Chemistry,2007,102(4):1317-1327.
[19]孙存普,张建中,段绍瑾.自由基生物学导论[M].合肥:中国科技大学出版社,1999.
Modification of two protein hydrolysates by Fenton reaction and change of their antioxidant activity
GAO Bo,XU Wei,ZHAO Xin-huai*
(Key Laboratory of Dairy Science,Ministry of Education,Northeast Agricultural University,Harbin 150030,China)
Soy protein isolate hydrolysates or casein hydrolysates were prepared by hydrolysis of soy protein isolate or casein with alcalase 2.4L FG respectively,and then modified by Fenton reaction.Ultraviolet absorption and Lowry assay were applied to estimate the effects of Fenton reaction on the two hydrolysates.The results indicated that the modified hydrolysates were different from the original ones and showed the impacts of Fenton reaction on the compositions of two protein hydrolysates.The antioxidant activities of the modified protein hydrolysates were analyzed for DPPH radical scavenging activity.The analysis results showed that the lC50values of the modified soy protein isolate hydrolysates or casein hydrolysates on DPPH radical were decreased from 2.92 or 2.80mg/mL to 1. 36~2.28 or 0.89~2.12mg/mL,which clearly indicated that modification of two protein hydrolysates by Fenton reaction improved their free radical scavenging activities.
soy protein isolate;casein;hydrolysates;Fenton reaction;antioxidant activity
TS201.2
A
1002-0306(2010)09-0104-04
2009-10-22 *通讯联系人
高博(1984-),女,硕士研究生,研究方向:食品科学。
国家高技术发展计划(863)(2006AA10Z324)。
