大麦蛋白组分对糖化麦汁的影响
2010-11-10石殿瑜赵长新
徐 凯,石殿瑜,邱 然,赵长新
(1.中粮麦芽(大连)有限公司,辽宁大连116200;2.中粮麦芽(江阴)有限公司,江苏江阴214434;3.大连工业大学生物与食品工程学院,辽宁大连116034)
大麦蛋白组分对糖化麦汁的影响
徐 凯1,石殿瑜2,邱 然1,赵长新3,*
(1.中粮麦芽(大连)有限公司,辽宁大连116200;2.中粮麦芽(江阴)有限公司,江苏江阴214434;3.大连工业大学生物与食品工程学院,辽宁大连116034)
根据不同蛋白组分溶解特性,以不同溶剂依次提取了大麦中蛋白组分,将各组分蛋白重组到麦芽粉中进行糖化。结果表明,醇溶蛋白是对糖化过程和糖化麦汁质量有较大负面影响的组分,其中非凝胶醇溶蛋白中的一些组分或被一定程度降解得到的多肽是导致麦汁混浊的主要成分;而凝胶醇溶蛋白是导致麦汁分离困难的主要因素。
大麦,蛋白,麦汁,聚丙烯酰胺凝胶电泳
大麦蛋白组成对制麦、糖化、发酵及成品啤酒的泡沫、风味、非生物稳定性都会产生很大的影响[1]。大麦总氮这一指标已经被国内生产厂作为选择啤酒酿造大麦的主要依据。随着研究的深入发现,仅靠总氮来衡量大麦的蛋白品质明显不能满足生产需要。为此,深入了解大麦蛋白的组成对实际制麦和啤酒生产的影响是十分必要的。研究表明大麦中的蛋白质对啤酒生产中糖化工艺过程及所得麦汁质量的影响都是非常显著的,它对麦汁的分离过程有很大的影响[2]。另有研究发现,麦汁的浊度同大麦中的蛋白含量有很大的联系,而麦汁浊度对啤酒发酵过程及成品啤酒的非生物稳定性和风味稳定性都有明显的影响[3]。因此,本文通过提取大麦各组分蛋白,特别是将大麦醇溶蛋白以乙醇溶液和含有还原剂巯基乙醇的乙醇溶液分步提取,以区分出非凝胶醇溶蛋白和凝胶醇溶蛋白,然后将各组分蛋白重新添加到麦芽粉中进行糖化,以期找出对麦汁糖化过程和麦汁质量有负面影响的蛋白组分,并为进一步更加有针对性的研究制麦及啤酒酿造中蛋白质的降解提供一定依据。
1 材料与方法
1.1 材料与仪器
大麦品种 澳大利亚大麦Hordeum sp.Gairdner;标准牛血清白蛋白 Sigma;丙烯酰胺、甘氨酸Amresco;SDS-PAGE低分子量蛋白质标准 Takara;其余试剂 均为国产分析纯。
EBC麦芽粉碎机 德国PFFEUIFFER;自动糖化器 德国LB;2100P浊度计 美国HACH;TU1900紫外可见分光光度计 北京普析通用;TGL-16M高速台式冷冻离心机 长沙湘仪;JM-250型小型电泳仪 大连捷迈;凝胶成像系统 美国UVP。
1.2 实验方法
1.2.1 大麦蛋白组分分离工艺 参考奥斯保式分离工艺[4],将大麦粉碎,在4℃下用0.5mol/L氯化钠溶液100mL浸取10g大麦粉1h,离心分离后,残余物用50mL去离子水洗2次,每次30min,然后再离心。将上述三次上清液混合,用去离子水透析(4℃,48h,截流分子量12~14kDa),然后离心分离,清液即为水溶蛋白,沉淀物为盐溶蛋白。用盐溶液提取后的残留物用100mL的70%酒精溶液进一步提取,60℃下提取1h,离心后沉淀用50mL酒精溶液重复提取两次,每次30min,合并三次上清液为非凝胶醇溶蛋白。离心后沉淀再用含5%疏基乙醇的70%乙醇溶液提取凝胶性醇溶蛋白,方法同非凝胶性醇溶蛋白。沉淀再以5%氢氧化钠100mL在室温下提取两次,每次1h,离心分离,上清液用水透析(4℃,48h),得到沉淀物即为碱溶蛋白。上述过程中离心操作均在4000r/min进行15min。将上述五种组分及最后的残留物冷冻干燥,用研钵磨碎残留物,备用。

表2 过滤时间和麦汁中多酚含量
1.2.2 蛋白组分分析 采用Bradford法测定蛋白质的含量,以考马斯亮蓝G-250溶液进行显色、比色,标准曲线用牛血清白蛋白制作,具体操作见参考文献[5]。总糖在酸水解后,采用文献[6]方法测定。
1.2.3 重组糖化 在80%麦芽中添加用上述方法制得的蛋白组分,添加量相当于20%麦芽所含蛋白量,将不同的重组混合物进行糖化(图1所示)。每组取10.0g样品置于已知重量的糖化杯中,加入46℃去离子水40mL,在不断搅拌下于45℃水浴中保温30min。以1℃/min的速度升温加热水浴,在25min内升至70℃,此时于杯内加入70℃的去离子水20mL,醪液于70℃下保温1h后,以1℃/min的速度升温至80℃并保温10min,在10~15min内迅速冷却至室温。冲洗搅拌器,加水使内容物准确称量为90.0g。搅动糖化醪并用中速滤纸过滤,将最初收集的20mL滤液返回重滤,记录过滤时间,收集滤液于干燥烧杯中。每组制备的糖化麦汁必须在4h内测定完毕。
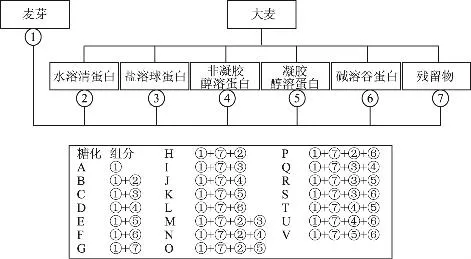
图1 蛋白组分重组
1.2.4 麦汁分析 根据EBC方法进行分析[7]。
1.2.5 蛋白组分的SDS-PAGE 分别称取各组分蛋白1mg,溶于2mL加入样品缓冲液中(50mmol/L Tris-HCl,pH6.8,5%β-巯基乙醇,2%SDS,10%甘油,0.1%溴酚蓝),沸水浴5min,冷却后供电泳上样用。
按照 Laemmli的 SDS-PAGE方法[8],浓缩胶5%,分离胶12%,考马斯亮蓝R-250染色,醋酸-甲醇体系脱色。SDS-PAGE电泳图谱采用凝胶成像分析系统分析。
2 结果与分析
2.1 蛋白组分分析结果
表1给出了各组分蛋白的分离收率、含量及总糖的含量。残留物占总质量的91.85%,是最主要的组分,它含有95%以上的淀粉和3.93%的蛋白质,在提取过程中造成的损失占麦粒的0.3%,主要是由分子量小于12~14kDa的水溶性化合物组成。将大麦各组分蛋白质含量与测得的总蛋白含量10.12%相比较,可看出在提取过程中只损失了0.9%的凯氏氮。通过不同组分的收率及其蛋白含量可以计算出,以本实验方法提取的大麦蛋白中分别有8.34%清蛋白、6.63%球蛋白、11.18%非凝胶醇溶蛋白、7.78%凝胶醇溶蛋白、21.49%碱溶性谷蛋白和35.69%不溶于碱的谷蛋白。
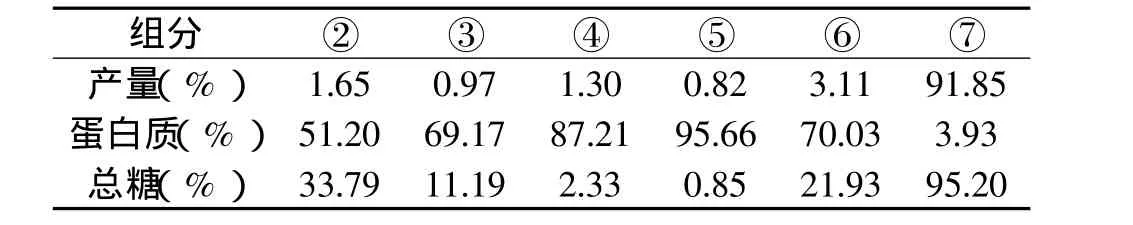
表1 蛋白组分化学组成
2.2 麦汁分析结果
由表2中过滤时间数据可看出,对过滤影响较大的组分是凝胶醇溶蛋白、碱溶谷蛋白和提取残留物,主要原因为凝胶醇溶蛋白和碱溶谷蛋白在糖化过程中可以重新形成二硫键,使之聚合为二硫化物聚合体[9],这些二硫化物聚合体堆积在过滤层上而导致过滤速度降低;提取残留物也因为增大了过滤层厚度而导致过滤速度降低。
从多酚含量数据中可看出,对多酚含量影响最大的组分是提取残留物,其次是碱溶性组分,而其它几个组分对多酚含量影响不大,说明碱溶组分中提取出一部分多酚物质,而大部分多酚物质没有被溶解出来,留在残留物中。
2.3 重组糖化对麦汁浊度的影响
如图2所示,全麦麦汁浊度(20℃)为1.9EBC,对比添加单独的组分糖化(B~G)得到的麦汁可以看出,麦汁中水溶性组分使浊度下降0.38EBC;盐溶性组分、凝胶醇溶性组分和碱溶性组分对混浊影响很小;残留物组分使浊度上升了1.33EBC;非凝胶醇溶性组分对混浊影响最大,使浊度上升了4.16EBC。把残留组分与其它组分混合添加进行糖化(H~L),发现与水溶性组分的混合糖化浊度降低了0.25EBC,而与非凝胶醇溶性组分的混合糖化浊度分别比两组分单独糖化增加了4.84EBC和2.01EBC,显示了这两种组分对混浊的增加有相互增强的作用。通过对比三种组分重组进行糖化(M~V),进一步说明了水溶性组分对浊度有降低作用,而非凝胶醇溶性组分和残留物组分有增加浊度的作用,并且这两个组分的混合物可导致浊度有额外的增高。
2.4 SDS-PAGE电泳分析
由图3可以看出,大麦种子中水溶清蛋白缺乏高分子量蛋白组分,而富含中、低分子量蛋白亚基,其亚基在分子量10~66kDa间分布。大麦清蛋白由一个相对较小的基因家族所编码[10],这部分蛋白主要为酶、酶原、酶抑制剂及被降解的多肽等[11]。盐溶球蛋白组成的种类与清蛋白大多相似,也均为中、低分子量蛋白亚基,这与Gorg等人研究结果相符[12],这部分蛋白主要为结构与代谢蛋白。清蛋白与球蛋白在种子的信息传递、能量转化及物质代谢中有重要作用,也就是通常所说的组织蛋白[13]。在没有还原剂的条件下提取的非凝胶醇溶蛋白包括全部的A、B1、B2醇溶蛋白和部分的B3、C醇溶蛋白;而加了还原剂提取的凝胶醇溶蛋白中包括部分B3醇溶蛋白,少量的C醇溶蛋白和全部的D醇溶蛋白。碱溶谷蛋白组分电泳结果可看出,谷蛋白亚基在分子量20~100kDa间分布,谷蛋白是高分子的大麦贮存蛋白,它是由通过二硫键连接的多肽单体组成。大麦醇溶蛋白和谷蛋白也就是通常说的贮藏蛋白,它们在大麦发育中形成,为种子萌发及幼苗生长提供氮源。
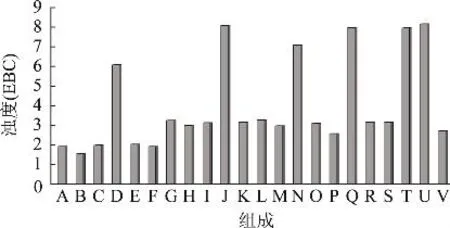
图2 麦汁的浊度

图3 大麦蛋白组分SDS-PAGE电泳图
3 讨论
麦芽的糖化是将淀粉、蛋白质等大分子物质降解为小分子物质,以供发酵生产中酵母菌利用的过程。现有的研究结果表明,麦汁浊度的变化对啤酒发酵过程有一定的影响,对成品啤酒的非生物稳定性和风味稳定性有明显的影响。大量研究证明,麦汁中的混浊主要是由蛋白质和多酚在氧、光照、振荡、金属离子等多种因素的催化下产生了比较稳定的共价键而形成的[14]。
将大麦蛋白的不同提取物添加到麦芽中进行不同的糖化,盐溶球蛋白、凝胶醇溶蛋白和碱溶谷蛋白对麦汁的混浊影响较小,这是因为球蛋白在糖化过程中基本被降解成短肽和氨基酸,而凝胶醇溶蛋白和碱溶蛋白未被降解部分将形成聚合体被滤出而不存在于麦汁中;水溶清蛋白组分能一定程度地降低麦汁浊度,这是由清蛋白中蛋白酶在发挥作用,它能水解一部分混浊敏感蛋白从而降低麦汁的浊度;相反,非凝胶醇溶蛋白和提取残留物分别使浊度增加了200%和100%以上,并且这两个组分的混合物可导致糖化麦汁浊度有额外的增高。考察非凝胶醇溶组分的成分可看出,其中含有近90%的蛋白质,再除去含有少量水分外该组分只有少量的糖类等其它物质,麦汁中的多酚物质主要来自于麦芽,而麦芽中的多酚物质主要存在于谷皮中[15],通过考察添加提取残留物组分糖化结果证实了该组分中含有大量的多酚类物质。所以,我们认为麦汁中的混浊主要是因为非凝胶醇溶蛋白中的一些组分或被一定程度降解得到的多肽与提取残留物中的多酚发生聚合反应所引起的。这与Chapon[16]和Karl[17]等人的研究结果是一致的。
一般认为,大麦蛋白中的二硫键是导致糖化分离困难的原因,在糖化过程中,大部分清蛋白和球蛋白被蛋白酶水解,只有小部分凝胶蛋白的二硫键被还原,其蛋白亚基被水解[18],而大部分含巯基的单体蛋白中巯基被氧化成二硫键形成了凝胶蛋白聚合体,在糖化后谷物残渣中形成一层“无法穿越层”。凝胶醇溶蛋白和碱溶谷蛋白是在提取剂中加入了还原剂巯基乙醇将大麦蛋白中二硫键还原后才提取出来的,而麦汁的过滤速度指标可看出这两部分蛋白的添加明显延长了过滤时间,证明了这两部分蛋白在糖化过程中可以重新通过二硫键形成凝胶蛋白二硫化物聚合体,这些蛋白聚合体堆积在过滤层上而导致过滤速度降低。另一个导致过滤速度降低的组分是提取残留物,这是因为该组分中的麦皮等残留物增大了过滤层厚度而导致过滤时间的延长。因为过滤时间指标的检测人为误差较大,并不十分精确,只能依此指标指示出各组分对糖化分离的影响趋势,而无法定量的对影响程度进行准确地分析。
综上所述,醇溶蛋白是对糖化过程和糖化麦汁有较大负面影响的蛋白组分,因此如何调节萌发期内大麦种子中蛋白酶活性,使醇溶蛋白在萌发过程和糖化过程中适当地降解,将成为种子萌发机理研究及制麦科技和遗传育种的一个重要方面。
[1]Howard K A.The relationship between D hordein and malting quality in barley[J].Journal of Cereal Science,1996,24:47-53.
[2]Charles Bamforth.Beer:Tapping into the Art and Science of Brewing[M].New York:Plenum Press,1999.
[3]Paul R.Glenister,Beer Deposits-a Laboratory Guide and Pictorial Atlas for the Study of various Particles Found in the Deposits of Beer and Ale[M].Miles L aboratories Inc,1975.
[4]Chen C H,Bushuk W.Nature of proteins in Triticale and its parental species.I.Solubility characteristics and aminoacid composition of endosperm proteins[J].Can J Plant Sci,1970,50:9-14.
[5]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72:248-254.
[6]管敦仪.啤酒工业手册[M].北京:中国轻工业出版社,1983.
[7]European Brewery Convention.Analytica-EBC[M]. Nürnberg:Verlag Hans Carl,2005.
[8]Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227:680-685.
[9]Pöyri S,Mikola M,Sontag-Strohm T,et al.The formation and hydrolysis of barley malt gel-protein under different mashing conditions[J].Journal of the Institute of Brewing,2002,108:261-267.
[10]Adachi T,Izumi H,Yamada T,et al.Gene structure and expression of rice allergenic proteins belonging to the α-amylase/ trypsin inhibitor family[J].Plant Mol Biol,1993,21:239-248.
[11]Sanchezdela Hoz P,Castagnaro A,Carboero P.Sharp divergence between wheat and barley at loci encoding novel members of the trypsin/α-amylase inhibitors family[J].Plant Mol Bio1,1994,26:12-31.
[12]Gorg A.Qualitative and quantitative changes in barley seed protein patterns during the malting process analyzed by SDSPAGE with respect to malting quality[J].Electrophoresis,1992,13:787-797.
[13]Bewley J D,BIack M.Seeds Physiology of Development and Germination[M].New York:Plenum Press,1994.
[14]Delcour J.The reaction between polyphenols and a dehydes and the influence of acetaldehyde on haze formation in beer[J].J Inst Brew,1982,88:234-243.
[15]石碧,狄莹.植物多酚[M].北京:科学出版社,2000.
[16]Chapon L.Nephelometry as a method for studying the relations between polyphenols and proteins[J].J Inst Brew,1993,99:49-56.
[17]Karl J,Siebert.Nature of Polyphenol-Protein Interactions[J].Journal of Agricultural and Food Chemistry,1996,44:80-85.
[18]Bilgi B,C-elik S.Solubility and emulsifying properties of barley protein concentrate[J].European Food Research and Technology,2004,218:437-441.
Effect of barley protein components on wort
XU Kai1,SHI Dian-yu2,QIU Ran1,ZHAO Chang-xin3,*
(1.Cofco Malt(Dalian)Co.,Ltd.,Dalian 116200,China;
2.Cofco Malt(Jiangyin)Co.,Ltd.,Jiangyin 214434,China;3.College of Biology&Food Technology,Dalian Polytechnic University,Dalian 116034,China)
Barley seed protein fractions,such as albumin,globulin,prolamin and glutenin were successively extracted by using different solvents,and mashed with malt separately.lt was showed that the hordein fractions had negative influence on quality indexes of wort.Some polypeptides that may be hydrolysate of non-gel-forming hordein induced to wort.However,the gel-forming hordein is a factor which leads to filtration difficulty.
barley;protein;wort;SDS-PAGE
TS210.1
A
1002-0306(2010)12-0072-04
2009-11-19 *通讯联系人
徐凯(1982-),男,硕士,研究员,研究方向:制麦技术。
国家科技部“十一五”科技支撑项目(2007BAK36B01)。
