经冠状动脉骨髓单个核细胞移植治疗重度心力衰竭的超声心动图初步观察
2010-11-07高连如沈燕华朱智明王志国张宁坤
贺 声 高连如 沈燕华 朱智明 王志国 张宁坤
骨髓间充质干细胞( bone marrow mesenchymal stem cell,MSC)具有多分化潜能,基础及临床研究均表明,应用富含MSC的单个核细胞(mononuclear bone marrow cell,MBMC)不同途径移植,可以明显改善心脏功能[1-3]。本研究观察一组治疗上除心脏移植外,不能或难于从其他治疗中获益的重度缺血性心力衰竭(end-stage ischemia heart failure,EIHF)患者,经冠状动脉自体骨髓MBMC移植后的心功能的变化,了解超声心动图对其治疗的评价意义。
1 资料与方法
1.1 观察对象及分组
41例来自2003年7月至2008年6月住院患者,入选标准:陈旧性心肌梗死OMI病史(依病史、心电图、超声心动图、核医学),有典型心力衰竭症状,经常规治疗方案,仍不能改善症状或症状迅速复发,不能进行日常生活中的大多数活动,或终日卧床休息,反复发作急性肺水肿,需反复或长期住院,LVEF<40%;排除恶性肿瘤、原发严重肝肾功能不全、出血疾病及其他肺心病、瓣膜心脏病者。根据患者意愿分成两组:细胞移植组(常规治疗+MBMC移植27例),对照组(常规治疗14例):除MBMC移植外其他治疗同细胞移植组;常规治疗均系全面、充分内科治疗,无外科手术适应证(表1)。
经海军总医院伦理委员会及科委会论证同意,入选者及家属均签属知情同意书。

表1 41例患者一般资料比较
1.2 经冠状动脉MBMC移植
术前1d下午于髂后上嵴抽取骨髓40mL,调为4×106/2mL浓度MBMC细胞悬液;常规行左右冠状动脉造影;MBMC移植,超选择性:经球囊导管将MBMC以高压注入心肌梗死相关动脉,2mL含4×106BMMC,共注入6~8次;非超选择性:根椐冠状动脉病变,完全闭塞性病变不能血管重建者,选择逆灌流血管、桥血管移植,多支弥漫性、钙化性狭窄病变选择左或右冠状动脉主干,手推高压注入MBMC悬液;MBMC细胞总数(5.0±0.7)×107,活细胞占(94.6±1.8)%,全部操作时间在10~30min。27例细胞移植者中14例同时行PCI术,余单纯MBMC移植。
1.3 影像学观察
超声心动图检查:于细胞移植术前和术后1~2周、3个月行超声心动图检查。测量左室收缩期末、舒张期末容量,计算LVEF以及舒张功能指标,观测二尖瓣环组织多普勒DTI及二尖瓣口血流波形改变;正电子体层显像(PET)(18F标记的脱氧葡萄糖 )评价移植细胞代谢活性:于术前及术后3个月分别进行,计算病变缺损区占左室心肌总面积的百分比。
1.4 临床观察指标
系统临床观察表、NYHA分级、6min步行试验、实验室检查包括肝肾功能、白细胞、CRP、CK-MB、血浆心房利钠肽(atrial natriuretic peptide,ANP)、脑型利钠肽(BNP)、内皮素1(ET-1)测定。
1.5 统计学处理
应用t检验和配对t检验进行统计分析,P<0.05为统计学有差异。
2 结 果
2.1 临床一般资料
由表1可知,两组临床状况比较,包括年龄、性别比例和高血压、糖尿病、高脂血症患病率均无明显差异,吸烟史、介入史、搭桥史、脑卒中史也无差异,均有陈旧性心肌梗死病史;超声室壁瘤移植组9例,对照组3例,附壁血栓移植组2例,两组均有50%患者心功能NYHA分级为4级;细胞移植组冠状动脉造影:多支病变10例,双支病变10例,单支病变5例,原血管重建2例,本次造影未见明显狭窄;移植组中14例MBMC移植+PCI,13例单纯MBMC移植;对照组14例均拒绝介入检查及治疗。
2.2 MBMC移植前后实验室指标和临床症状的变化
移植组27例患者中,2例在注入细胞悬液时出现室性早搏,均为自限性;2例分别于注入细胞悬液15、30min后出现发冷,30min后好转;该组的肝、肾功能、心肌酶等指标手术前后相比差异不明显,患者的尿量有增多的趋势,NYHA分级则有下降的趋势,而6min步行试验增加明显,见表2。
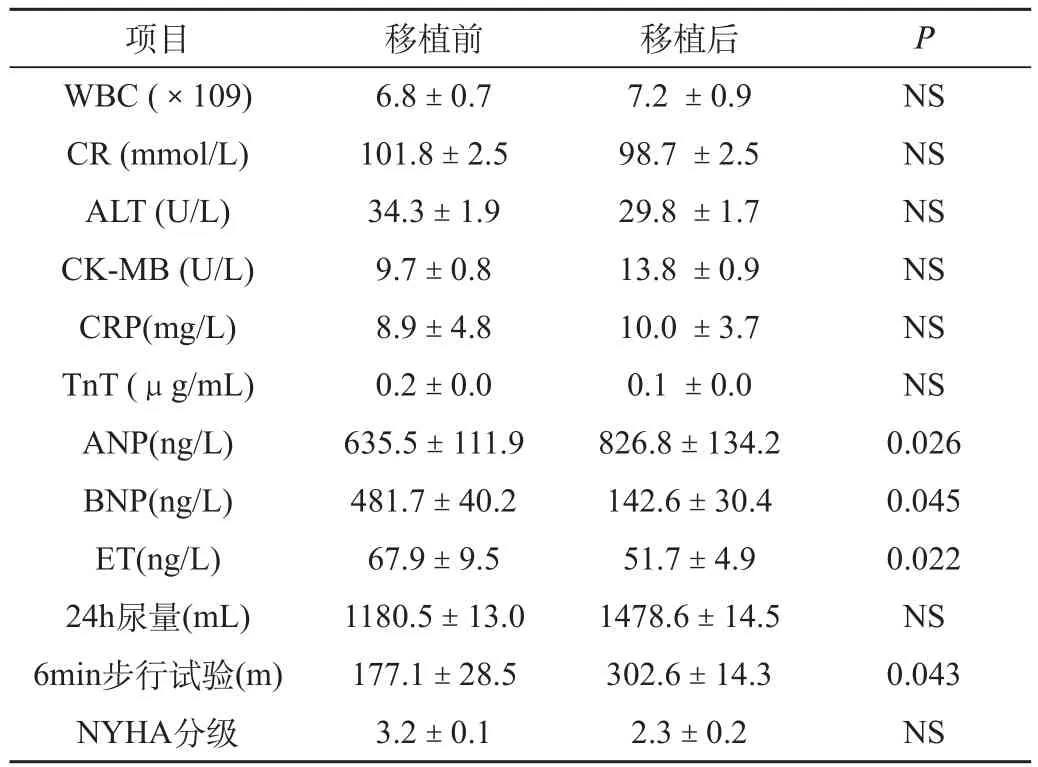
表2 27例MBMC移植前后实验室和临床症状的变化
2.3 MBMC移植前后心肌活力的影响
12(MBMC移植+PCI9例、单纯MBMC移植3例)例完成术前及术后3个月PET随访。对比显示:MBMC移植后3个月原心肌梗死的缺损区明显变小,有代谢活动力的心肌范围增加(10.3±3.4)%,即由(68.3±4.4)%→(78.6±3.3)%,P=0.037(图1)。

图1 MBMC移植前后心肌核素显像
2.4 MBMC移植前后心功能超声心动图改变
MBMC移植1周后即可检出患者的左室收缩功能的改善(表3),主要反映在与移植前相比,患者的LVEF、SV的明显增加及LVESD的减少,而MBMC移植+PCI组与单纯MBMC移植组之间左室功能改善差异无统计学意义(表4),对照组则无明显改善。
表3 移植组与对照组超声心动图心功能比较(±s)
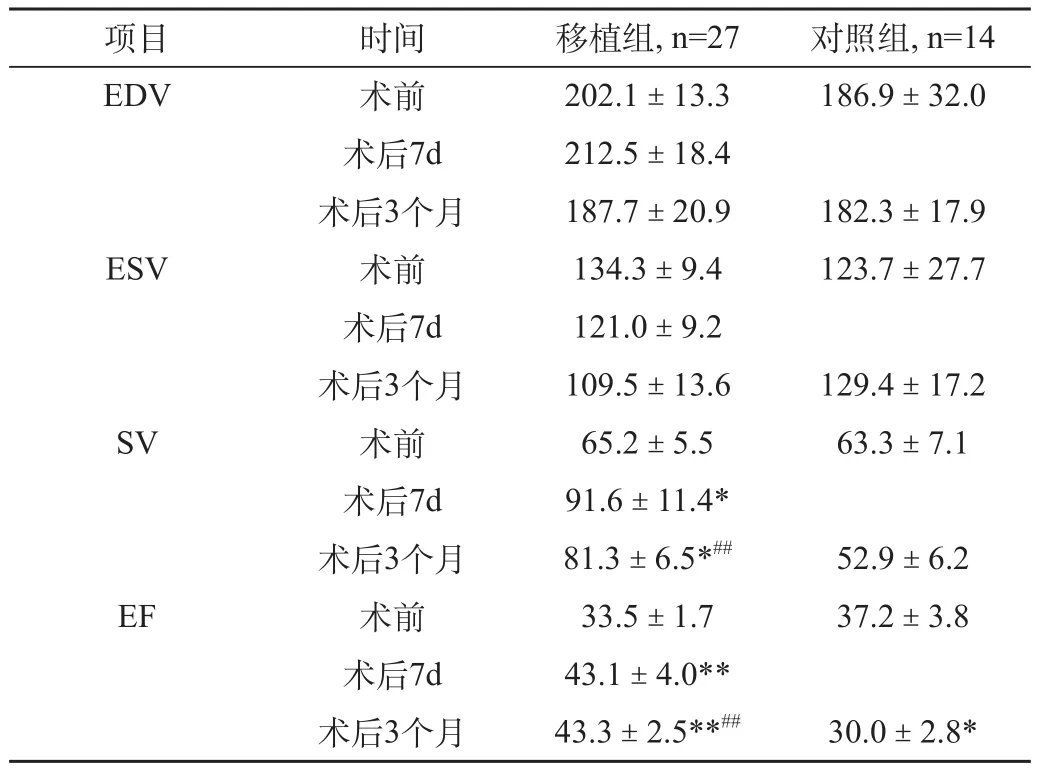
表3 移植组与对照组超声心动图心功能比较(±s)
注:*治疗后vs治疗前 P<0.05,**治疗后vs治疗前 P<0.01 #移植组vs对照组 P<0.05,# #移植组 vs对照组P<0.01
项目 时间 移植组, n=27 对照组, n=14 EDV 术前 202.1±13.3 186.9±32.0术后7d 212.5±18.4术后3个月 187.7±20.9 182.3±17.9 ESV 术前 134.3±9.4 123.7±27.7术后7d 121.0±9.2术后3个月 109.5±13.6 129.4±17.2 SV 术前 65.2±5.5 63.3±7.1术后7d 91.6±11.4*术后3个月 81.3±6.5*## 52.9±6.2 EF 术前 33.5±1.7 37.2±3.8术后7d 43.1±4.0**术后3个月 43.3±2.5**## 30.0±2.8*

表4 单纯细胞移植组与细胞移植组+PCI组心功能比较
二尖瓣环室间隔、侧壁、前间隔、后壁、前壁及下壁6个位点的DTI收缩期s波、舒张早期e波、舒张晚期a波及e/a比值的平均值见表5,细胞移植后,s波的幅度增加比较明显,虽然反映舒张功能的常用指标二尖瓣口血流E/A及二尖瓣环运动波形e/a的改善不显著,但不论是细胞移植组+PCI组,还是单纯细胞移植组的e波幅度均见增大,MVDT也可见延长(图2)。
3 讨 论
近年来研究表明,成年骨髓间充质干细胞(mesenchymal stem cell,MSC)具有多分化和自我更新的潜能。MSC可在梗死心肌中分化为具有心肌特异蛋白、心肌转录因子GATA-4、心肌兴奋收缩耦联因子(connexting43)表达的心肌样细胞[4-6]。有学者报道,经冠状动脉自体MBMC移植治疗急性心肌梗死患者,与常规治疗比较,3个月随访,铊201灌注扫描显示梗死区明显缩小[7];借助一定的感知标识系统对14例严重缺血性心力衰竭患者经心内膜行自体MBMC点状注射移植,术后4个月随访LVEF增加9%,左室收缩末容量减少16%[8]。本组研究根据冠状动脉造影结果合理选用移植径路,以移植细胞最大程度达到靶区域为目的,对41例缺血性心力衰竭患者中的27例进行了自体MBMC移植治疗,手术前后的实验室检查和临床随访表明,该项移植技术的安全性好,不良反应少,临床症状、心功能分级可有明显改善。

表5 单纯细胞移植组与细胞移植组+PCI组DTI指标比较

图2 MBMC移植前后的超声心动图观测
移植7d后超声心动图即可检出LVEF及SV的增加,而同时敏感反应心功能变化的BNP己明显下降,具有强大的利钠、利尿、舒张血管、拮抗肾素-血管紧张素-醛固酮系统的作用[9]的ANP升高;MBMC移植后3个月,伴随原心肌梗死的缺损区变小,有代谢活动力的心肌范围的增加[10],无论是单纯细胞移植组,还是细胞移植组+PCI组的左室收缩进一步好转,左室舒张功能指标也有改善的趋势,由表5可知,二尖瓣环e波的增加尤为明显,s波的增大也是左室收缩功能好转的佐证。
尽管MBMC 治疗EIHF 的机制尚不清楚,但近期的疗效还是明显的,在细胞移植早期,MSC分化过程中在内在环境网络调控下,通过自分泌、旁分泌功能产生和释放大量血管活性肽直接作用心脏及血管,也可解释在细胞移植早期,细胞尚未分化成熟,血管尚未充分再生改善心肌灌注时,心功能即可有改善的可能机理。随着移植细胞的存活,逐渐补充丢失的心肌细胞,修复坏死心肌,再生血管改善灌注,限制或逆转心室重构;移植细胞又可以通过自分泌、旁分泌产生大量血管活性物质、生长因子、细胞因子促进心肌、血管再生,改善心功能[11]。超声心动图可以比较敏感地观测到自体MBMC移植后患者心功能的改善,且观察结果与临床的表现及有关影像学检查比较一致。
由于终末期心力衰竭年生存率仅为50%,自体MBMC经冠状动脉移植,通过补充自体细胞,无伦理道德问题,无免疫排斥反应,不需体外扩增,且价格低廉,不失为一种EIHF治疗的安全有效的新策略;超声则可为MBMC移植效果的评价提供多角度的监测,其可靠性随观察样本的增多、观测手段的改善会有更大的提高。
[1]Mann DL. Mechanisms and models in heart failure: A combinatorial approach[J]. Circulation,1999,100(1): 999-1008.
[2]高连如,田海涛,朱智明,等. 经冠状动脉自体骨髓单个核细胞移植治疗缺血性心力衰竭[J].中国介入心脏病杂志,2005,13(6):386-389.
[3]Califf RM,Adams KF,Mckenna WJ,et al. A randomized controlled trial of epoprostenol therapy for severe congestive heart failure:the Flolan Internationl Randomized trial (FIRST)[J]. Am Heart J,1997,134(1): 44-45.
[4]Kocher AA,Schuster MD,Szabolcs MJ,et al. Neovascularization of ischemic myocardium by human bone-marrow-derived angioplasty prevents cardiomyocyte apoptosis,reduces remodeling and improves cardiac function[J]. Nat Med,2001,7(4): 430-436.
[5]Kamihata H,Mattsubara H,Nishiue T,et al. Implantation of bone marrow mononuclear cells into ischemic myocardium enhances collateral perfusion and regional function via side supply of angioblasts, angiogenic ligand and cytokines[J]. Circulation, 2001,104(9):1046-1052.
[6]朱智明,高连如,王志国,等.骨髓单个核细胞移植修复梗死心肌的实验研究[J].第二军医大学学报,2004,25(1):1-4.
[7]Strauer BE,Brehm M,Zeus T,et al. Repair of infarcted myocardium by autologous intracoronary mononuclear bone marrow cell transplantation in humans[J]. Circulation,2002,106(15): 1913-1918.
[8]Perin EC,Dohmann HFR,Borojevic R,et al. Transendocardial, aut ologous bone marrow cell transplantation for severe,chronic ischemic heart failure[J]. Circulation,2003,107(18): 2294-2302.
[9]Fyhrquist F,Tikkanen I. Atrial Natriuretic peptide in congestive heart failure[J]. Am J Cardiol,1988,62(2): 20A-24A.
[10]Makino S,Fukuda K,Miyoshi S,et al.Cardiomyocytes can be generated from marrow stromal cells in vitro[J]. J Clin Inves,1999,103(5): 697-705.
[11]Singer DRJ,Buckley M,MacGregor G,et al. Raised concentrations of plasma atrial natriuretic peptides in cardiac transplant recipients[J].Br Med J,1986,293(6559): 1391-1392.
