补体C3a对人中巨噬细胞凋亡影响的实验研究*
2010-11-03赵海军张万江吴江东李春柱孟宪杰
赵海军,张万江,吴 芳,王 萍,吴江东,李春柱,孟宪杰
[(1石河子大学医学院第一附属医院检验科;2石河子大学医学院病理生理学教研室/(新疆地方与民族高发病)教育部重点实验室,新疆 石河子 832002]
多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)是危重病救治中最重要的临床问题和主要死亡原因。急性肺损伤(acute pulmomary damage,APD)在MODS中出现早、发生率高,临床上表现为急性呼吸窘迫综合征(Acute respiratory distress syndrome,ARDS)[1]。巨噬细胞是参与APD、ARDS与MODS的主要效应细胞,APD、ARDS与MODS发生的原因之一就是巨噬细胞凋亡延迟[2-5]。在APD发生的炎症级联反应过程中,一方面,通过巨噬细胞的激活、脱颗粒和呼吸爆发,导致了组织细胞的炎症损伤,进而导致APD、ARDS与MODS的发生;另一方面,巨噬细胞凋亡的延迟也参与了APD、ARDS与MODS的发生和发展[2~5]。补体C3a 作为重要的前炎性介质,起炎症启动和放大作用;补体C3a参与了包括APD、ARDS与MODS等在内的许多炎性疾病的进程。有研究显示[6~8],补体C3a既可促使巨噬细胞脱颗粒和呼吸爆发,还能协同其它介质进一步活化白细胞;同时,补体C3a还可通过影响巨噬细胞凋亡而参与APD、ARDS与MODS的发生和发展;为此,本实验通过探讨研究补体C3a对巨噬细胞凋亡的影响,为APD、ARDS与MODS救治提供新的思路。
1 材料与方法
1.1 材料
1.1.1 仪器 流式细胞仪(BECKMAN-COULTER XL4美国),CO2恒温孵箱(RKJ,日本),超净工作台(中国上海),台式高速离心机(Sigma),倒置显微镜(Nikon,日本)
1.1.2 主要试剂 rhC3a和Histopaque 1077/1119(Sigma),Annevix-V FITC and PI 凋亡试剂盒(Beckman Coulter),RPMI-1640 培养基(含 100 U/mL青霉素,100U/mL链霉素,10%的胎牛血清,20 mmol/L的L-谷氨酰胺)胎牛血清(Gibco)。
1.2 方法
1.2.1 人巨噬细胞培养与制备 THP-1细胞株购自中国医学科学院肿瘤研究所。细胞生长培养基采用含10%FBS的RPMI-1640培养基,每周换液2次。取对数生长期的细胞用于试验,台盼兰染色做活细胞测定,活细胞比率大于95%。试验前离心细胞,重悬于含10%FBS的RPMI-1640培养液,调整细胞浓度为1×106/mL。加入PMA使其终浓度为60 ng/mL,48 h后细胞分化贴壁,更换新鲜培养液。
光镜下见分化前THP-1单核细胞呈球形,悬浮生长并呈无限制繁殖。加入佛波脂(PMA)72 h后,见细胞全部贴壁生长,呈不规则形状,体积明显增大,伸出伪足,提示巨噬细胞形成。
1.2.2 实验分组 计数巨噬细胞数量,调整巨噬细胞浓度为1×106/mL,在含不同刺激剂的RPMI-1640培养基中,37℃、5%二氧化碳的条件下培养,分组实验。实验分4组:补体C3a浓度为0.5μg/mL的巨噬细胞刺激组、补体C3a浓度为1μg/mL的巨噬细胞刺激组、补体C3a浓度为2μg/mL的巨噬细胞刺激组和空白对照组。
1.2.3 巨噬细胞凋亡的定量检测 用4℃的PBS洗涤待测的巨噬细胞2次,用100μL结合缓冲液重新悬浮细胞,调节细胞浓度为 1×106/mL,取100μL的细胞悬液于5mL流式管中,加入5μL Annexin V/FITC和5μL 20μg/mL的PI液,摇匀后于室温避光孵育15min,在反应管中加入400μL结合缓冲液,1 h、7 h、24 h分别上流式细胞仪检测巨噬细胞凋亡指数,1 000个/s,总共检测10 000个。
1.2.3 统计分析 结果采用SPSS 13.0统计软件进行双因素析因分析、单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 人巨噬细胞培养与制备
人THP-1细胞培养,悬浮生长,呈圆形(图1,2)。

图1 人THP-1细胞培养照片(10×10)

图2 人THP-1细胞培养照片(10×40)
人THP-1细胞经PMA诱导后培养照片,贴壁生长,呈梭形(图 3,4)。
图3 人THP-1细胞加入PMA 48 h后培养照片(10×40)
图4 人THP-1细胞加入PMA 48 h后培养照片(10×40)
2.2 补体C3a依浓度对人巨噬细胞凋亡的影响
以补体C3a浓度为0.5、1和2μg/mL的人巨噬细胞刺激组,其对人巨噬细胞的凋亡率分别为(37.90±2.09)%、(34.52±2.27)%和(32.47±1.65)%;与凋亡率为(57.13±2.89)%的空白对照组相比,均有明显的差异(P<0.01);依补体C3a浓度人巨噬细胞凋亡率呈下降趋势,0.5μg/mL与2μg/mL组对比有差异(P=0.04<0.05);详见图 5所示。
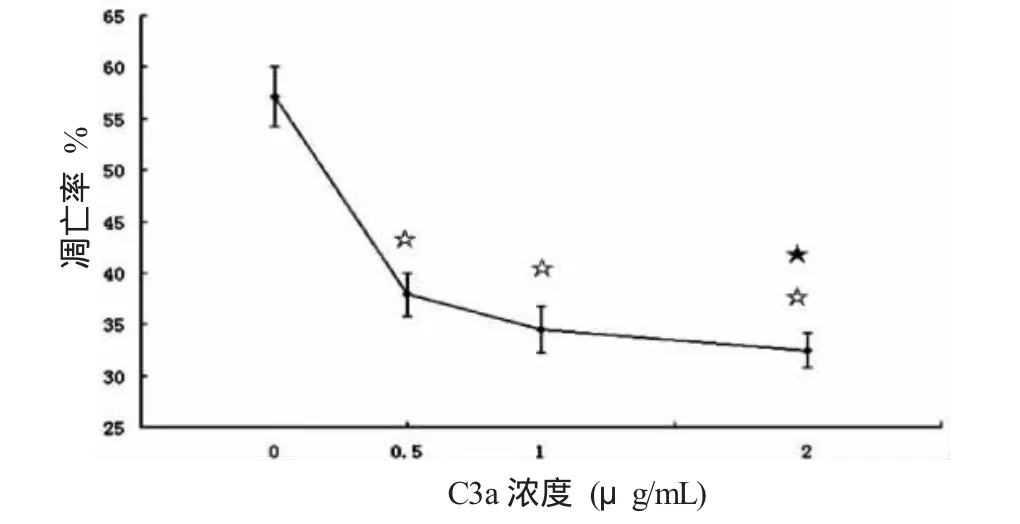
图5 不同浓度补体C3a刺激人巨噬细胞7 h后其凋亡率的变化(n=3)
2.3 补体C3a刺激依时间对人巨噬细胞凋亡的影响
图6显示:空白组7 h凋亡率为(59.63±2.46)%,24 h后升至(72.15±3.57)%,两者对照有显著差异;补体 C3a组7h凋亡率(34.81±2.28)%,24 h后升至(42.17±3.82)%,两者对照有差异。图6显示,补体C3a组与空白组比较,7 h至24 h凋亡率增加的幅度变小,且有统计学差异。
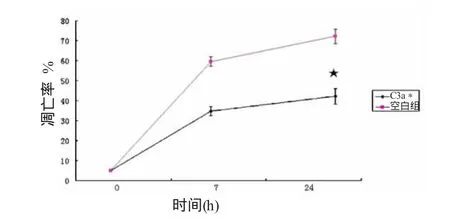
图6 补体C3a刺激人巨噬细胞随时间其凋亡率的变化(n=3)
3 讨论
巨噬细胞是参与APD、ARDS与MODS的主要效应细胞,APD、ARDS与MODS发生的原因之一就是巨噬细胞凋亡延迟[2~5]。巨噬细胞的凋亡控制着炎症反应的时间和强度,巨噬细胞凋亡的调节是炎症的进展和消退的关键因素,而凋亡紊乱与包括APD、ARDS与MODS在内的多种急慢性炎症性疾病相关[9,10]。研究证实,APD、ARDS与 MODS发病时渗出至肺组织的巨噬细胞存在凋亡延迟[3];PARSEY[11]通过动物实验研究证实,在炎症早期巨噬细胞凋亡是受抑制的。SOOHAI[4]发现,随着巨噬细胞凋亡的增强,缺血/再灌注损伤导致的肺损伤程度明显减轻。TAKESHI[5]研究发现,使用连续性肾脏替代治疗技术,可通过清除患者血清炎症因子(IL-1,IL-8,TNF-α)明显改善巨噬细胞的凋亡延迟,且与组织器官损伤评分相关的。
补体C3a是补体系统级链反应的终末产物,由86个氨基酸组成,补体C3a通过其受体补体C3aR而产生生物学效应。C3a为重要的前炎性介质,起炎症启动和放大作用,补体C3a参与了包括MODS、ARDS与APD等在内的许多炎性疾病进程[6~8]。补体C3a趋化巨噬细胞,也可直接或间接活化巨噬细胞释放弹性蛋白酶、活性氧和炎症因子等而损伤肺组织[12],创伤后发生APD、ARDS与MODS的患者血浆和支气管灌洗液中补体C3a浓度显著增高,且其升高的水平与患者的创伤评分呈正相关[13]。
本实验结果显示,补体C3a能明显抑制人巨噬细胞凋亡,且随浓度增加抑制作用有增强的趋势,与既往的实验结果相一致;本实验不论对照组和刺激组的凋亡率和已有实验相比均明显升高,这与以往较多实验是使用PI染色主要观察晚期凋亡,而本实验使用Annevix-PI双染色法,可同时检测早中晚期凋亡有关。此外,应用不同浓度的补体C3a刺激,其凋亡率无显著差异。一方面,提示补体C3a浓度为0.5μg/mL,刺激已达饱和浓度,另一方面,也可能是刺激时间短,抑制作用体现不足。此外,样本数少也可能使差异未显现。
本实验还显示:巨噬细胞凋亡随时间而增加,7 h凋亡率为(59.63±2.46)%,24 h时即升至(72.15±3.57)%,两者对照有显著差异;但24 h的巨噬细胞凋亡增加幅度明显为低。补体C3a刺激7 h组凋亡率(34.81±2.28)%,随着补体C3a刺激时间的延长,其抑制巨噬细胞凋亡的作用持续存在,24 h后升至(42.17±3.82)%;与补体C3a刺激7 h相比,24 h的巨噬细胞凋亡显著增加,但幅度也明显为低。这与本实验的空白对照组和已有实验结果趋势相一致。上述结果显示了补体C3a刺激后巨噬细胞凋亡存在时间依赖关系。
综上所述,本研究显示补体C3a抑制巨噬细胞凋亡存在浓度及时间依赖关系;补体C3a延长巨噬细胞的炎性反应的时间,可能由此导致炎症失控和消散延迟,从而参与了APD、ARDS与MODS的发生发展。
[1]韩守信,陈复辉,周 丹,等.急性肺损伤中性粒细胞凋亡异常及早基强的松龙调控的研究 [J].中国现代医学杂志,2007,17(2):167-171.
[1]HAN SX,CHEN FH,ZHOU D,et al.Abnormality of PMA apoptosis and effect of methylpredhisolone in acute lung iniury induced by administrating oleic acid[J].China journal of modern meoicine,2007,17(2):167-171.Chinese
[2]BERNARD GR,ARTIGAS A,BRIGHAM KL,et al.Report of the American-European consensus conference on ARDS:definitions, mechanisms,relevant outcomes, and clinical trial coordination.Intensive Care Med,2006;20:225-236.
[3]GOANNOUDIS PV.Current concepts of the inflammatory response after major trauma:an update[J].Injury,2008,34(6):397-404.
[4]SOOKHAI S,WANG JJ,MC COURT M,et al.A novel therapeutic strategy for attenuating neutrophil-mediated lung injury in vivo[J].Ann Surg,2009,235(2):285-291.
[5]HIRANO T,HIRASAWA H,ODA S,et al.Modulation of polymorphonuclear leukocyte apoptosis in the critically ill by removal of cytokines with continuous hemodiafiltration [J].Blood Purif,2007,22(2):188-197.
[6]HUBER-LANG MS,YOUNKIN EM,SARMA JV.et al.Complement-induced impairment of innate immunity during sepsis[J].J Immunol 2006;169(6):3223-3231.
[7]NIEDERBICHLER AD,HOESEL LM,WESTFALL MV,et al.An essential role for complement C3a in the pathogenesis of septic cardiac dysfuntion.The Journal of Experimental Medicine 2006;203(1):53-61.
[8]PETER A.Ward.The dark side of C3a in sepsis[J].Nature immunology.2007,4:133-142.
[9]JIMENEZ MF,WATSON WG,PARODO J,et al:dysregulated expression of neutrophil apoptosis in the systemic inflammatory response syndrome[J].Arch Surg,2007,132:1263-1270.
[10]DROEMANN D,ARIES SP,HANSEN F,et al.decreased apoptosis and increased activation of alveolar neutrophils in bacterial pneumonia[J].Chest,2006,117:1679-1684.
[11]PARSEY MV,KANEKO D,SHENKAR R,et al.Neutrophil apoptosis in the lung after hemorrhage or endotoxemia:apoptosis and migration are independent of IL-1belta[J].Clin Immunol,2008,91(2):219-225.
[12]SHOWELL HJ,GLOVSKV MM.WARD PA.C3a-induced lysosomal enzyme secretion from human macrophages[J].Int arch allergy immunol.2007;67:227.
[13]FOSSE E,PILLGRAM-LARSEN,SVENNEVIG JL,et al.Complement activation in injured patients occurs immediately and is dependent on the severity of the trauma[J].Injury.2008,29(7):509-514.
