甘精胰岛素对糖尿病大鼠主动脉结构及TGF-β1、III型胶原表达的影响
2010-11-03金秀平
金秀平,谷 巍
(华北煤炭医学院附属医院 内分泌科,河北 唐山 063000)
糖尿病引起动脉粥样硬化(atherosclerosis AS)发病早、发病率高、病情进展快,是糖尿病主要死亡原因。本研究旨在观察甘精胰岛素对糖尿病大鼠主动脉结构及TGF-β1、III型胶原表达的影响。
1 材料与方法
1.1 材料与仪器
雄性Wistar大鼠50只,体重180~220克(华北煤炭医学院动物中心),STZ(美国sigma公司),甘精胰岛素(长秀霖),Masson特染试剂盒(福州迈新生物技术公司),免疫组化试剂盒(武汉博士德生物工程公司)。
1.2 方法
1.2.1 动物模型建立 50只大鼠随机分对照组10只、实验组40只。实验组造模前禁食12 h,按65 mg/kg腹腔注射STZ,对照组注射相应体积0.1mol/L无菌柠檬酸缓冲液。注射后分别于3 d、1周同一时间剪尾测血糖,血糖≥16.7mmol/L为糖尿病大鼠模型成立。造模过程中2只死亡。将造模成功38只随机分糖尿病组19只、胰岛素组19只。糖尿病组不给任何治疗,常规喂养。胰岛素组给予甘精胰岛素1.5 U/kg/d,根据血糖监测调整胰岛素剂量,维持血糖在8mmol/L左右。
1.2.3 生化指标的检测 各组分别于造模前,造模后1周、治疗后1、2、4周测体重,剪尾测血糖。治疗后4周日立全自动生化分析仪酶法测血清TG、TC、LDL-C、HDL-C。
1.2.4 免疫组化测定 采用免疫组化试剂盒,SABC法,免疫组化图象分析经标准灰度校正,随机取5个视野,同等条件下测TGF-β1及III型胶原平均积分光密度值IDP。
2 结果
2.1 大鼠体重及各项实验室指标改变
造模前各组体重、血糖、血脂无明显差异(P>0.05)。造模后1周比对照组血糖明显升高(P<0.01),体重明显下降(P<0.01),治疗后1周胰岛素组比糖尿病组,血糖明显下降(P<0.01),体重明显升高(P<0.01),治疗后4周糖尿病组比对照组血脂明显增高(P<0.05),胰岛素组比糖尿病组血脂明显下降(P<0.05)。结果见表1-3。
表1 各组大鼠不同时期体重变化比较(g,±s)
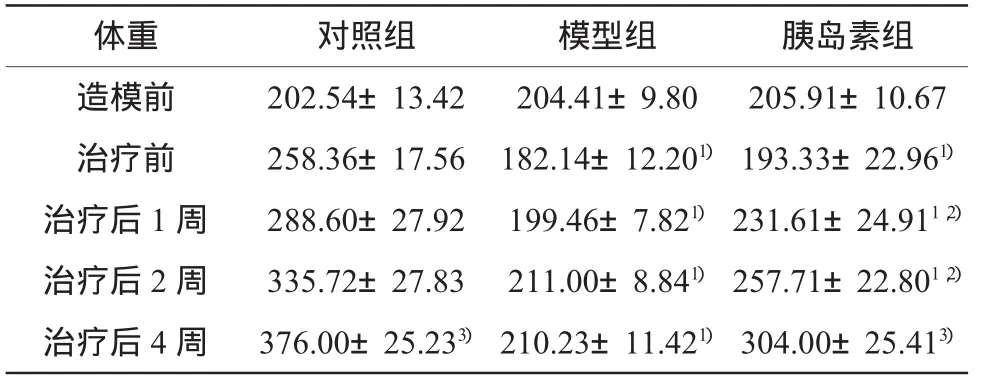
表1 各组大鼠不同时期体重变化比较(g,±s)
注:1)与对照组相比,P<0.01;2)与模型组相比,P <0.01;3)同组相比,P <0.05
体重 对照组 模型组 胰岛素组造模前 202.54±13.42 204.41±9.80 205.91±10.67治疗前 258.36±17.56 182.14±12.201) 193.33±22.961)治疗后1周 288.60±27.92 199.46±7.821) 231.61±24.911,2)治疗后2周 335.72±27.83 211.00±8.841) 257.71±22.801,2)治疗后 4周 376.00±25.233) 210.23±11.421) 304.00±25.413)
表2 各组大鼠不同时期血糖情况变化比较(±s,mmol/L)

表2 各组大鼠不同时期血糖情况变化比较(±s,mmol/L)
注:1)与对照组相比,P<0.01;2)与模型组相比,P <0.01
血糖 对照组 模型组 胰岛素组造模前 6.62±0.47 6.61±0.76 6.62±0.67治疗前 6.18±0.47 28.27±4.191) 30.91±1.951)治疗后 1周 6.51±1.22 31.07±2.981) 16.15±7.801,2)治疗后2周 6.56±0.77 32.04±1.541) 10.34±7.252)治疗后4周 6.32±0.80 32.18±1.331) 6.91±3.582)
表3 各组大鼠血脂情况比较(±s,mmol/L)
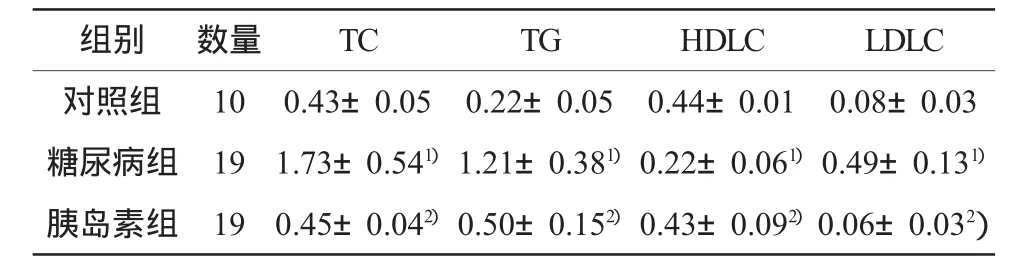
表3 各组大鼠血脂情况比较(±s,mmol/L)
注:1)与对照组比,P <0.05;2)与糖尿病组比,P <0.05
组别 数量 TC TG HDLC LDLC对照组 10 0.43±0.05 0.22±0.05 0.44±0.01 0.08±0.03糖尿病组 19 1.73±0.541) 1.21±0.381) 0.22±0.061) 0.49±0.131)胰岛素组 19 0.45±0.042) 0.50±0.152) 0.43±0.092) 0.06±0.032)
2.2 主动脉光镜观察
HE染色见图1,Masson染色见图2。
对照组:内膜平坦,内皮细胞扁平,中层平滑肌细胞整齐排列,平滑肌细胞间有少量胶原纤维。糖尿病组:内膜增厚,局部有内皮细胞脱落,中层平滑肌排列紊乱,可见少量体积大、胞浆空的泡沫细胞,胶原纤维增多。胰岛素组:内膜较厚,内皮细胞脱落较少,中层平滑肌细胞平行排列,胶原增多不明显。采用计算机图像分析系统进行半定量分析测内膜厚度及中膜厚度(表4):糖尿病组比对照组内膜厚度及内膜/中膜厚度明显升高(P<0.05),胰岛素组比糖尿病组明显降低(P<0.05)。同时,比较各组胶原面积占统计总面积百分比(表5):糖尿病组比对照组胶原面积明显升高(P<0.05),胰岛素组比糖尿病组明显降低(P<0.05)。
表4 各组大鼠主动脉内膜厚度及中膜厚度情况比较(±s)

表4 各组大鼠主动脉内膜厚度及中膜厚度情况比较(±s)
注:1)与对照组比,P <0.05;2)与糖尿病组比,P <0.05
组别 数量 IMT(μm) IMT/IFT(%)对照组 10 4.56±1.01 3.21±1.05糖尿病组 19 21.61±3.611) 15.25±1.061)胰岛素组 19 12.61±1.611,2) 6.84±1.671,2)
表5 各组大鼠主动脉胶原面积占统计总面积百分比(±s)
注:1)与对照组比,P <0.05;2)与糖尿病组比,P <0.05;
组别 数量 胶原面积/统计血管总面积(%)对照组 10 2.46±1.09糖尿病组 19 38.19±6.561)胰岛素组 19 18.98±5.611,2)
2.3 主动脉透射电镜观察
对照组:内皮细胞扁平,细胞间可见完整紧密连接,内弹性膜完整。糖尿病组:内膜明显增厚,内皮细胞脱落,细胞核分裂,内弹性膜不连贯。胰岛素组:内皮细胞较完整,表面粗糙,细胞间可见细胞连接结构,内弹性膜完整,结果见图3。
2.4 免疫组化结果:TGF-β1及III型胶原的表达
阳性结果(TGF-β1表达在细胞浆和细胞间,III型胶原表达在平滑肌细胞浆和细胞间)显棕黄色,正常大鼠组织切片作为阴性对照。TGF-β1:糖尿病组(0.0987±0.0198)比对照组(0.0179±0.0018)表达明显升高(P<0.05),胰岛素组(0.0198±0.0019)比糖尿病组表达明显降低(P <0.05);III型胶原:糖尿病组(0.0457±0.0128) 比对照组(0.0138±0.0020)表达明显升高(P<0.05),胰岛素组(0.0130±0.0029)比糖尿病组表达明显降低(P<0.05),见图 4、图 5。
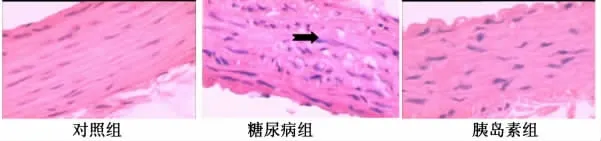
图1 主动脉HE染色(×400)

图2 主动脉Masson染色(×400)

图3 主动脉电镜

图4 各组主动脉免疫组化TGF-β1表达情况

图5 各组主动脉免疫组化III型胶原表达情况
3 讨论
AS是糖尿病大血管病变病理基础[1],动脉平滑肌细胞增生是AS重要组成部分,内膜平滑肌灶性增生是AS最早可识别形态学变化[2]。研究显示,STZ造模4周后,透射电镜观察到糖尿病组大鼠主动脉内皮细胞大面积脱落,中膜浅层平滑肌细胞明显增生活跃并向内膜层迁移,平滑肌周围有大量胶原纤维增生,提示糖尿病主动脉结构发生了病理改变。非酶糖化蛋白终末产物(AGE)导致胶原的绞连,基底膜增厚,并可与特异AGE受体结合,促进某些细胞因子释放,如高血糖与AGE均可刺激TGF-β1合成[3]。TGF-β1是一种多功能细胞因子,主要作用是调节细胞外基质(ECM)形成,使成纤维细胞合成胶原、层粘连蛋白等[4]。研究显示,TGF-β1在糖尿病大鼠主动脉中表达明显增高,血管平滑肌细胞间III型胶原表达也增高,表明高血糖通过TGF-β1促使ECM增生,进而促进中层平滑肌细胞增生并向内膜迁移。
胰岛素能降低血糖,抑制脂肪分解,美国学者研究还发现,胰岛素具有抗炎及抗动脉粥样硬化作用[5]。甘精胰岛素(insulin glargin〔GlyA21,Arg-B31,ArgB32〕)是超长效胰岛素类似物,目前已应用于临床。它是利用重组DNA技术生产的生物合成人胰岛素类似物。本研究中,糖尿病大鼠注射甘精胰岛素后,主动脉病理改变明显减轻,血糖、血脂下降,血管壁TGF-β1及collagen III表达明显降低,提示甘精胰岛素可能通过降低血糖、血脂,下调TGF-β1及collagen III表达,从而抑制主动脉内ECM增生,改善糖尿病大血管病变,但具体作用机制有待进一步研究。
[1]SANZ PARIS A,GAMBOA RA,USON JP,CELAYA PEREZ S.New dietetic recommendations in diabetes mellitus:the implications in enteral nutrition.Nutr Hosp,1995,10(3):143-151
[2]STOUT RW.Hyperinsulinemia and atherosclerosis.Diabetes,1996 Jul;45 Suppl 3;S45-6
[3]HAO FENG,YU Jinde.High glucose enhance expression of matrix metalloproteinase-2 in smooth muscle cells[J].Acta Pharmacol Sin,2003,24(6):534–538
[4]ZIYADEL FN,SHERMA K,ENICKSEN M.et al.Stimulation of collagen game expression and protein synthesis in murine mesangial cells by acti vation of transforming growth factor- B1 JClinlnvest 1994,93:536.
[5]ROSS R,et al.The responsets injury and atherosclerosis:the rote of endothelium and smooth muscle.Atheroscleresis 1987,8(6):69.
